
- •Методическая разработка к практическому занятию № 1 (для преподавателей)
- •Контрольные вопросы по теме занятия
- •8.1. Биохимия - определение как науки
- •8.3. Биохимия человека (медицинская). Что изучает, понятие о статической, динамической, функциональной биохимии, основные достижения.
- •Биохимические исследования, направленные на выявление причин заболеваний
- •Изучение болезней способствует развитию биохимии
- •Изучение низших организмов и вирусов
- •8.4. Цель и задачи курса биохимии в медицинской академии как базовой медицинской науки, ее роль в освоении знаний студентами других дисциплин и в формировании врача любого профиля.
- •Биохимия и другие биологические науки
- •8.5. Достижение кафедры биохимии и направления ее работы (коротко).
- •8.6. Возможности кафедры для участия в студенческом научном обществе (сно).
- •Понятие о метаболизме, метаболических путях,
- •1. Выделение биомолекул.
- •Иерархическая последовательность препаратов, используемых для изучения биохимических процессов.
- •8.10. Биохимический материал, его виды, методы получения.
- •8.11. Метод дифференциального центрифугирования: причины, виды центрифуг, правила работ, получение фракций крови.
- •Рефрижераторные высокоскоростные центрифуги
- •8.12. Метод гомогенизирования, причины, назначение. Приготовление гомогенатов тканей и органов.
- •8.13. Метод фракционирования гомогенатов, назначение.
- •Субклеточное фракционирование
- •8.15. Хроматографический анализ: классификация, назначение. Тонкослойная хроматография: принципы, назначение.
- •Классификация типов хроматографического анализа.
- •8.17. Спектрофотометрия: принцип, назначение.
- •8.18.А Полярография
- •8.19. Электрофорез: принцип метода, назначение.
- •8.20. Автоматические анализаторы: принцип действия, назначение, достоинства.
- •Используются разработки Мещанинова в.Н. По определению биологического возраста у людей в стадии предболезни.
- •Заключение
- •Основная
- •Дополнительная
- •Инструкция по работе с фотокалориметром кфк-2мп
- •Инструкция по работе с фотокалориметром кфк-2
8.10. Биохимический материал, его виды, методы получения.
Наиболее распространенным материалом для клинико-лабораторных исследований являются кровь и моча. В качестве биологического материала используют также другие жидкости организма: спинномозговую, слезную, лимфу. В качестве биологического материала используют биоптаты тканей и кал.
Получение биологического материала.
Кровь рекомендуется брать утром после 8-12 часового голодания. Если требуется получить плазму - в пробирку заранее вносят антикоагулянт для предохранения крови от свертывания. В зависимости от цели и задач применяют следующие антикоагулянты: аксалат натрия, ЭДТА, гепарин, тринатрий цитрат и др. Для получения сыворотки - антикоагулянт не добавляют, а пробирки с кровью закрывают ватной пробкой и помещают в термостат на 10-15 минут (t= 37°C). Сгусток фибрина отделяют от стенок пробирки стеклянной палочкой или стальной спицей, сыворотку переливают в центрифужную пробирку и центрифугируют 10 минут при 1500 об/мин. Считается, что объем выделяемой сыворотки составляет примерно 1/3 взятого объема крови.
В процессе выполнения экспериментов на животных (примеры кафедральных научных работ) с целью изучения метаболизма в тканях получают экстракты тканей и клеточные органеллы.
После декапитации крыс и взятия крови, изучаемые ткани немедленно помещают в жидкий азот для прекращения работы ферментных систем. Делают навеску ткани, которую растирают в кислотах (ТХУ или НClО4) – происходит кислотная денатурация ферментов. После центрифугирования полученный экстракт нейтрализуется КНСО3 или NaOH. Приготовленный таким образом образец может быть использован например для определения концентрации метаболитов ЦТК, ПФП, гликолиза. Часть образца, используемая для аналитического определения содержащихся в нем компонентов, обозначается как проба.
Применяя микроизмельчители тканей, получают тканевую «кашицу», которую затем гомогенезируют в гомогенезаторе Поттера. Приготовленные подобным образом гомогенаты подвергаются дифференциальному центрифугированию в градиенте сахарозы для выделения субклеточных структур.
Для этой цели используют рефрижераторные высокоскоростные центрифуги.
8.11. Метод дифференциального центрифугирования: причины, виды центрифуг, правила работ, получение фракций крови.
Субфракционирование гомогената путём дифференциального центрифугирования – это один из наиболее важных методов биохимии. В классическом случае используются три стадии центрифугирования при возрастающих скоростях. В ходе каждой из них образуются осадок и надосадочная жидкость (супернатант). Супернатант, полученный на каждой из стадий, подвергается центрифугированию на следующей стадии. В результате этой процедуры образуются три типа осадков, которые называются ядерной, митохондриальной и микросомной фракциями. Ни одна из этих фракций не представляет собой абсолютно чистые органеллы. Однако с помощью электронного микроскопа, а также путём идентификации соответствующих «маркерных» ферментов и химических компонентов (например, ДНК или РНК) было установлено, что главными компонентами этих трёх фракций являются ядра, митохондрии и микросомы соответственно. «Маркерный» фермент или химическое соединение – это тот компонент, который присутствует практически только в составе данного типа органелл; например, кислая фосфатаза находится в лизосомах, а ДНК – в ядре. Таким образом, маркер служит индикатором присутствия или отсутствия фракции тех органелл, в составе которых он находится. Микросомная фракция (микросомы) представляют собой в основном смесь фрагментов гладкого эндоплазматического ретикулума, шероховатого эндоплазматического ретикулума (т. е. эндоплазматического ретикулума с присоединёнными к нему рибосомами) и свободных рибосом. Содержимое супернатанта, полученного на конечной стадии, приблизительно соответствует составу клеточного сока (цитозоля). Модификации этого основного подхода, основанные на использовании различных сред для гомогенизации, разных условий или методов центрифугирования (например, использование непрерывного или ступенчатого градиента сахарозы), позволили выделить в более или менее чистом виде все органеллы. Описанная выше схема применима к большинству органов и клеток, однако в каждом случае для стандартизации процедуры субклеточного фракционирования необходимо провести серию анализов на содержание маркерных ферментов или других химических компонентов, а также выполнить электронно-микроскопические наблюдения.
 Супернатант
(3)
Супернатант
(3)




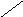
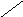 Супернатант
(1) Супернатант (2)
Супернатант
(1) Супернатант (2)
 600 g
600 g
 15000g
105000 g
15000g
105000 g
x 10 мин x 5 мин x 60 мин



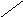 Гомогенат
Гомогенат
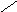
 Ядерная
фракция Митохондри-
Ядерная
фракция Митохондри-
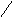 альная
альная
фракция
Микросомная
фракция
Схема разделения субклеточных фракций с помощью дифференциального центрифугирования. Гомогенизированную ткань (например, печень) сначала центрифугируют при малой скорости, что приводит к осаждению ядерной фракции (содержащей ядро и неразрушенные клетки) и отделению супернатанта (1). Супернатант осторожно сливают (декантируют) и проводят центрифугирование при более высокой скорости, в результате чего разделяются митохондриальная фракция (содержащая митохондрии, лизосомы и пероксисомы) и супернатант (2). Последний декантируют и центрифугируют при более высокой скорости, в результате чего формируется микросомная фракция (содержащая смесь свободных рибосом и фрагментов гладкого и шероховатого ЭПР) и отделяется чистый прозрачный раствор – конечный супернатант (3). Последний представляет собой цитозоль, или клеточный сок. Используя различные модификации представленного здесь подхода, обычно выделяют каждую из клеточных органелл в относительно чистом виде.
