
- •Отдельное спасибо ребятам со второго потока лечебного факультета 2012 г.
- •1)Мультиферментные комплексы и изоферменты. Кдз определения активности изоферментов. Энзимодиагностика. Ферментативные лекарственные препараты.
- •2) Окисление жирных кислот. Внутриклеточная локализация и биоэнергетика процесса. Особенности обмена жк с нечетным количеством углеродных атомов и ненасыщенных жк.
- •3) О каком заболевании следует думать, если моча новорожденного ребенка дает положительную реакцию на наличие фенилпирувата? Какой молекулярный блок лежит в основе данной патологии?
- •1)Классификация ферментов. Общая характеристика класса лиаз. Коферменты лиазных рекций.
- •2) Регуляция липидного обмена. Гормоны влияющие на обмен липидов. Патология липидного обмена : гиперлипидемия, атеросклероз, липоидозы, жировое перерождение печени, ожирение.
- •1)Классификация гормонов по локализации рецеторов. Вторичные посредники действия гормонов.
- •2) Гемоглобин, его структура, синтез, виды. Гемоглобинозы.
- •1)Белки плазмы крови, место их синтеза, биологическая роль. Изменение белкового спектра сыворотки при различных заболеваниях. Белки острой фазы.
- •2) Глюкоза крови. Пути ее поступления и использования. Гексокиназная реакция – клучевая реакция углеводного обмена. Пусти превращения глюкозо-6-фосфата.
- •1)Дыхательная цепь. Ферментные комплексы дыхательной цепи, их локализация. Редокс-потенциалы ферментных систем. Ингибиторы переноса электронов.
- •2) Адреналин и норадреналин, их синтез и влияние на обмен веществ.
- •1)Особенности обмена в эритроцитах. Эритроцитарные энзимопатии. Синтез гема. Порфирин.
- •3) Оцените состояние больного по следующим данным анализа крови и мочи: глюкоза крови – 10,0 ммоль/л, рН крови – 7,30, в моче обнаружены глюкоза, кетоновые тела.
- •1)Эндокринная система оргранизма. Классификация гормонов по химической структуре, их роль в регуляции обменных процессов. Причины эндокринных заболеваний. Механизм действия гормонов.
- •Причины заболеваний эндокринной системы.
- •1)Биологические мембраны, их структурные компоненты. Функции биологических мембран.
- •2) Патология углеводного обмена. Сахарный диабет. Нарушение углеводного и липидного обмена при этом заболевании.
- •1. Гипергликемия вызвана:
- •3) В крови больного повышена активность липазы, амилазы, трипсина. О какой патологии следует думать? Какие реакции катализируются данными ферментами?
- •1) Классификация ферментов. Общая характеристика класса трансфераз. Основные подклассы. Коферменты трансферазных реакций.
- •2)Напишите последовательность реакций превращения ацетил-КоА в мевалоновую кислоту в процессе синтеза холестерина. Укажите ферменты и коферменты.
- •3) Биохимический анализ нормальной и патологической мочи. Глюкозурия, протеинурия, кетонурия, билирубинурия.
- •2) Витамины, их классификация. Витамин в12 и фолиевая кислота, участие в обмене веществ и признаки витаминной недостаточности.
- •3) Какие изменения белкового спектра будут наблюдаться при остром воспалении? Что такое белки «острой фазы»? Диагностическое значение определения их концентрации в крови.
- •1)Роль воды в организме. Водный баланс, его регуляция и патология. Макроэлементы: натрий, калий, хлор, магний.
- •2) Биосинтез днк (репликация). Биосинтез рнк (транскрипция). Посттранскрипционный процессинг рнк. Основные положения аминокислотного кода. Обратная транскрипция.
- •2)Витамин в6, биотин, их химическая структура и признаки витаминной недостаточности. Участие в обмене веществ.
- •3)Будет ли протекать глюконеогенез, если в клетке цитратный цикл и дыхательная цепь полностью ингибированы. Ответ поясните.
- •1)Классификация и характеристика сложных белков (липопротеины, хромопротеины, гликопротеины, нуклеопротеины, фосфопротеины).
- •2) Вторичный липолиз триглицеридов. Окисление глицерина до конеч¬ных продуктов (со2 и н2о). Биоэнергетика процесса.
- •1)Структура гликогена, синтез и распад гликогена в печени и мышцах. Гликогенозы.
- •2) Изогидрия. Механизмы поддержания изогидрии. Ацидоз и алкалоз.
- •3) Сипмтомами авитаминоза в1 является расстройство нервной систе¬мы, потеря памяти, изменение психики. Почему к дефициту витамина в1 особо чув¬ствительна центральная нервная система?
- •1)Паратгормон и тиреокальцитонин. Влияние гормонов на обмен кальция и фосфора в организме человека
- •2) Сопряжение обмена углеводов и липидов. Сопряжение обмена углеводов и аминокислот. Пути превращения и образования пировиноградной кислоты.
- •1)Обмен и биологическое значение серосодержащих аминокислот (метионин и цистеин). Участие метионина в реакциях трансметилирования. Молекулярная патология обмена этих аминокислот.
- •2) Микроэлементы: селен, цинк, марганец, стронций, фтор, йод, молибден. Микроэлементозы.
- •3) Оценить состояние больного, если: рН крови - 7,31, рН мочи - 4,8. Общее содержание со2 в крови повышено. РСо2 - 80 мм рт ст. Титрометрическая кислотность мочи повышена.
- •1)Основные пути обмена аминокислот: декарбоксилирование, дезаминирование. Биологическая роль биогенных аминов.
- •2) Витамины р и с, их структура, признаки витаминной недостаточности, влияние на обмен веществ.
- •3) У больного после переливания крови развилась желтуха. Какой вид желтухи можно заподозрить? Как изменились показатели пигментного обмена в крови и моче?
- •1)Классификация ферментов. Общая характеристика класса оксидоредуктаз. Коферменты оксидоредуктазных реакций.
- •Характеристика фермента
- •2) Гормональная регуляция углеводного обмена. Гормоны, повышающие и понижающие уровень глюкозы в крови. Механизм их действия.
- •3) В крови снижено содержание мочевины. Нарушение какого метаболического пути можно предположить, каковы возможные причины этих нарушений?
- •1)Понятие об обмене веществ. Процессы анаболизма и катаболизма, их характеристика и взаимосвязь. Виды метаболических путей. Центральные метаболиты.
- •I . Подготовительная фаза.
- •II фаза. Превращение мономеров в простые соединения - центральные метаболиты (пвк, ацетилКоА)
- •III фаза. Цикл Кребса
- •2) Витамины рр и в2, структура, признаки витаминной недостаточности и участие в обмене веществ.
- •1)Обмен и биологическое значение глутаминовой и аспарагиновой аминокислот в организме человека.
- •2)Микроэлементы: железо, медь и кобальт. Их роль в организме. Понятие о микроэлементозах.
- •3) Пациенту в лечебных целях назначили диету с низким содержанием углеводов. Концентрация глюкозы в крови нормальная. За счет каких процессов преимущественно поддерживается уровень глюкозы в крови?
- •1) Основные пути промежуточного обмена аминокислот. Трансаминирование. Клиническое значение определения активности трансаминаз.
- •2) Антиоксидантная система организма. Неферментативные антиоксиданты. Антиоксидантные ферменты.
- •1)Гормоны передней доли гипофиза, их химическая структура и влияние на обмен веществ. Последствия изменений продукции соматотропного гормона в организме.
- •2)Глюконеогенез. Основные субстраты, ключевые ферменты процесса. Цикл Кори
- •3)Больной 50 лет поступил в клинику с жалобами на резкие боли в области сердца, слабость. Активность каких ферментов следует определить в крови больного для исключения инфаркта миокарда?
- •1)Холестерин, его биологическая роль, биосинтез. Гиперхолестеринемии. Атеросклероз.
- •2) Кровь, ее роль в организме. Химический состав плазмы. Калликреин-кининовая система.
- •3)Для лечения подагры применяется аллопуринол, структурный аналог гипоксантина. Объясните биохимический механизм действия данного лекарственного средства.
- •1)Кинетика ферментативных реакций. Зависимость скорости ферментативных реакции от концентрации субстрата и фермента, рН и температуры среды. Принципы количественного определения активности ферментов.
- •1. Зависимость скорости реакции от температуры
- •2. Зависимость скорости реакции от рН
- •3. Зависимость скорости реакции от концентрации субстрата
- •4. Зависимость от концентрации фермента
- •2) Синтез жирных кислот. Внутриклеточная локализация. Биосинтез триацилглицеролов.
- •1)Нуклеопротеины и нуклеиновые кислоты. Структурная организация молекул днк и рнк. Распад нуклеопротеинов в пищеварительном тракте. Нуклеотидный пул клеток, пути его пополнения и расходования.
- •2)Витамины а, е, к, влияние на обмен веществ, признаки витаминной недостаточности.
- •3)Оценить состояние больного по следующим данным анализа крови: активность креатинфосфокиназы повышена, общая активность лдг повышена, преимущественно за счет лдг1. Коэффициент де Ритиса - 1,90.
- •1)Биологическая роль печени. Роль печени в обмене углеводов, липидов, аминокислот и белков. Антитоксическая роль печени.
- •2)Биосинтез пуриновых и пиримидиновых нуклеотидов. Оротовая ацидурия.
- •1)Распад гемоглобина. Образование билирубина и продуктов его обмена. Характеристика прямого и непрямого билирубина. Диагностическое значиние их определения. Классификация желтух.
- •2)Глюкоза крови. Гипергликемия, гипогликемия, глюкозурия. Диагностическое значение определния глюкозы в крови и моче.
- •1)Гликолиз. Биологическая роль, химизм процесса, биоэнергетика, регуляция. Эффект Пастера.
- •2)Витамин d. Химическая природа витамина, гормонально-активные формы. Участие витамина в обмене веществ. Рахит.
- •3)Какова судьба гемоглобина, попавшего в плазму крови в результате гемолиза эритроцитов?
- •2. Регуляция и патология белкового обмена
- •3. Ответ. Поражение тканей печени. За счет изофермента лдг 4 и 5
- •1. 4,5 8,0 4,3
- •2. 6,1 14,0 10,0
- •2.Биохимия мышечной ткани
- •3. Ответ: 1 пациент – норма, 2 пациент – сахарный диабет.
- •1. Переваривание белков. Диагностическое значение биохимического анализа желудочного и дуоденального сока.
- •Условно заменимые аминокислоты ( могут образоваться из других кислот в организме )
- •Незаменимые аминокислоты ( нужно употреблять каждый день с пищей )
3. Ответ: 1 пациент – норма, 2 пациент – сахарный диабет.
Билет 36.
Роль белков в питании человека. Биологическая ценность пищевых белков. Полноценные и неполноценные белки. Азотистый баланс. Переваривание белков в желудке. Определение кислотности желудочного сока.
Аэробный (дихотомический) путь распада глюкозы. Роль пируватдегидрогиназного комплекса в процессе окислительного декарбоксилирования пирувата. Биоэнергетика процесса.
В моче больного обнаружено увеличение уробилина. Чем это может быть обусловлено? Какие биохимические исследования нужно провести, чтобы уточнить причину появления билирубина в моче?
1. Переваривание белков. Диагностическое значение биохимического анализа желудочного и дуоденального сока.
Функции белков: структурная, каталитическая, регуляторная, рецепторная, иммунологическая, защитная, транспортная, сократительная, дыхательная, обезвреживающая, геннорегуляторная, создание биопотенциалов мембран, гомеостатическая, индивидуальное строение органов, обеспечивают хорошее зрение, энергетическая,
Белковый обмен. В организме человека содержится около 15 кг белков. Количество свободных АМК примерно 35 г. АМК и белки содержат 95 % всего азота в организме.
Азотистый баланс – разность между общим количеством азота, поступившим в организм человека и количеством экскретируемого азота.
Азотистое равновесие наблюдается у взрослого здорового человека. При этом количество синтезируемого белка, равно количеству экскретируемого.
Положительный азотистый баланс у детей, беременных, выздоравливающих, введении анаболиков. При этом синтез белка преобладает над распадом.
Отрицательный азотистый баланс при голодании, старении, истощающих заболеваниях, раке.
Избыток и недостаток белка.
При недостаточном поступлении белка развивается белковая недостаточность. При белковых нагрузках вероятность возникновения дистрофических поражений почек, аллергических заболеваний, неопластических процессов повышается.
Белковый оптимум. Для человека умственного труда при средней физической нагрузке – 100 г в сутки, при работе в жарком климате – 120 г в сутки.
Оптимальная норма белка в питании обеспечивает положительный азотистый баланс. Содержание белка в пищевых продуктах неодинаково.
.На потребность в белке влияют - климатические условия, характер трудовой деятельности, возраст, физиологическое состояние организма, стрессы, наличие заболеваний.
Белковый минимум 30-50 г в сутки. Такое количество белка необходимо для поддержания азотистого равновесия. Даже при полном исключении из диеты всех белков с мочой выводится 4 г азота в сутки, то есть 25 г белка. Следовательно, при белковом голодании организм ежесуточно расходует примерно 25 г белков собственных тканей.
Биологическая ценность белков определяется - сбалансированностью АМК состава, атакуемостью белков ферментами пищеварительного тракта (доступностью АМК).
Ограниченная всасываемость АМК растительной пищи связана с высоким содержанием в ней волокон, наличием специфических ингибиторов пищеварительных ферментов если эти ингибиторы не инактивированы горячей обработкой пищи (соя, горох).
Идеальный белок - 100% биологическая ценность, 100% усвоение в ЖКТ. К идеальным белкам можно отнести белок женского молока, белок цельного куриного яйца. Белки коровьего молока усваиваются на 90%, растительные белки – на 60%.
Ценность белка определяется его химическим составом. Незаменимые АМК: Вал, Иле, Лей, Лиз, Мет, Тре, Три, Фен.
Незаменимые АМК для детей: Вал, Иле, Лей, Лиз, Мет, Тре, Три, Фен, Гис и Арг.
Скорость синтеза Гис и Арг недостаточна для того, чтобы обеспечить рост организма в детстве.
Исключение какой-либо АМК из пищи сопровождается развитием отрицательного азотистого баланса, истощением, остановкой в росте, нарушениями со стороны нервной системы.При отсутствии Гис, Арг – анемия. При отсутствии Три – катаракта. При отсутствии Лиз - кариес, задержка роста. При отсутствии Мет страдает печень.
Дефицит белка в пище вызывает - потерю массы тела, нарушения роста, ферментную недостаточность, нарушения иммунитета.
Парентеральное белковое питание используют при ожогах, отравлениях, непроходимости пищевода, тяжёлых раковых поражениях пищевода и желудка.
В ротовой полости нет переваривания белков, Переваривания белков начинается в желудке.
Расщепление белка в ЖКТ. Желудочный сок - 95% - вода, 0,5% органические вещества, 2,5 литра.
Состав желудочного сока - пепсин (7 изоферментов), соляная кислота, гастрин (гормон, стимулирующий желудочную секрецию), лизоцим (вырабатывается поверхностью эпителия желудка), слизь (гликопротеины) несёт защитную функцию, внутренний фактор Кастла.
Пепсин образуется путём ограниченного протеолиза. рН оптимум 1,5 – 2, гидролизует пептидные связи с участием NH2 группы ароматической АМК.
Соляная кислота - создаёт рН 1,5-2 у взрослого, рН 5-6 – у новорожденных.
Роль соляной кислоты - вызывает денатурацию, набухание белка, активация пепсиногена, создаёт оптимум рН для пепсина, бактерицидное действие, нужна для всасывания железа, стимулирует работу внутреннего фактора Кастла, стимулирует работу секретина.
Общая кислотность желудочного сока - совокупность всех кислотореагирующих веществ желудочного сока. Связанная соляная кислота - соляная кислота, связанная с белками и продуктами их переваривания. Свободная соляная кислота - соляная кислота, остающаяся в избытке.
Кислотность измеряется в титрационных единицах – количество NaOH, затраченное на титрование 100 мл желудочного сока.
Общая кислотность – 40-60 ТЕ. Связанная соляная кислота – 20-30 ТЕ. Свободная соляная кислота - 20-40 ТЕ.
Защитные факторы слизистой желудка от соляной кислоты и пепсина - образование слизи, секреция эпителием ионов НСОз, создающих рН 5-6, наличие гетерополисахаридов на поверхности мембран клеток слизистой, быстрая регенерация повреждённого эпителия.
Основные пепсины желудочного сока. Пепсин А гидролизует белки при рН 1,5-2. Часть пепсина переходит в кровеносное русло и выделяется с мочой (уропепсин). Гастриксин - оптимум рН 3,2 -3,5. Пепсин В (желатиназа) расщепляет белки соединительной ткани. Реннин (пепсин D, химозин) расщепляет казеин молока в присутствии ионов кальция.
Пепсиноген активируется двумя способами - соляной кислотой – медленно, аутокаталитически –быстро, уже имеющимся пепсином.
Гипохлоргидрия – снижение концентрации соляной кислоты в желудочном соке.
Ахлоргидрия – отсутствие соляной кислоты в желудочном соке.
Гиперхлоргидрия – повышение концентрации соляной кислоты в желудочном соке.
2. Аэробный распад глюкозы. Основной путь катаболизма глюкозы.
Дихотомический распад молекулы глюкозы на 2 триозы. Происходит в нервной ткани, почках, печени, сердце. Поставляет энергию в клетку. Требуется кислород.
В процессе аэробного распада глюкозы выделяют три этапа:
Гликолитическая фаза.
Окислительное декарбоксилирование ПВК.
Цикл трикарбоновых кислот.
I этап аэробного распада –гликолиз без последней реакции. Все реакции протекают в цитоплазме. Кислород может присутствовать, а может и отсутствовать (анаэробная фаза). Две реакции идут с затратой энергии (гексокиназная, фосфофруктокиназная). Субстратное фосфорилирование обеспечивает на одну молекулу глюкозы 4 молекулы АТФ. 2 НАДН+Н+ (на 1 молекулу глюкозы) образуются в глицеральдегидфосфатдегидрогеназной реакции, проникают в митохондрии , где дают 3*2=6 АТФ. Большинство реакций обратимы, три реакции необратимые (гексокиназная, фосфофруктокиназная, пируваткиназная).
Баланс: приход 6+4= 10АТФ расход 2АТФ. 10-2 = 8АТФ.
II этап - окислительное декарбоксилирование ПВК. Реакция катализируется мультиферментным пируватдегидрогеназным комплексом, в котором участвуют 5 коферментов (ФАД, ТПФ, липоевая кислота, НАД , КоАSH) и 3 фермента.
Условия протекания реакции - ПВК диффундирует в матрикс митохондрий, реакция протекает в матриксе митохондрий, реакция необратима, требуется кислород, образуются 2 НАДН+Н, которые дают 6АТФ. При избытке углеводов у ребёнка возникает недостаточность тиамина, в крови накапливается ПВК (продукт неполного окисления углеводов).
III этап - Цикл Кребса. идёт в митохондриях, требует присутствия кислорода, из 1 молекулы ацетил-КоА – 12АТФ из 2 молекул ацетил-КоА = 2*12 АТФ=24 АТФ.
При аэробном распаде глюкозы:
этап – 8 АТФ,
этап – 6 АТФ,
этап –24 АТФ.
Итого: 38 АТФ на 1 моль глюкозы.
3.Ответ. Появление в моче уробилина свидетельствует о гемолитической или печеночной желтухе. Дополнительные биохимические исследования – содержание прямого и непрямого билирубина, стеркобилина, печеночная проба.
Билет 37.
Биосинтез белка. Активация аминокислот, трансляция. Ингибиторы синтеза белка. Влияние <неразборчиво> на синтез белка.
Гормоны стероидной природы: глюкокортикоиды, половые гормоны, минералокортикоиды. Химическая структура гормонов, механизм действия, влияние на обмен веществ.
При добавлении АТФ к гомогенату мышечной ткани снизилась скорость гликолиза, концентрация глюкозо-6-фосфата и фруктозо-6-фосфата увеличилась, а концентрация всех других метаболитов гликолиза была при этом ниже. Укажите фермент, активность которого снижается при добавлении АТФ. Напишите реакцию, катализируемую этим ферментом.
Матричные биосинтезы.
При биосинтезе белков и нуклеиновых кислот матрицей служат нуклеиновые кислоты. Матрица в ходе матричного синтеза не расходуется и может использоваться многократно. Существует три основных типа матричных биосинтезов. Биосинтез ДНК (репликация ДНК) с использованием в качестве матрицы уже существующих молекул ДНК. Биосинтез РНК на матрице ДНК (транскрипция). Биосинтез белков с использованием в качестве матрицы и-РНК (трансляция).
Трансляция – синтез белка на матрице РНК. ДНК – код АТГ, и-РНК – кодон УАУ, т –РНК – антикодон АУГ.
Этапы трансляции - инициация, элонгация, терминация.
Инициация. Инициирующий кодон – АУГ. Рост цепей идёт с N-конца. Синтез начинается с N-формилметионина.
Необходимые компоненты: рибосомы, инициирующий кодон, инициаторная аминоацил-тРНК, факторы инициации (IF1, IF2, IF3), ГТФ, ионы магния.
Процесс формилирования предотвращает участие аминогруппы АМК в образовании пептидной связи и обеспечивает синтез белка в направлении от аминогруппы к карбоксильной.
IF3 первым связывается с малой субъединицей рибосомы. IF3 обеспечивает узнавание участка на м-РНК, куда присоединяется формилметионин-тРНК. IF1 способствует связыванию формилметионин-тРНК с малой субъединицей рибосомы и присоединению к ней м-РНК. IF2 способствует объединению большой и малой субчастиц.
Образование инициаторного комплекса осуществляется путём присоединения белковых факторов, формилметионин-тРНК, ГТФ к малой субчастице рибосомы, к которой комплементарно антикодону присоединяется м-РНК, при участии кодона АУГ. После присоединения 50S субчастицы рибосома становится функционально активной.
Элонгация трансляции. Необходимо: т-РНК, АМК, ГТФ, ионы магния, рибосомы, факторы элонгации, м-РНК. Формилметионин-тРНК поступает сначала на А-центр, а потом на Р-центр. Участок А получает другую АМК. Для этого необходим ГТФ. Рибосома делает «шаг» по м-РНК на один кодон. Формилметионин переходит на А-участок с Р-участка. На А-участке происходит синтез пептидной связи под влиянием пептидилтрансферазы. Рибосома перемещается на один кодон. Дипептид вновь переносится на Р-участок под влиянием пептидилтранслоказы. На А-участок поступает третья АМК. При перебросе в участок А дипептида образуется трипептид.
Главное событие транслокации – перемещение пептидил-тРНК из А в Р-участок рибосомы. Антикодон тянет за собой кодон матрицы, приводя к перемещению матрицы на один триплет относительно рибосомы.
Для синтеза одной пептидной связи нужно 4АТФ: 2 АТФ - на активацию АМК и 2 ГТФ - на включение АМК т-РНК в А-центр и транслокацию.
Терминация. Необходимы: рибосомы, факторы терминации (3), м-РНК, терминирующие кодоны УАГ, УАА, УГА. От рибосомы отделяется белок, т-РНК, м-РНК. м-РНК распадается до рибонуклеотидов.
Синтез митохондриальных белков. 2% клеточной ДНК находится в митохондриях. Белки, синтезируемые в митохондриях, нерастворимы и участвуют в организации структуры митохондрий.
Посттрансляционная модификация - формирование третичной и четвертичной структур – фолдинг (участвуют шапероны), ограниченный протеолиз. присоединение коферментов, простетической группы, гликозилирование, метилирование, гидроксилирование, фосфорилирование, образование дисульфидных связей.
Ингибиторы белкового синтеза. 50% антибиотиков являются ингибиторами белкового синтеза, 20% - антибиотиков ингибиторы синтеза нуклеиновых кислот. Репликацию нарушают антибиотики, химические яды, вирусы.
Гормоны стероидной природы.
Гормоны коры надпочечников. Кора надпочечников – жизненно важный орган. В коре синтезируется свыше 50 кортикостероидов, 7 – 10 из них - гормоны: глюкокортикоиды, минералокортикоиды, половые гормоны.
Синтез гормонов.
Кортикостероиды синтезируются из холестерина. Холестерин превращается в прегненолон, который является предшественником всех стероидных гормонов.
Регуляция синтеза кортикостероидов – кортиколиберин гипоталамуса →АКТГ гипофиза →кортикостероиды→транспортируются в клетку.
Рецепторы кортикостероидов в цитоплазме клетки. Гормоны соединяются с белком и транспортируются в ядро. В ядре кортикостероиды связываются с хроматином и действуют на геном, изменяя транскрипцию генов. Гормон→ген→белок.
Глюкокортикоиды - кортикостерон, кортизон, гидрокортизон, 11-дезоксикортизол, 11-дегидрокортикостерон. Глюкокортикоиды состоят из 21 углеродного атома и имеют боковую цепь у 17 атома углерода. 75-80 % глюкокортикоидов связаны с транскортином. 10-15 % - с альбумином.
Синтез глюкокортикоидов
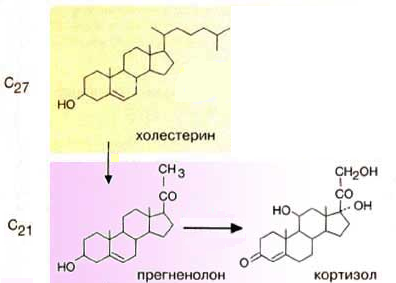
Органы-мишени для глюкокортикоидов - соединительная ткань, мышцы, жировая ткань, лимфоидная ткань, печень, почки.
Влияние глюкокортикоидов на белковый обмен. Глюкокортикоиды являются катаболиками в мышечной, лимфоидной, соединительной, жировой тканях. Снижают проницаемость клеток этих тканей для аминокислот и глюкозы, способствуют гипераминоацидурии, повышают выделение общего азота с мочой. В печени глюкокортикоиды – анаболики.
Влияние глюкокортикоидов на углеводный обмен: усиливают глюконеогенез из АМК, ингибируют ГК, снижают синтез гликогена в мышцах, активируют гликогенолиз. На жировой обмен: стимулируют липолиз, активируя липазы, повышают содержание жирных кислот в крови. Из-за того, что жирные кислоты не успевают сгорать, развивается кетонемия и стероидный диабет.
Глюкокортикоиды: влияют на терморегуляционный центр, снижают синтез АТФ и адениловых нуклеотидов, оказывают противоаллергическое действие (угнетение образования иммуноглобулинов), оказывают противовоспалительное действие: уменьшают проницаемость капилляров, ослабляют фагоцитарную активность лимфоцитов.
Глюкокортикоиды действуют: на кровь: снижают число лимфоцитов, снижают число эозинофилов, повышают число нейтрофилов. На соединительную ткань: снижают образование гликозаминогликанов, тормозят рост фибробластов, уменьшают число тучных клеток.
Применение. В клинике глюкокортикоиды применяют как десенсибилизаторы, противовоспалительные, иммунодепрессанты. Используют при коллагенозах, бронхиальной астме.
Минералокортикоиды - дезоксикортикостерон, альдостерон:
1) Действует на канальцевый аппарат почек: снижает реабсорбцию калия (нарушение сократительной способности мышц), повышает реабсорбцию натрия и хлора из первичной мочи повышается осмотическое давление крови, лимфы, тканевой жидкости повышается обратное всасывание воды в кровь. 2) Усиливает воспаление.
Биологическая роль альдостерона. Катаболизм гормонов: 17-кетостероиды – конечные метаболиты гормонов - выводятся с мочой. У мужчин 10-25 мг в сутки. У женщин 5-15 мг в сутки.
Выделение увеличивается при: опухоли коры надпочечников и семенников, аддисоновой болезни, микседеме.
Гиперкортицизм. Возникает при: опухоли коры надпочечников, поражении гипоталамо- гипофизарной системы (избыток либерина). Проявляется повышенной секрецией всех кортикостероидов, либо одной группы гормонов.
Болезнь Иценко - Кушинга возникает при избытке кортизола. При этом заболевании: «буйволовый» тип телосложения, повреждается миокард, снижается иммунитет, стероидный диабет, гипергликемия, гипертония.
Синдром Конна возникает при избыточном выделении альдостерона. При этом заболевании: задержка натрия, хлора и воды в организме, теряется калий, отёки, гипертония, слабость, повышается возбудимость миокарда.
Гиперплазия коры надпочечников. Гормонально активные опухоли коры надпочечников: кортикостерома, андростерома, кортикоэстрома, альдостерома, смешаннные опухоли. При опухоли, продуцирующей мужские половые гормоны в моче много 17-кетостероидов, появляются усы и борода у женщин.
Гипокортицизм, Бронзовая болезнь (болезнь Аддисона). Причины: аутоиммунные поражения клеток коры надпочечников, туберкулёз, сифилис.
Клинические проявления: слабость, гипотония, гипогликемия, снижение концентрации натрия и хлора, повышение концентрации калия, пигментация кожи (кортикостерон связан с МСГ), снижается сопротивляемость к стрессам, инфекциям, снижается возбудимость миокарда.
Женские половые гормоны.
1) Эстрогены (эстрадиол, эстрон, эстриол). Эстрогены синтезируются в яичниках, жёлтом теле, надпочечниках, семенниках, плаценте.
2) Прогестины (прогестерон). Секреция этих гормонов носит циклический характер: В первой фазе цикла выделяются эстрогены, а во второй – прогестерон (в жёлтом теле).
Биологическая роль эстрогенов. Обеспечение репродуктивной функции организма: стимулируют рост яйцеводов и матки, усиливают размножение клеток эндометрия, усиливают сократительную функцию матки, стимулируют разрастание желёз эндометрия, в миометрии стимулируют синтез белка, увеличивают активность ферментов, анаболики, действуют на ЦНС.
Биологическая роль прогестерона. Органы - мишени прогестерона: молочные железы, матка. Прогестерон: стимулирует процессы, обеспечивающие наступление беременности и её сохранение до родов, готовит эндометрий матки к имплантации оплодотворённой яйцеклетки, стимулирует разрастание эндометрия, усиливает деятельность маточных желёз, стимулирует развитие железистой ткани молочных желёз, расслабляет маточную мускулатуру, влияет на ЦНС.
Биологическая роль женских половых гормонов. Релаксин – гормон плаценты, яичников, эндометрия. Стимулирует размягчение лонного сращения, открытие шейки матки.
Плацентарные гормоны. Хорионический гонадотропин – гликопротеин. Стимулирует рост, развитие и секреторную активность жёлтого тела.
Эстрогены, прогестерон, релаксин, окситоцин, СТГ, ТТГ, АКТГ, глюкокортикоиды, андрогены (тестостерон, андростерон, дегидроэпиандростерон). Синтезируются в семенниках, клетках яичников, клетках Лейдига, надпочечниках. Синтез регулирует ГТГ гипофиза.
Андрогены. Биологическая роль тестостерона - формирование половых признаков (голос, гортань, скелет, мускулатура, волосы и др.), активирует сперматогенез, стимулирует развитие добавочных половых желёз (простаты), влияет на скорость закрытия эпифизарных зон роста, анаболический эффект – усиливает синтез белка в печени, почках, мышцах, влияет на ЦНС, влияет на фиксацию кальция и фосфора в костях, активация ЦТК и окислительных процессов.
Уровень тестостерона в крови после рождения повышается, достигает максимума к 1-3 месяцу, затем до 1 года снижается, повышается в пубертатном периоде.
Тестостерон применяют при лечении рака молочных желёз. Эстрогены – при раке простаты. Признаки формирования пола обнаруживаются у эмбриона на 7-9 неделе развития. Избыток андрогенов в этот период (гиперплазия коры надпочечников, введение матери с лечебной целью) стимулирует формирование органов у девочки по мужскому типу.
3.Ответ. Эта реакция фосфорилирования, является регуляторной. Регулируя активность фосфофруктокиназы, можно изменять скорость катаболизма глюкозы.Фосфофруктокиназа относится к числу аллостерических ферментов. Она ингибируется АТФ и стимулируется АМФ. При значительных величинах отношения АТФ/АМФ активность фосфофруктокиназы угнетается и гликолиз замедляется. Напротив, при снижении этого коэффициента интенсивность гликолиза повышается. Так, в неработающей мышце активность фосфофруктокиназы низкая, а концентрация АТФ относительно высокая. Во время работы мышцы происходит интенсивное потребление АТФ и активность фосфофруктокиназы повышается, что приводит к усилению процесса гликолиза.



Билет 38.
Виды специфичности ферментов. Основные пути активации и ингибирования ферментативной активности.
Тироксин, его синтез, влияние на обмен веществ. Гипотериоз и гипертиреоз.
Как осуществляется связывание аммиака в различных тканях человеческого организма и его выделение? Напишите уравнения соответствующих реакций.
Специфичность действия ферментов.
Каждый фермент действует строго на одно вещество или очень небольшое число близкородственных веществ. Если бы ферменты не обладали специфичностью, их действие приводило бы к распаду клеточного материала. Структура активного центра фермента комплементарна структуре его субстрата.
Специфичность действия ферментов. Абсолютная специфичность - Фермент катализирует превращение только одного субстрата. Уреаза, аргиназа.
Стереоспецифичность - фермент катализирует превращение одного из стереоизомеров, оксидазы L и D аминокислот.
Относительная специфичность - Фермент действует на субстраты разных групп химических соединений.
Специфичность по типу реакции. Цитохром Р450.
Групповая специфичность - Фермент действует на отдельные связи определённой группы субстратов. Пепсин расщепляет связи, образованные аминогруппой тирозина или фенилаланина. Трипсин гидролизует пептидные связи, в образовании которых принимают участие СООН-группы лиз и арг. Химотрипсин гидролизует пептидные связи, в образовании которых участвуют СООН-группы ароматических АМК. Эластаза гидролизует пептидные связи, в образовании которых участвуют СООН-группы гли, ала.
Инактивация ферментов. Факторы, вызывающие денатурацию, вызывают потерю ферментативной активности, так как происходит разрыв дисульфидных связей, которые способствуют формированию третичной структуры.
Аллостерическая регуляция. Во многих строго биосинтетических реакцияхосновным типом регуляции скорости многоступенчатого ферментативного процесса является ингибирование по принципу обратной связи. Это означает, что конечный продукт биосинтетической цепи подавляетактивность фермента, катализирующего первую стадию синтеза, которая является ключевой для данной цепиреакции. Поскольку конечный продукт структурно отличается отсубстрата, он связывается с аллостерическим (некаталитическим) центроммолекулыфермента, вызывая ингибирование всей цепи синтетическойреакции.
Предположим, что в клеткахосуществляется многоступенчатый биосинтетический процесс, каждая стадия которого катализируется собственнымферментом:
![]()
Скорость подобной суммарной последовательности реакцийв значительной степени определяетсяконцентрациейконечного продукта Р, накопление которого выше допустимого уровня оказывает мощное ингибирующее действие на первую стадию процесса и соответственно наферментE1.
Типы ингибирования. Различают обратимое и необратимое ингибирование. Если ингибиторвызывает стойкие изменения пространственной третичной структурымолекулыферментаили модификациюфункциональных группфермента, то такой тип ингибирования называется необратимым. Чаще, однако, имеет место обратимое ингибирование, поддающееся количественному изучению на основе уравнения Михаэлиса-Ментен. Обратимое ингибирование в свою очередь разделяют на конкурентное и неконкурентное в зависимости от того, удается или не удается преодолеть торможение ферментативнойреакциипутем увеличенияконцентрациисубстрата.
Конкурентное ингибирование может быть вызвано веществами, имеющими структуру, похожую на структурусубстрата, но несколько отличающуюся от структуры истинногосубстрата. Такое ингибирование основано на связыванииингибиторас субстратсвязывающим (активным) центром. Классическим примером подобного типа ингибирования является торможениесукцинатдегидрогеназы(СДГ)малоновой кислотой. Этотферменткатализируетокислениепутемдегидрированияянтарной кислоты(сукцината) в фумаровую.
Тироксин. Гормон щитовидной железы, производное тирозина, йодсодержащий гормон. На долю тироксина приходится ¾ всего йода, содержащегося в крови.
Этапы синтеза тироксина
Окисление йода катализирует фермент – тиреопероксидаза. Щитовидная железа – единственная ткань, способная окислять йод до состояния с более высокой валентностью, что необходимо для синтеза тиреоидных гормонов.
Окисленный йод внедряется в тиреоглобулин. Происходит йодирование тирозина в составе тиреоглобулина. Образуются МИТ и ДИТ.
3. Конденсация йодтирозинов
Тиреоглобулин – большой йодированный белок. 70% йодида в этом белке находится в составе неактивных предшественников МИТ и ДИТ. 30% - в виде Т3 и Т4. Тиреоглобулин – форма хранения Т3 и Т4 в коллоиде, обеспечивает поступление этих гормонов в кровь.
Синтез тиреоглобулина: контролируется по цепочке: тиролиберин ТТГ синтез тиреоглобулина ограничивается:
тиреоидными гормонами, которые подавляют секрецию тиролиберина,
протеиназами плазмы, которые расщепляют тиролиберин во время его транспорта кровью.
4. Тироксин выделяется в кровь после гидролиза тиреоглобулина протеазами лизосом фолликулярных клеток щитовидной железы.
Тироксинсвязывающий белок преальбумин и альбумин транспортируют Т4. Концентрация тироксина контролируется ТТГ. При недостатке йода могут образоваться моно- и дииодтиронины. Распад Т3 и Т4 происходит в клетках печени.
Механизм действия тироксина. Тироксин легко проходит через клеточную мембрану. Внутри клетки имеет рецепторы в: ядре, митохондриях, цитоплазме.
Действие тироксина. Тироксин активирует аденилатциклазу в чувствительных к нему тканях: печень, почки, сердце, жировая ткань, скелетные мышцы. Тироксин действует на все ткани и обмены. Он необходим для нормального роста, развития, дифференцировки тканей. Тироксин вначале стимулирует энергопотребляющую систему (активный мембранный перенос ионов натрия). За этим следует поглощение кислорода тканями, усиление синтеза белка, необходимое для образования митохондрий, а затем наполнение их ферментами. Тироксин – анаболик в малых дозах в детстве. В больших дозах во взрослом организме тироксин – катаболик: стимулирует распад белков, липидов, активирует глюконеогенез.
Действие тироксина - увеличивает скорость основного обмена, усиливает поглощение кислорода тканями, обеспечивает теплопродукцию, стимулирует синтез белков, ускоряет синтез многих ферментов, повышает активность ферментов, стимулирует сердечную деятельность, стимулирует проведение нервных импульсов, увеличивает всасывание глюкозы, стимулирует трансляцию и транскрипцию, тормозит синтез жира из глюкозы, стимулирует липолиз.
Функция щитовидной железы в норме и патологии. Щитовидная железа развивается на 3 неделе внутриутробного развития. На 12 неделе железа способна синтезировать гормон. У новорожденных отмечена гиперфункция щитовидной железы. К 5 – 10 годам железа функционирует как у взрослых.
При недостатке тироксина возникает: кретинизм в детстве, микседема у взрослых.
Кретинизм - врождённое нарушение синтеза тироксина. Клинические проявления: остановка роста, изменения кожи, волос, мышц, нарушения психики.
Микседема – слизистый отёк. Чаще встречается у женщин. Клинические проявления: нарушение водно-солевого, основного, жирового обменов, патологическое ожирение, выпадение волос и зубов, психические расстройства, вялость, отёчность, снижение интенсивности окислительно-восстановительных процессов.
Эндемический зоб обусловлен недостатком йода в питьевой воде, почве и растениях определённых районов земного шара. При заболевании компенсаторно разрастается соединительная ткань. Наблюдается ухудшение интеллектуального, полового, физического развития детей. В регионах тяжёлой зобной эндемии распространён врождённый гипотиреоз, дети с эндемическим неврологическим кретинизмом, глухонемота, резкое снижение интеллекта, спастическая диплегия. В регионах средней степени эндемии – тугоухость, нарушения речи, лёгкие моторные нарушения.
Заболевания (состояния), ассоциированные с зобной эндемией - Снижение интеллектуального потенциала населения. Бесплодие, невынашивание беременности, высокая перинатальная и младенческая смертность ® демографические проблемы. Ухудшение состояния здоровья населения: - высокий уровень заболеваемости - высокий уровень хронических заболеваний - акселерация атеросклероза - рост кардиоваскулярных заболеваний - йоддефицитный эндемический зоб - смешанного генеза.
Ранняя диагностика врождённого гипотиреоза осуществляется путём определения ТТГ в капиллярной крови новорожденных на 4-5 день жизни. О наличии в регионе йодной недостаточности свидетельствует большая частота показателей ТТГ выше 5 м Ед/л. Степень экологической напряжённости влияет на тиреоидную функцию новорожденных. Явное снижение функции щитовидной железы при гипотиреозе и скрытое при йоддефицитном зобе оказывает неблагоприятное воздействие на состояние репродуктивной системы женщины, снижая адаптационные резервы и обуславливая развитие иммунодефицитных состояний.
Тиреотоксикоз обусловлен повышенным содержанием в крови гормонов щитовидной железы. Тироксин разобщает тканевое дыхание и окислительное фосфорилирование, снижается концентрация АТФ, идёт распад белков, жиров, углеводов.
Клинические проявления: худоба, тахикардия, экзофтальм, остеопороз, раздражительность, психические расстройства, нарушение сна, потливость, повышение температуры тела, астения, снижение психической активности.
Ответ.
Пути обезвреживания аммиака –
синтез
мочевины (печень) ,
,
образование
амидов АМК (кл. мозга) ,
,
восстановительное
аминирование (в регенерирующей печени)
 ,
,
образование
аммонийных солей (почки) →
→![]()
Билет 39.
Сопряжение обмена липидов и аминокислот. Сопряжение обмена углеводов, липидов и аминокислот на уровне образования ацетил-КоА, и на уровне цикла Кребса.
Гормоны гипоталамуса и нейрогипофиза, их химическая природа и влияние на обмен веществ.
Оценить состояние больного по следующим данным анализа его крови: общая активность ЛДГ повышена, коэффициент АСТ/АЛТ – 0,8, общий билирубин – 55 мкмоль/л, непрямой билирубин – 30мкмоль/л, прямой билирубин – 25 мкмоль/л, количество альбуминов снижено, концентрация альфа-2- и бета-глобулинов повышена.
Взаимосвязь обменов осуществляется благодаря интегрирующим системам: нервной, эндокринной, сосудистой.
Взаимосвязь обеспечивается различными уровнями: информационный уровень, структурный уровень, общее энергетическое обеспечение, на уровне общих метаболитов, на уровне Ц.Т.К.
Информационный уровень взаимосвязи. В геноме клеток заложена информация о структуре и функциональной активности различных белков, принимающих участие в структурной и динамической организации живых систем.
Структурный уровень взаимосвязи. Мембранный аппарат клеток, рибосомы.
Общее энергетическое обеспечение. АТФ – универсальная энергетическая валюта, образующаяся при окислении углеводов, жиров, аминокислот. НАДФН2 – основной донор электронов в восстановительных реакциях биосинтеза. Восстановительные эквиваленты, накапливаемые в ходе катаболизма в клетке в виде восстановительных форм НАДФН2 используются в восстановительных реакциях клеточного анаболизма, связывая таким образом, катаболические и анаболические процессы в единую систему. Синтез одного соединения (жира) происходит за счёт катаболизма другого (глюкозы).
Взаимосвязь на уровне общих метаболитов. Центральные метаболиты: ацетил-КоА, ПВК, ЩУК, ФГА.
Ацетил-КоА
образуется при окислительном
декарбоксилировании ПВК, при β-окислении
жирных кислот, из аминокислот.

Взаимосвязь углеводного и липидного обменов осуществляется через - ацетил-КоА, ФГА, НАДФН2 из пентозного цикла идёт на синтез жирных кислот, ЩУК нужен для работы Ц.Т.К.
Жиры сгорают в пламени углеводов. При избытке в пище углеводов возникает ожирение. ФГА и ацетил-КоА– источники глицерина и жирных кислот. При спячке у животных происходит образование углеводов из жиров. Взаимосвязь белкового и жирового обменов на уровне - ПВК, ацетил-КоА, кетоновых тел. Из белков осуществляется синтез жира.
Взаимосвязь углеводного и белкового обменов на уровне - ПВК, ЩУК, ацетил-КоА, пентоз, глюкопластичных и кетопластичных аминокислот. Углеродные скелеты АМК вступают в Ц.Т.К. Возможно образование углеводов из белков (ГНГ) и белков из углеводов (из ПВК образуется аланин).
Сопряжение на уровне Ц.Т.К. - углеродные скелеты АМК включаются в Ц.Т.К, все кислоты Ц.Т.К. превращаются в ЩУК (ГНГ), взаимосвязь Ц.Т.К. с синтезом мочевины через фумарат, асп, СО2.
Ц.Т.К. обеспечивает энергией все обмены. Взаимосвязь обмена веществ на уровне цикла Кребса. Связь липидного обмена с Ц.Т.К. осуществляется через: цитрат, - активатор ацетил-КоА-карбоксилазы, - перенос в цитоплазму ацетил-КоА, Сукцинил-КоА.
Жирные кислоты с нечётным числом углеродных атомов через пропионил-КоА превращаются в сукцинил-КоА, СО2, малат. Малик-реакция – источник образования НАДФН2.
Гормоны гипоталамуса (релизинг-факторы) - соматолиберин, пролактолиберин, тиролиберин, кортиколиберин, люлиберин, меланолиберин, фоллилиберин, соматостатин, меланостатин, пролактостатин.
Соматостатин. Он оказывает широкий спектр биологического действия; в частности, показано ингибирующее действие на синтез гормона ростав аденогипофизе, а также прямое тормозящее действие его набиосинтезинсулинаиглюкагонав β- и α-клеткахостровков Лангерганса.
Соматолиберин стимулирует синтез и секрециюгормона ростагипофизасоматотропина.
Меланолиберин оказывает стимулирующее действие, а меланостатин, напротив, ингибирующее действие на синтез и секрециюмеланотропинав передней долегипофиза.
Местом синтеза гипоталамических гормонов, вероятнее всего, являются нервные окончания – синаптосомы гипоталамуса, поскольку именно там отмечена наибольшаяконцентрациягормонови биогенныхаминов. Последние рассматриваются наряду сгормонамипериферическихжелезвнутреннейсекреции, действующих по принципу обратной связи, в качестве основных регуляторовсекрециии синтезагормоновгипоталамуса.
Механизм биосинтезатиролиберина, осуществляющегося, скорее всего, нерибосомальным путем, включает участие SH-содержащейсинтетазыили комплексаферментов, катализирующихциклизациюглутаминовой кислотыв пироглутаминовую, образованиепептидной связии амидирование проли-на в присутствииглутамина. Существование подобного механизмабиосинтезас участием соответствующихсинтетаздопускается также в отношениигонадолиберинаисоматолиберина.
Гипоталамические гормонынепосредственно влияют насекрецию(точнее, освобождение) «готовых»гормоновибиосинтезэтихгормоновde novo. Доказано, чтоцАМФучаствует в передаче гормонального сигнала. Показано существование вплазматических мембранахклетокгипофизаспецифических аденогипофизарныхрецепторов, с которыми связываютсягормоныгипоталамуса, после чего через системуаденилатциклазыи мембранных комплексов Са2+–АТФ и Mg2+–АТФ освобождаются ионыСа2+ и цАМФ; последний действует как на освобождение, так и на синтез соответствующегогормона гипофизапутем активированияпротеинкиназы.
Гормоны задней доли гипофиза. Вазопрессин и окситоцин синтезируются в нейронах гипоталамуса, связываются с белками нейрофизинами и транспортируются в нейросекреторные гранулы гипоталамуса, затем вдоль аксона в заднюю долю гипофиза, где происходит пострибосомальная достройка.
Вазопрессин - стимулятор аденилатциклазы: цАМФ образуется в мембране эпителия почечных канальцев, в результате повышается проницаемость для воды, повышает артериальное давление из-за стимуляции сокращения гладкой мускулатуры сосудов, способствует уменьшению диуреза из-за воздействия на канальцевый аппарат нефрона, повышения реабсорбции воды.
Несахарный диабет возникает из-за нарушения: синтеза, транспорта, секреции вазопрессина. При заболевании с мочой теряется до 40 л воды в сутки, возникает жажда. Несахарный диабет бывает при атрофии задней доли гипофиза.
Синдром Пархана возникает из-за повышенной секреции вазопрессина, усиливается реабсорбция воды в почках, появляются отёки.
Окситоцин - стимулирует сокращения гладкой мускулатуры матки, гладких мышц кишечника, уретры, стимулирует сокращение мышц вокруг альвеол молочных желёз, способствуя молокоотдаче. Окситоциназа разрушает гормон. При родах её активность падает в 100 раз.
Ответ. ↑ ЛДГ – болезнь печени, сердца, легких.
Коэффициент Де Ветиса < 1 – забол. печени
↑ непр. и прям. Билирубина – паренхиматозная желтуха.
↑ концентрации белков острой фазы – острое воспаление.
Билет 40.
Основные фазы унификации питательных веществ в организме. Цикл трикарбоновых кислот и его роль в организме.
Биохимия нервной ткани, ее химический состав, особенности обмена.
В крови больного ребенка понижено содержание кальция и неорганического фосфора, активность щелочной фосфатазы повышена, в моче избыточное содержание лимонной кислоты и фосфатов. При каком заболевании могут наблюдаться такие лабораторные показатели? Следствием каких метаболических нарушений они являются?
Обмен веществ.Метаболические пути. Унификация питательных веществ.
Обмен веществ и энергии - совокупность процессов превращения веществ и энергии в живых организмах и обмен веществами и энергией между организмом и окружающей средой. Обмен веществ включает 3 этапа - поступление веществ в организм, метаболизм, или промежуточный обмен, выделение конечных продуктов обмена.
Основные функции метаболизма - извлечение энергии из окружающей среды (в форме химической энергии органических веществ), превращение экзогенных веществ в строительные блоки, сборка белков, нуклеиновых кислот, жиров из строительных блоков, синтез и разрушение тех биомолекул, которые необходимы для выполнения различных специфических функций данной клетки.
Различают две стороны обмена веществ – анаболизм и катаболизм
Катаболизм – ферментативный распад высокомолекулярных соединений до составляющих их мономеров и дальнейший распад мономеров до конечных продуктов: углекислого газа, аммиака, лактата.
Главные реакции катаболизма – реакции окисления, поставляющие клетке энергию. Энергия может запасаться в двух формах: АТФ, НАДФН+Н - донор водорода в реакциях восстановления при синтезе ряда соединений.
Анаболизм - ферментативный синтез основных макромолекул клетки, а также образование биологически активных соединений, требует затраты свободной энергии (АТФ, НАДФН+Н ).
Отличия катаболизма и анаболизма. Катаболизм – распад, запасание АТФ. Анаболизм – синтез, но потребление АТФ. Пути не совпадают, разное число реакций. Отличаются по локализации. Разная генетическая и аллостерическая регуляция.
Основной энергетический источник для человека – энергия, запасённая в химических связях пищевых продуктов. Соотношение Б:Ж:У = 1:1:4. 55% энергии человек получает за счёт углеводов, 15% - за счёт белков, 30% - за счёт жиров (80% приходится на животные жиры, а 20% - на растительные).
Суточная потребность человека в энергии – 3000 ккал. Суточная потребность человека в энергии зависит от: работы (при тяжёлой физической работе выше основной обмен), пола (у женщин величина обмена ниже на 6-10%), температуры (при повышении температуры тела на один градус величина обмена возрастает на 13%), возраста (с возрастом, начиная с 5 лет, величина основного обмена снижается).
За сутки в организме образуется и распадается около 60 кг АТФ. Цикл АТФ-АДФ работает постоянно. Он включает в себя использование АТФ для различных видов работы и регенерацию АТФ за счёт реакций катаболизма.
Унификация питательных веществ идёт в три фазы.
I. Подготовительная фаза. Высокомолекулярные соединения распадаются под действием гидролаз ЖКТ до мономеров. Протекает в ЖКТ и лизосомах. Не является поставщиком энергии (1%).
II фаза. Превращение мономеров в простые соединения - центральные метаболиты (ПВК, ацетилКоА). Эти продукты связывают 3 вида обмена, до 2-3 с, протекает в цитоплазме, завершается в митохондриях, даёт 20-30% энергии, поставляемой анаэробно.
III фаза. Цикл Кребса. Аэробные условия, полное окисление поступивших с пищей веществ, выделяется большое количество энергии и аккумулируется она в АТФ.
Анаболические пути расходятся
1 фаза. Синтез белков начинается с образования α-кетокислот.
2 фаза. Аминирование α-кетокислот, получение АМК.
фаза. Из АМК образуются белки. 2 СО2
Общий путь катаболизма. После образования ПВК дальнейший путь распада веществ до углекислого газа и воды происходит одинаково в общем пути катаболизма (ОПК). ОПК включает реакции окислительного декарбоксилирования ПВК и ЦТК. Реакции ОПК происходят в матриксе митохондрий и восстановленные коферменты передают водород на компоненты дыхательной цепи. Катаболические пути сходятся, вливаясь на третьей фазе в ЦТК.
На первой фазе белки дают 20 АМК. На второй фазе 20 АМК дают ацетилКоА и аммиак. На третьей фазе ЦТК даёт углекислый газ, воду и энергию.
Метаболические пути – совокупность катализируемых ферментами реакций, в ходе которых происходит превращение субстрата в продукт. Главные (основные) метаболические пути – универсальные, свойственные любой клетке. Поставляют энергию, синтез основных биополимеров клетки. Добавочные пути менее универсальны, характерны для определённых тканей и органов. Синтез важных веществ. Поставляют энергию в форме НАДФН+Н.
Цикл трикарбоновых кислот открыт в 1937 г Г.Кребсом, протекает в циклическом режиме в матриксе митохондрий, в каждый оборот ЦТК вступает в форме ацетилКоА одна ацетильная группа, 2 атома углерода, и при каждом обороте из цикла выводится 2 молекулы углекислого газа. Оксалоацетат в ЦТК не расходуется, так как он регенерирует.
Изомеризация цитрата - α –Кетоглутарат окисляется до сукцинилКоА и углекислого газа.
ЦТК – специфический механизм для расщепления ацетилКоА на 2 типа продуктов: углекислый газ – продукт полного окисления, восстановленные нуклеотиды, окисление которых является главным источником энергии.
При окислении одной молекулы ацетилКоА в ЦТК и системе окислительного фосфорилирования образуется 12 молекул АТФ: 1АТФ за счёт субстратного фосфорилирования, 11АТФ за счёт окислительного фосфорилирования. Энергия окисления аккумулируется в форме восстановленных нуклеотидов и 1АТФ. Валовое уравнение ЦТК - АцетилКоА + 3НАД + ФАД+ АДФ+Фн+2Н20→ 2СО2+ 3НАД+Н +ФАДН2+ АТФ + КоАSH
ЦТК – центральный метаболический путь. Функции ЦТК: интегрирующая, энергообразующая, анаболическая.
Взаимосвязь обмена веществ на уровне цикла Кребса.

Анаболическая функция ЦТК. Метаболиты цикла Кребса используются для синтеза различных веществ: углекислый газ в реакциях карбоксилирования, α-кетоглутарат → глу, оксалоацетат → глюкоза, сукцинат → гем.
ЦТК играет роль в процессах глюконеогенеза, переаминирования, дезаминирования, липогенеза.
Регуляция ЦТК. Регуляторные энзимы: цитратсинтаза, изоцитратДГ, α –кетоглутаратДГ комплекс.
Положительные аллостерические эффекторы цитратсинтазы - ЩУК, ацетилКоА, НАД, АДФ.
Отрицательные аллостерические эффекторы цитратсинтазы - АТФ, цитрат, НАДН+Н, жирные кислоты, повышение выше нормы концентрации сукцинилКоА.
Действие АТФ заключается в повышении Км для ацетилКоА. С увеличением концентрации АТФ снижается насыщение фермента ацетилКоА и в результате снижается образование цитрата.
Положительные аллостерические эффекторы изоцитратДГ - АДФ, НАД.
Отрицательные аллостерические эффекторы изоцитратДГ - АТФ, НАДН+Н.
Цикл Кребса регулируется по типу обратной связи: ингибируется АТФ, активируется АДФ. Гипоэнергетические состояния – состояния, при которых снижается синтез АТФ.
Гипоксия тканей из-за: снижения концентрации кислорода в воздухе, нарушения работы сердечно-сосудистой и дыхательной систем, анемии, гиповитаминозы, голодание.
Роль витаминов в цикле Кребса - рибофлавин (ФАД) - кофермент СДГ, α-кетоглутарат ДГ комплекса, РР (НАД) – кофермент МДГ,ИДГ, α-кетоглутарат ДГ, тиамин (ТПФ) - кофермент α-кетоглутарат ДГ комплекса, пантотеновая кислота (КоА): ацетилКоА, сукцинилКоА.
Биохимия нервной ткани.
Функции нервной ткани - Генерация электрического сигнала (нервного импульса). Проведение нервного импульса. Запоминание и хранение информации. Формирование эмоций и поведения. Мышление.
Функции липидов нервной ткани
Структурная – липиды входят в состав клеточных мембран нейронов
Липиды обеспечивают надёжную электрическую изоляцию
Защитная – ганглиозиды являются антиоксидантами и защищают ткань мозга при повреждении от перекисного окисления липидов
Регуляторная – фосфотидилинозиты являются предшественниками биологически активных веществ
В нервной ткани присутствуют: фосфолипиды, гликолипиды, холестерин, эфиры холестерина (в участках активной миелинизации). Фосфотидилинозит.
Инозитол-3-фосфат. Увеличивает концентрацию кальция. Кальций активирует ферменты клетки и способствует сокращению микрофиламентов, обеспечивая передвижение веществ в теле нервной клетки и аксоне
Диацилглицерол. Активируя протеинкиназу С, участвует в реакциях фосфорилирования белков клетки. Изменяет активность ферментов и скорость синтеза белков.
Обмен нуклеиновых кислот в нервной ткани. ДНК не синтезируется. Содержание и скорость синтеза РНК большая. Пиримидиновые нуклеотиды поступают из крови через гематоэнцефалический барьер. Пуриновые нуклеотиды синтезируются в нервной ткани. Циклические нуклеотиды (цАМФ, цГМФ) содержатся в нервной ткани в большом количестве.
Обмен углеводов и энергообеспечение нервной ткани. Основной путь получения энергии – аэробный распад глюкозы. Проникновение глюкозы в ткань мозга не зависит от действия инсулина (инсулин не проникает через гематоэнцефалический барьер). Влияние инсулина проявляется только в периферических нервах.
Необходим постоянный и непрерывный приток глюкозы и кислорода из крови. Содержание гликогена в нервной ткани очень мало (0,1% от массы мозга) .Окисления неуглеводных субстратов с целью получения энергии не происходит. При гипоксии и гипогликемии в нервной ткани образуется очень мало АТФ, быстро наступает коматозное состояние и необратимые изменения в клетках головного мозга. Энергия АТФ в нервной ткани используется неравномерно во времени: резкое повышение энергозатрат происходит при быстром переходе от сна к бодрствованию
Метаболизм белков и аминокислот в нервной ткани. Обмен белков и аминокислот идет очень интенсивно. Существуют специальные транспортные системы для транспорта аминокислот через мембраны. Ткань мозга способна синтезировать заменимые аминокислоты. 75% аминокислот составляют аспарагиновая и глутаминовая кислоты и их метаболиты (глутамин, глутатион, ГАМК).В спинном и головном мозге действует «ГАМК-шунт».
Роль глутаминовой кислоты в нервной ткани
Энергетическая – глутаминовая кислота связана с реакциями цикла Кребса
Глутаминовая и аспарагиновая кислоты участвуют в реакциях дезаминирования аминокислот с выделением аммиака
Из глутаминовой кислоты при декарбоксилировании образуется нейромедиатор ГАМК и синтезируется глутатион
Нейромедиаторы - это вещества, которые накапливаются в пресинаптической мембране, освобождаются при передаче нервного импульса, вызывают после связывания с постсинаптической мембраной изменение скорости метаболических процессов и возникновение электрического импульса. Имеют систему инактивации или специальную транспортную систему для удаления нейромедиаторов из синапса.
Синтез нейромедиаторов происходит в теле нейронов, а накопление – в особых везикулах, которые постепенно перемещаются с помощью нейрофиламентов и нейротрубочек по аксону к синапсам
Нейромедиаторы
Аминокислоты и их производные(таурин, ДОФАмин, ГАМК, глицин, ацетилхолин, гомоцистеин, адреналин, серотонин, гистамин).
Пептиды. Функционируют только в высших отделах нервной системы. Выполняют одновременно функцию нейромедиаторов и гормонов. Передают информацию от клетки к клетке по системе циркуляции
Нейрогипофизарные гормоны (вазопрессин, либерины, статины). Опиатоподобные пептиды – эндорфины (вызывают обезболивание, действуя на те же рецепторы, что и опиаты (морфин). Пептиды сна. Пептиды памяти (скотофобин, белок S-100). Образуются пептиды в результате реакций ограниченного протеолиза, а разрушаются под действием протеиназ.
Ответ. Рахит. Нарушение Са – Р обмена. Возможно вследствие дефицита витаминаD.
Билет 41.
Классификация простых белков, их характеристика (альбумины, глобулины, гистоны, протамины, протеиноиды). Физико – химические свойства простых белков.
Свободнорадикальное окисление. Понятие о перекисном окислении липидов.
У пациента с острыми болями в области сердца было установлено увеличение активности аминотрансфераз в крови. Активность какой из аминотрасфераз в наибольшей стапени увеличивается при этой патологии? Напишите реакцию, катализируемую этим ферментом, укажите кофермент.
Классификация простых белков - альбумины, глобулины, гистоны, протамины, протеиноиды. Содержат только белковую часть.
Альбумины - глобулярные белки, молекулярная масса 70 000, растворимы в воде, ИЭТ 5, высаливаются 100% сульфатом аммония, синтез в печени.
Функции альбуминов - депо белка в организме, осморегуляция, неспецифическая защита, транспорт лекарств, металлов, холестерина, билирубина, желчных пигментов, гормонов.
Глобулины - глобулярные белки, молекулярная масса 150 000 дальтон, растворимы в солевых растворах, ИЭТ 7, имеют ряд фракций, высаливаются 50% сульфатом аммония, синтезируются в печени и В-лимфоцитах.
Функции глобулинов - ферменты, транспорт витаминов, гормонов, металлов, защита (иммунитет), γ-глобулины являются антителами.
Гистоны - связаны с ДНК, молекулярная масса 20 000, ИЭТ 8, богаты лиз, арг, гис, имеют положительный заряд, содержат тирозин, защищают ДНК от нуклеаз.
Протамины - молекулярная масса 5000, ИЭТ 11, содержат много арг, лиз, имеют положительный заряд, не содержат тирозин, являются белковым компонентом нуклеопротеинов.
Проламины и глютелины - белки растительного происхождения, содержатся в семенах злаков, растворимы в 60-80% водном растворе, а другие простые белки выпадают в осадок, проламины содержат 20-25% глу и 10-15% пролина.
Протеиноиды. Фибриллярные белки: коллаген, эластин, кератины.
Треть общего белка организма приходится на коллаген – основной белок соединительной ткани, молекулярная масса коллагена 300 000, Содержится в: коже, роговице, костях. АМК состав коллагена - глицин -30%, гидроксипролин – 15%, пролин – 5%.
Строение коллагена - молекула коллагена состоит из 3 полипептидных цепей, в каждой примерно 1000 АМК, вторичная структура коллагена – 3 спирали перевиты друг с другом, образуя плотный жгут (тропоколлаген), все 3 цепи параллельны, то есть на одном конце коллагена N-концы цепей, а на другом С-концы. Молекулы коллагена, соединяясь, образуют микрофибриллы, из них образуются пучки волокон. Тройная спираль коллагена стабилизируется межцепочечными сшивками между лизиновыми и гидроксилизиновыми остатками. Гидроксипролин стабилизирует тройную спираль коллагена по отношению к действию протеиназ и действию протеолитических ферментов.
Уникальная особенность метаболизма гидроксипролина - эта АМК, входящая в состав белков пищи, не включается в коллаген, пищевой пролин является предшественником гидроксипролина в составе коллагена. На каждый моль гидроксилированного пролина декарбоксилируется 1 моль α-кетоглутарата с образованием сукцината. В результате реакции один атом кислорода поступает в сукцинат, а другой в пролин. Известно 19 типов коллагена.
Определённую роль в синтезе коллагена играют белки-шапероны, обеспечивающие «контроль качества» коллагена.
Ряд заболеваний связан с нарушением синтеза коллагена. Основная причина - мутации. Заболевания, связанные с нарушением синтеза коллагена - несовершенный остеогенез, хондродисплазии, семейная аневризма аорты.
По мере старения - фибриллы коллагена становятся более жёсткими и хрупкими, меняются свойства хрящей, сухожилий, роговицы.
Эластин - гликопротеин с множеством гидрофобных АМК, сеть полипептидных цепей, поперечно-связанных остатками десмозина, фибриллы эластина хорошо растягиваются, эластичность возникает за счёт наличия гибкой случайной конформации молекул эластина и большого количества эластичных сшивок, молекулярная масса 72 000 дальтон, основной структурный компонент эластических волокон, входит в состав кровеносных сосудов, связок, артерий.
α-кератины образуют волосы, шерсть, перья, рога, когти, чешую, наружный слой кожи. Строение α-кератинов - 3 α-спирали в волосе скручены одна вокруг другой, нерастворимы в воде, так как в их составе преобладают АМК с неполярными радикалами, на поверхности фибрилл находится большое количество гидрофобных радикалов.
Свободнорадикальное окисление.
Использование кислорода в организме. До 80-90% фонда кислорода расходуется на окисление субстратов в митохондриальной дыхательной цепи. Помимо тканевого дыхания кислород расходуется в реакциях микросомального окисления, в реакциях, катализируемых оксигеназами, монооксигеназами, диоксигеназами.
Свободный радикал – молекула с неспаренным электроном на орбите. Избыток кислорода повреждает мембраны. При гипероксии образуются свободные радикалы. Свободнорадикальное окисление – универсальный процесс, сопровождающий нормальную жизнедеятельность и активирующийся при патологии. Свободные радикалы образуются в живом организме в результате естественного метаболизма кислорода, а также в процессе окислительно-восстановительных превращений различных эндогенных субстратов, лекарств, ксенобиотиков. При физиологических условиях 5-6% потребляемого кислорода восстанавливается до О2.
Активные формы кислорода - перекись водорода, свободные радикалы: супероксидрадикал, гидроксилрадикал, оксид азота.
Активность форм кислорода. Свободные радикалы - промежуточные продукты нормального метаболизма. Образуются: при синтезе простагландинов, при синтезе стероидных гормонов, в дыхательной цепи, в цепи микросомального окисления, при фагоцитозе.
Образование активных форм кислорода
При восстановлении кислорода до воды образуются активные формы кислорода. Конечным этапом четырёхэлектронного восстановления кислорода является вода. Суммарно: О2 + 4ē + 4Н → 2 Н2О
Токсичность кислорода. Свободные радикалы вовлекаются в механизмы, повышающие выживаемость клеток в неблагоприятных условиях, а снижение генерации свободных радикалов в организме способствует ослаблению клеточного иммунитета.
Пути образования супероксидрадикалов.
Ферментативные. Супероксидрадикал может продуцироваться в клетках ферментами : ксантиноксидазой, НАДФ-оксидазой, альдегидоксидазой, дигидрооротатоксидазой. Источник супероксидрадикала – убихинон. В процессе одноэлектронного восстановления кислорода. Под влиянием УФО. Путём взаимодействия кислорода с ионами металлов переменной валентности.
Неферментативные пути - спонтанное окисление некоторых соединений: гидрохинонов, катехоламинов, лейкофлавинов, тетрагидроптеринов, фередоксина.
Гидрофильный супероксидрадикал не может покидать клетку и накапливается в цитоплазме. Его превращения приводят к образованию ряда активных окислителей. Супероксидрадикал способен активировать NO-синтазу, которая образует в тканях NO-радикал.
Оксид азота - вазодилятатор, антикоагулянт, снижает проницаемость сосудов, вторичный посредник: активирует растворимую гуанилатциклазу, продукт которой цГМФ проявляет вазодилятаторные свойства.
Супероксидрадикал способен снижать содержание оксида азота, превращая его в пероксинитрит ONOOH.
Пероксинитрит - может индуцировать апоптоз, в ходе распада может превращаться гидроксилрадикал. Токсичность нитратов и нитритов. Основное повреждающее и токсическое действие нитратов и нитритов осуществляется на стадии превращения нитритов в оксид азота. Нитриты стимулируют развитие лейкозов.
Перекисное окисление липидов физиологически необходимо для - синтеза простагландинов, синтеза лейкотриенов, фагоцитоза, пиноцитоза.
Тетрада ПОЛ - повреждение мембран и других липопротеинов, инактивация ферментов, подавление деления клеток, накопление инертных полимеров.
Для развития ПОЛ необходимо образование радикала жирной кислоты, лишённого атома водорода путём его отрыва. RH→R · → ROO· → ROOH Затем кислород внедряется в ПНЖК с образованием пероксидного радикала ROO· .ROO· с другой ПНЖК приводит к образованию гидропероксида ROOH и нового радикала R1 · .Гидропероксиды липидов ROOH в присутствии ионов железа распадаются с образованием RО· и ·ОН, поддерживая СРО.
В тканях ПОЛ имеет цепной характер. В клетках накапливаются вторичные продукты ПОЛ: альдегиды, кетоны, спирты. Накопление вторичных продуктов ПОЛ ведёт к гибели клетки. Фосфолипиды мембран содержат много ПНЖК, они легко окисляются.
Модификация белковых фрагментов под действием альдегидов. ПОЛ in vivo катализируется гемовыми соединениями, липооксигеназами тромбоцитов, липооксигеназами лейкоцитов.
Активация ПОЛ играет роль в развитии многих патологических процессов - лучевые поражения, злокачественный рост, гипоксия, ишемия, атеросклероз, старение, стресс.
Резкое усиление СРО при недостаточности АОС приводит к развитию «оксидантного стресса» - один из общих механизмов повреждения тканей организма. В организме существует две системы защиты от чужеродных агентов: иммунная, фагоцитарная. Достоинство иммунной системы – специфичность её реакций. Преимущество фагоцитарной системы – быстрое реагирование.
Гидрофобный АО α-токоферол прерывает ПОЛ , инициируемое в гидрофобном пространстве клеточных мембран.
Ответ.
 Кофермент – витаминB6.
Кофермент – витаминB6.
Билет 42.
Аминокислоты – структурные единицы белка. Классификация аминокислот по структуре радикала. Заменимые и незаменимые аминокислоты. Значение для организма незаменимых аминокислот.
Транспортные формы липидов. Роль липопротеинов в обмене холестерина.
При гриппе у детей может возникнуть тяжелая гипераммониемия, сопровождающаяся рвотой, потерей сознания, судорогами. Обнаружено, что вирус гриппа может вызывать нарушения синтеза карбамоилфосфатсинтетазы-1. Напишите реакцию, катализируемую этим ферментом в норме. Концентрация каких веществ в крови при этом состоянии увеличивается?
Классификация аминокислот
Все
встречающиеся в природе аминокислотыобладают общим свойством –амфотерностью(от греч. amphoteros – двусторонний), т.е.
каждаяаминокислотасодержит как минимум одну кислотную и
одну основную группы. Общий тип строения
α-аминокислот может быть представлен
в следующем виде:

Как видно из общей формулы, аминокислотыбудут отличаться друг от друга химической природой радикала R, представляющего группуатомоввмолекулеаминокислоты, связанную с α-углеродныматомоми не участвующую в образованиипептидной связиприсинтезе белка. Почти все α-амино- и α-карбоксильные группы участвуют в образованиипептидных связейбелковоймолекулы, теряя при этом свои специфические для свободныхаминокислоткислотно-основные свойства. Поэтому все разнообразие особенностей структуры и функции белковыхмолекулсвязано с химической природой и физико-химическими свойствами радикаловаминокислот. Именно благодаря имбелкинаделены рядом уникальных функций, не свойственных другимбиополимерам, и обладают химической индивидуальностью.
Классификацияаминокислотразработана на основе химического строения радикалов. Различают ароматические и алифатическиеаминокислоты, а такжеаминокислоты, содержащиесеруилигидроксильные группы. Частоклассификацияоснована на природе зарядааминокислоты. Если радикал нейтральный (такиеаминокислотысодержат только одну амино- и однукарбоксильную группы), то они называются нейтральнымиаминокислотами. Еслиаминокислотасодержит избыток амино- иликарбоксильных групп, то она называется соответственно основной или кислойаминокислотой.
Современная рациональная классификацияаминокислотоснована на полярности радикалов (R-групп), т.е. способности их к взаимодействию сводойпри физиологических значениях рН (близких к рН 7,0). Различают 5 классоваминокислот, содержащих следующие радикалы: 1) неполярные (гидрофобные); 2) полярные (гидрофильные); 3) ароматические (большей частью неполярные); 4) отрицательно заряженные и 5) положительно заряженные.
Существует около 28 аминокислот. В организме человека многие из них синтезируются в печени. Однако некоторые из них не могут быть синтезированы в организме, поэтому человек обязательно должен получать их с пищей. Такие аминокислоты называются незаменимыми и к ним относятся гистидин, изолейцин, лейцин, лизин, метионин, фенилаланин, треонин, триптофан и валин. Аминокислоты, которые синтезируются в печени, являются заменимыми и включают аланин, аргинин, аспарагин, аспартовую кислоту, цитруллин, цистеин, гамма-аминомасляную кислоту, глютамовую кислоту, глютамин, глицин, орнитин, пролин, серии, таурин, тирозин.
Процесс синтеза белков постоянно идет в организме. В случае, когда хоть одна незаменимая аминокислота отсутствует, образование белков приостанавливается. Это может привести к самым различным серьезным проблемам — от нарушения пищеварения до депрессии и замедления роста.
К дефициту аминокислот могут привести нарушение процессов всасывания из желудочно-кишечного тракта, инфекционные заболевания, травмы, стресс, прием некоторых лекарственных препаратов, процесс старения и дисбаланс других питательных веществ в организме (даже если вы потребляете достаточное количество белка).
Транспорт липидов.
Ресинтезированные в кишечнике липиды транспортируются в составе хиломикронов с лимфой. Липиды нерастворимы в воде, поэтому они транспортируются в ассоциации с белками.
Липопротеиды – комплексы белков и липидов, транспортная форма липидов в крови. Липиды ЛП: триглицериды, фосфолипиды, холестерин. Белки ЛП – апопротеины отдельных классов ЛП.
Функции апопротеинов - структурная (ЛП), транспортная, секреторная (нужны для секреции ЛП клетками печени и кишечника), необходимы для взаимодействия ЛП с рецепторами, активируют ферменты, участвующие в метаболизме ЛП, придают липидам водорастворимость, апопротеин А1 в ЛПВП активирует ЛХАТ.
Структура липопротеида. Гидрофобное ядро (эфиры холестерина, ТГ) окружено снаружи фосфолипидами, свободным холестерином, апобелками.
Классификация ЛП.
на основании подвижности в электрическом поле: - ХМ остаются на старте, - другие мигрируют к зонам глобулинов: ß-ЛП, пре- ß-ЛП, α-ЛП.
по величине гидратированной плотности (методом ультрацентрифугирования) ЛП делят на ХМ, ЛПОНП, ЛППП, ЛПНП, ЛПВП.
Биологическая роль ЛП. Эндогенные ТГ доставляются в периферические клетки для обеспечения потребности в энергии, а эндогенный холестерин – для биосинтеза мембран.
Состав и свойства липопротеинов.
Хиломикроны транспортируют экзогенные ТГ, холестерин, фосфолипиды пищевые жиры из кишечника в ткани через лимфатическую систему. В энтероцитах синтезируются незрелые ХМ, которые сначала попадают в лимфу , а затем в кровоток. Основной апопротеин ХМ – белок В-48 синтезируется в клетках слизистой кишечника, необходим для формирования структуры ХМ. В крови незрелые ХМ получают от ЛПВП другие апобелки – С- и Е- и превращаются в зрелые ХМ. Первым органом, через который должны пройти ХМ являются лёгкие. При поступлении ХМ из кишечника в кровь происходит активация тучных клеток с выходом гепарина и активацией липопротеинлипазы.
Адсорбтивная липемия - повышение количества липидов в крови, которое наступает после приёма пищи.
Липопротеидлипаза (просветляющий фактор) гидролизует ТАГ в ХМ и ЛПОНП, находится в эндотелии капилляров разных органов, активируется гепарином и увеличением в крови ТАГ. ТАГ хиломикронов расщепляются на поверхности и внутри гепатоцитов, на поверхности эндотелия капилляров жировой ткани.
ЛПОНП и ЛПВП - секретируются в кровь печенью, где осуществляется их синтез. ЛПНП образуются в кровотоке из ЛПОНП в результате гидролиза части ТГ ЛПОНП липопротеидлипазой.
Судьба ЛПНП. На плазматических мембранах клеток имеются рецепторы к ЛПНП. ЛПНП проникают в клетки, где под влиянием гидролаз лизосом распадаются на составные компоненты, свободный холестерин включается в состав плазматической мембраны или этерифицируется и в виде эфиров откладывается в цитоплазме. Возможен неспецифический эндоцитоз ЛПНП.
ЛПВП выносят холестерин в печень. В печени холестерин окисляется в желчные кислоты и удаляется через кишечник. Окисление холестерина происходит в печени монооксигеназной системой. 7а-гидроксилаза холестерина – лимитирующий фермент. ЛПВП способны акцептировать холестерин с клеточных мембран.
Превращение свободного холестерина в эстерифицированный: холестерин + лецитин → лизолецитин + сложный эфир холестерина. Эфир холестерина образуется на поверхности ЛПВП и переносится в ядро ЛПВП.
Снижение холестерина ЛПВП в плазме крови сопряжено со снижением ЛХАТ, количества частиц ЛПВП, лецитина, апопротеина А1.
Период полураспада. ХМ – меньше часа, ЛПОНП – 2-4 часа, ЛПНП – 2-4 суток, ЛПВП – 5 суток. ЛНП и ЛВП поглощаются путём эндоцитоза клетками печени, кишечника, жировой ткани, почек, надпочечников и разрушаются в лизосомах.
Неэстерифицированные жирные кислоты (НЭЖК). Жирные кислоты в плазме крови находятся в эстерифицированной форме: в составе фосфолипидов, эфиров холестерина, моно-, ди-, триглицеридов. В свободном виде жирные кислоты транспортируются в плазме из жировой ткани и печени к скелетным мышцам, в этом случае они связаны с альбумином.
НЭЖК поступают в плазму крови в результате липолиза ТГ, катализируемого липазой в жировой ткани, образуются при действии липопротеидлипазы на ТГ плазмы крови в период перехода их в ткани, жирные кислоты с длиной цепи менее 1о атомов углерода всасываются в неэстерифицированной форме через систему портального кровообращения и поступают в печень (это важно для детей, так как молоко богато жирными кислотами с короткой цепью).
Содержание НЭЖК - у взрослого: 0,3-0,6 ммоль/л, у ребёнка до 2,2 ммоль/л.
Триацилглицериды – транспортная форма для насыщенных жирных кислот. Фосфолипиды и холестерин - транспортная форма для полиненасыщенных жирных кислот.
Функции НЭЖК - дают 50% энергии при голодании, энергетический материал для миокарда, мышц, почек, печени, насыщенные жирные кислоты выполняют энергетическую, а ненасыщенные – пластическую функции.
Ответ.
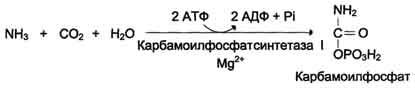 В крови больного повышается Аммиак,
глутамин, ион аммония NH4+.
В крови больного повышается Аммиак,
глутамин, ион аммония NH4+.
Билет 43.
Заменимые, незаменимые и условные аминокислоты. Кетопластичные и глюкопластичные аминокислоты. Аминокислотный пул. Пути его пополнения и использования. Биосинтез заменимых аминокислот.
Обмен кальция и фосфора в организме человека, регуляция обмена.
Каким превращениям подвергается лактат в печени в период восстановления после интенсивной мышечной работы? Напишите схему этих процессов.
Заменимые аминокислоты ( образуются из других аминокислот )
Биосинтез заменимых АМК. Ала, глу, асп – первичные АМК.
Пути синтеза: восстановительное аминирование, трансаминирование.
Глутамин синтезируется из глу под действием глутаминсинтетазы.
Аспарагин синтезируется из асп и глутамина.
Глицин синтезируется из серина.
Серин образуется из 3-фосфоглицерата.
Пролин образуется из глутамата.
Аргинин синтезируется в орнитиновом цикле.
Гистидин синтезируется из АТФ и рибозы.
Тирозин образуется из фенилаланина.
Цистеин синтезируется из метионина и серина.
Аланин Основной компонент соединительных тканей. Главный посредник в глюкозо-аланиновом цикле, позволяющий мышцам и другим тканям получать энергию из аминокислот. Укрепляет иммунную систему. Аспарагиновая кислота Помогает преобразовывать углеводы в мышечную энергию. Из нее строятся иммуноглобулины и антитела. Уменьшает уровень аммиака после тренировок. Глицин Помогает вырабатывать другие аминокислоты, является частью структуры гемоглобина и цитохромов (ферментов, участвующих в производстве энергии). Обладает успокаивающим эффектом, иногда применяется для лечения людей, страдающих припадками агрессивности и маниакально- депрессивным психозом. Производит глюкагон, который приводит в действие гликоген. Уменьшает желание есть сладкое. Глутаминовая кислота Главный - предшественник глутамина, пролина, агринина и глутатиона. Потенциальный источник энергии. Важная кислота для обменных процессов в мозгу и для обменных, процессов других аминокислот. Глутамин Наиболее распространенная кислота. Играет ключевую роль в работе иммунной системы. Важный источник энергии, особенно для почек и кишечника, когда приходится ограничить число калорий. Топливо для мозга - стимулирует умственную деятельность, способствует концентрации, укрепляет память. Орнитин В больших, дозах может увеличить секрецию гормона роста. Помогает работать печени и иммунной системе. Пролин Основной элемент для образования соединительных тканей и сердечной мышцы. Отвечает за мышечную энергию. Главный составной элемент коллагена. Серин Важная кислота для производства клеточной энергии. Стимулирует функции памяти и нервной системы. Укрепляет, иммунную систему. Таурин Помогает поглощению и уничтожению жиров. Может действовать как нейропередатчик в некоторых участках мозга и сетчатой оболочки глаза. Цистин Укрепляет соединительные ткани и усиливает антиокислительные процессы в организме. Способствует процессам заживления, стимулирует деятельность белых кровяных телец, помогает уменьшить болевые ощущения при воспалениях. Очень важная кислота для кожи и волос. Способствует заживлению ран.
