
- •Отдельное спасибо ребятам со второго потока лечебного факультета 2012 г.
- •1)Мультиферментные комплексы и изоферменты. Кдз определения активности изоферментов. Энзимодиагностика. Ферментативные лекарственные препараты.
- •2) Окисление жирных кислот. Внутриклеточная локализация и биоэнергетика процесса. Особенности обмена жк с нечетным количеством углеродных атомов и ненасыщенных жк.
- •3) О каком заболевании следует думать, если моча новорожденного ребенка дает положительную реакцию на наличие фенилпирувата? Какой молекулярный блок лежит в основе данной патологии?
- •1)Классификация ферментов. Общая характеристика класса лиаз. Коферменты лиазных рекций.
- •2) Регуляция липидного обмена. Гормоны влияющие на обмен липидов. Патология липидного обмена : гиперлипидемия, атеросклероз, липоидозы, жировое перерождение печени, ожирение.
- •1)Классификация гормонов по локализации рецеторов. Вторичные посредники действия гормонов.
- •2) Гемоглобин, его структура, синтез, виды. Гемоглобинозы.
- •1)Белки плазмы крови, место их синтеза, биологическая роль. Изменение белкового спектра сыворотки при различных заболеваниях. Белки острой фазы.
- •2) Глюкоза крови. Пути ее поступления и использования. Гексокиназная реакция – клучевая реакция углеводного обмена. Пусти превращения глюкозо-6-фосфата.
- •1)Дыхательная цепь. Ферментные комплексы дыхательной цепи, их локализация. Редокс-потенциалы ферментных систем. Ингибиторы переноса электронов.
- •2) Адреналин и норадреналин, их синтез и влияние на обмен веществ.
- •1)Особенности обмена в эритроцитах. Эритроцитарные энзимопатии. Синтез гема. Порфирин.
- •3) Оцените состояние больного по следующим данным анализа крови и мочи: глюкоза крови – 10,0 ммоль/л, рН крови – 7,30, в моче обнаружены глюкоза, кетоновые тела.
- •1)Эндокринная система оргранизма. Классификация гормонов по химической структуре, их роль в регуляции обменных процессов. Причины эндокринных заболеваний. Механизм действия гормонов.
- •Причины заболеваний эндокринной системы.
- •1)Биологические мембраны, их структурные компоненты. Функции биологических мембран.
- •2) Патология углеводного обмена. Сахарный диабет. Нарушение углеводного и липидного обмена при этом заболевании.
- •1. Гипергликемия вызвана:
- •3) В крови больного повышена активность липазы, амилазы, трипсина. О какой патологии следует думать? Какие реакции катализируются данными ферментами?
- •1) Классификация ферментов. Общая характеристика класса трансфераз. Основные подклассы. Коферменты трансферазных реакций.
- •2)Напишите последовательность реакций превращения ацетил-КоА в мевалоновую кислоту в процессе синтеза холестерина. Укажите ферменты и коферменты.
- •3) Биохимический анализ нормальной и патологической мочи. Глюкозурия, протеинурия, кетонурия, билирубинурия.
- •2) Витамины, их классификация. Витамин в12 и фолиевая кислота, участие в обмене веществ и признаки витаминной недостаточности.
- •3) Какие изменения белкового спектра будут наблюдаться при остром воспалении? Что такое белки «острой фазы»? Диагностическое значение определения их концентрации в крови.
- •1)Роль воды в организме. Водный баланс, его регуляция и патология. Макроэлементы: натрий, калий, хлор, магний.
- •2) Биосинтез днк (репликация). Биосинтез рнк (транскрипция). Посттранскрипционный процессинг рнк. Основные положения аминокислотного кода. Обратная транскрипция.
- •2)Витамин в6, биотин, их химическая структура и признаки витаминной недостаточности. Участие в обмене веществ.
- •3)Будет ли протекать глюконеогенез, если в клетке цитратный цикл и дыхательная цепь полностью ингибированы. Ответ поясните.
- •1)Классификация и характеристика сложных белков (липопротеины, хромопротеины, гликопротеины, нуклеопротеины, фосфопротеины).
- •2) Вторичный липолиз триглицеридов. Окисление глицерина до конеч¬ных продуктов (со2 и н2о). Биоэнергетика процесса.
- •1)Структура гликогена, синтез и распад гликогена в печени и мышцах. Гликогенозы.
- •2) Изогидрия. Механизмы поддержания изогидрии. Ацидоз и алкалоз.
- •3) Сипмтомами авитаминоза в1 является расстройство нервной систе¬мы, потеря памяти, изменение психики. Почему к дефициту витамина в1 особо чув¬ствительна центральная нервная система?
- •1)Паратгормон и тиреокальцитонин. Влияние гормонов на обмен кальция и фосфора в организме человека
- •2) Сопряжение обмена углеводов и липидов. Сопряжение обмена углеводов и аминокислот. Пути превращения и образования пировиноградной кислоты.
- •1)Обмен и биологическое значение серосодержащих аминокислот (метионин и цистеин). Участие метионина в реакциях трансметилирования. Молекулярная патология обмена этих аминокислот.
- •2) Микроэлементы: селен, цинк, марганец, стронций, фтор, йод, молибден. Микроэлементозы.
- •3) Оценить состояние больного, если: рН крови - 7,31, рН мочи - 4,8. Общее содержание со2 в крови повышено. РСо2 - 80 мм рт ст. Титрометрическая кислотность мочи повышена.
- •1)Основные пути обмена аминокислот: декарбоксилирование, дезаминирование. Биологическая роль биогенных аминов.
- •2) Витамины р и с, их структура, признаки витаминной недостаточности, влияние на обмен веществ.
- •3) У больного после переливания крови развилась желтуха. Какой вид желтухи можно заподозрить? Как изменились показатели пигментного обмена в крови и моче?
- •1)Классификация ферментов. Общая характеристика класса оксидоредуктаз. Коферменты оксидоредуктазных реакций.
- •Характеристика фермента
- •2) Гормональная регуляция углеводного обмена. Гормоны, повышающие и понижающие уровень глюкозы в крови. Механизм их действия.
- •3) В крови снижено содержание мочевины. Нарушение какого метаболического пути можно предположить, каковы возможные причины этих нарушений?
- •1)Понятие об обмене веществ. Процессы анаболизма и катаболизма, их характеристика и взаимосвязь. Виды метаболических путей. Центральные метаболиты.
- •I . Подготовительная фаза.
- •II фаза. Превращение мономеров в простые соединения - центральные метаболиты (пвк, ацетилКоА)
- •III фаза. Цикл Кребса
- •2) Витамины рр и в2, структура, признаки витаминной недостаточности и участие в обмене веществ.
- •1)Обмен и биологическое значение глутаминовой и аспарагиновой аминокислот в организме человека.
- •2)Микроэлементы: железо, медь и кобальт. Их роль в организме. Понятие о микроэлементозах.
- •3) Пациенту в лечебных целях назначили диету с низким содержанием углеводов. Концентрация глюкозы в крови нормальная. За счет каких процессов преимущественно поддерживается уровень глюкозы в крови?
- •1) Основные пути промежуточного обмена аминокислот. Трансаминирование. Клиническое значение определения активности трансаминаз.
- •2) Антиоксидантная система организма. Неферментативные антиоксиданты. Антиоксидантные ферменты.
- •1)Гормоны передней доли гипофиза, их химическая структура и влияние на обмен веществ. Последствия изменений продукции соматотропного гормона в организме.
- •2)Глюконеогенез. Основные субстраты, ключевые ферменты процесса. Цикл Кори
- •3)Больной 50 лет поступил в клинику с жалобами на резкие боли в области сердца, слабость. Активность каких ферментов следует определить в крови больного для исключения инфаркта миокарда?
- •1)Холестерин, его биологическая роль, биосинтез. Гиперхолестеринемии. Атеросклероз.
- •2) Кровь, ее роль в организме. Химический состав плазмы. Калликреин-кининовая система.
- •3)Для лечения подагры применяется аллопуринол, структурный аналог гипоксантина. Объясните биохимический механизм действия данного лекарственного средства.
- •1)Кинетика ферментативных реакций. Зависимость скорости ферментативных реакции от концентрации субстрата и фермента, рН и температуры среды. Принципы количественного определения активности ферментов.
- •1. Зависимость скорости реакции от температуры
- •2. Зависимость скорости реакции от рН
- •3. Зависимость скорости реакции от концентрации субстрата
- •4. Зависимость от концентрации фермента
- •2) Синтез жирных кислот. Внутриклеточная локализация. Биосинтез триацилглицеролов.
- •1)Нуклеопротеины и нуклеиновые кислоты. Структурная организация молекул днк и рнк. Распад нуклеопротеинов в пищеварительном тракте. Нуклеотидный пул клеток, пути его пополнения и расходования.
- •2)Витамины а, е, к, влияние на обмен веществ, признаки витаминной недостаточности.
- •3)Оценить состояние больного по следующим данным анализа крови: активность креатинфосфокиназы повышена, общая активность лдг повышена, преимущественно за счет лдг1. Коэффициент де Ритиса - 1,90.
- •1)Биологическая роль печени. Роль печени в обмене углеводов, липидов, аминокислот и белков. Антитоксическая роль печени.
- •2)Биосинтез пуриновых и пиримидиновых нуклеотидов. Оротовая ацидурия.
- •1)Распад гемоглобина. Образование билирубина и продуктов его обмена. Характеристика прямого и непрямого билирубина. Диагностическое значиние их определения. Классификация желтух.
- •2)Глюкоза крови. Гипергликемия, гипогликемия, глюкозурия. Диагностическое значение определния глюкозы в крови и моче.
- •1)Гликолиз. Биологическая роль, химизм процесса, биоэнергетика, регуляция. Эффект Пастера.
- •2)Витамин d. Химическая природа витамина, гормонально-активные формы. Участие витамина в обмене веществ. Рахит.
- •3)Какова судьба гемоглобина, попавшего в плазму крови в результате гемолиза эритроцитов?
- •2. Регуляция и патология белкового обмена
- •3. Ответ. Поражение тканей печени. За счет изофермента лдг 4 и 5
- •1. 4,5 8,0 4,3
- •2. 6,1 14,0 10,0
- •2.Биохимия мышечной ткани
- •3. Ответ: 1 пациент – норма, 2 пациент – сахарный диабет.
- •1. Переваривание белков. Диагностическое значение биохимического анализа желудочного и дуоденального сока.
- •Условно заменимые аминокислоты ( могут образоваться из других кислот в организме )
- •Незаменимые аминокислоты ( нужно употреблять каждый день с пищей )
3. Ответ. Поражение тканей печени. За счет изофермента лдг 4 и 5
Билет 32.
Химическая природа ферментов. Активный и аллостерический центры, их роль.
Апотомический путь обмена глюкозы. Окислительная и неокислительная ветви процесса. Биологическое значение пентозного цикла.
Аммиак является раздражителем нервной системы. При введении глутаминовой кислоты больным эпилепсией их состояние улучшается: частота приступов, судорог снижается. Почему? Напишите, какие биохимические реакции происходят в мозгу при введении глутаминовой кислоты?
Структура и общие свойства ферментов.
Энзимология – наука о ферментах. Фермент – биологический катализатор белковой природы. Энзимология появилась на стыке химической, биологической и медицинской наук.
Значение ферментов - любые химические превращения веществ в организме происходят при участии ферментов, практическое применение ферментов во всех областях деятельности, где речь идёт о живых существах: хлебопечение, виноделие, сыроварение, чайное, кожевенное, меховое производство.
В настоящее время известно 10 000 ферментов, 500 получено в кристаллическом состоянии.
Доказательства белковой природы ферментов все выделенные ферменты – белки, методы получение ферментов и белков одинаковы, факторы, вызывающие денатурацию белка, вызывают инактивацию ферментов, при гидролизе ферменты дают аминокислоты, ферменты обладают высокой специфичностью.
Ферменты могут быть простыми белками - пепсин, трипсин, уреаза, лизоцим. Ферменты могут быть сложными белками - ЛДГ, трансаминазы. Сложные ферменты помимо белковой части содержат небелковую часть – кофермент. Субстрат – вещество, на которое действует фермент и которое им активируется.
Активный центр фермента – несколько аминокислотных остатков, которые в ходе ферментативного катализа взаимодействуют с субстратом. У сложных ферментов в активный центр входят и простетические группы (коферменты). Для формирования активного центра имеют значение третичная и четвертичная структуры фермента, так как в активный центр входят аминокислоты, расположенные далеко друг от друга. Наиболее часто в активный центр входят 3-5 аминокислот.
Часто встречаются в активном центре гис, лиз, арг, асп, глу, сер, тир, цис.
Для проявления активности фермента необходимо наличие функциональных групп.
Инактивация ферментов. Факторы, вызывающие денатурацию, вызывают потерю ферментативной активности, так как происходит разрыв дисульфидных связей, которые способствуют формированию третичной структуры.
Отличия ферментов от неорганических катализаторов - высокая молекулярная активность, лабильность - ферменты действуют при относительно мягких условиях (t, рН, давление), специфичность действия, регуляция ферментов нейрогуморальным путём с участием других ферментов. Структура активного центра фермента комплементарна структуре его субстрата.
Помимо активного центра, вмолекулеферментаможет присутствовать такжеаллостерический центр (или центры) (от греч. allos – другой, иной и steros – пространственный, структурный), представляющий собой участок молекулыфермента, с которым связываются определенные, обычно низкомолекулярные,вещества(эффекторы, или модификаторы),молекулыкоторых отличаются по структуре отсубстратов. Присоединение эффектора к аллостерическому центру изменяет третичную и часто также четвертичную структурумолекулыферментаи соответственно конфигурациюактивного центра, вызывая снижение или повышение энзимати-ческойактивности.Ферменты,активностькаталитического центра которых подвергается изменению под влиянием аллостерических эффекторов, связывающихся с аллостерическим центром, получили название аллостерическихферментов.
Отличительной особенностью ряда аллостерических ферментовявляется наличие вмолекулеолигомерногоферментанесколькихактивных центрови нескольких аллостерических регуляторных центров, пространственно удаленных друг от друга. В аллостерическомферментекаждый из двух симметрично построенных протомеров содержит одинактивный центр, связывающийсубстратS, и один аллостерический центр, связывающий эффектор М2, т.е. 2 центра в одной молекулефермента. Получены доказательства, что длясубстратааллостерическиеферменты, помимоактивного центра, содержат и так называемые эффекторные центры; при связывании с эффекторным центромсубстратне подвергается каталитическому превращению, однако он влияет на каталитическую эффективностьактивного центра. Подобные взаимодействия между центрами, связывающимилигандыодного типа, принято называть гомотропными взаимодействиями, а взаимодействия между центрами, связывающимилигандыразных типов, –гетеротропными взаимодействиями.
Апотомический распад глюкозы иначе называется пентозофосфатным циклом. В результате протекания этого пути из 6 молекул глюкозо-6-фосфата распадается одна. Апотомический распад можно разделить на две фазы: окислительную и анаэробную. Рассмотрим отдельные реакции этого метаболического пути.
Окислительная фаза апотомического распада глюкозы. Как и в гликолизе первой стадией является фосфорилирование глюкозы с образованием глюкозо-6-фосфата. Далее глюкозо-6-фосфат дегидрируется с участием глюкозо-6-фосфатдегидрогеназы, коферментом которой служит НАДФ. Образующийся 6-фосфоглюконолактон спонтанно или с участием лактоназы гидролизуется с образованием 6-фосфоглюконовой кислоты. Заключительным процессом окислительной ветви пентозофосфатного цикла является окисление 6-фосфоглюконовой кислоты соответствующей дегидрогеназой. Одновременно с процессом дегидрирования происходит декарбоксилирование 6-фосфоглюконовой кислоты. С потерей одного углеродного атома глюкоза превращается в пентозу:

Анаэробная
фаза апотомического распада глюкозы.
Рибулозо-5-фосфат,
образовавшийся в окислительной фазе,
может обратимо изомеризоваться в другие
пентозофосфаты: ксилулозо-5-фосфат и
рибозо-5-фосфат. Катализируют эти реакции
два разных фермента, относящиеся к
классу изомераз: пентозофосфат изомераза
и пентозофосфат эпимераза. Образование
из рибулозо-5-фосфата двух других
пентозофосфатов необходимо для
осуществления последующих реакций
пентозофосфатного цикла, причем требуется
две молекулы ксилулозо-5-фосфата и одна
молекула рибозо-5-фосфата.

Далее идут реакции с участием ферментов трансфераз, переносящих молекулярные остатки - трансальдолазы и транскетолазы.
Гамма-аминомасляная кислота в организме образуется из другой аминокислоты -- глутаминовой -- в реакции декарбоксилирования. Гамма-аминомасляная кислота синтезируется только в нервной системе при посредстве глутаматдекарбоксилазы: HOOC-CH2-CH2-CH(NH2)-COOH→ HOOC-CH2-CH2-CH2-NH2 + СО2
Глутаминовая кислота ГАМК
Цикл превращений в мозге включает такие сопряженные ферментативные реакции, как декарбоксилирование глутамата с образованием ГАМК под действием глутаматдекарбоксилазы, так и переаминирование ГАМК ГАМК-трансаминазой в глутамат с образованием янтарного полуальдегида.
HOOC-CH2-CH2-CH2-NH2 →HOOC-CH2-CH2-CH(O)
ГАМК Янтарный полуальдегид.
Гамма-аминомасляная кислота является основным ингибиторным трансмиттером (передатчиком) в ЦНС. Она осуществляет нейрональную трансмиссию в 1/3 всех синапсов головного и спинного мозга. ГАМК играет важную роль в регуляции двигательных функций. При этом особенностью нейротрансмиттерной организации супраспинальных двигательных центров (в первую очередь базальных ганглиев и коры мозжечка) является большое количество ГАМК-ергических нейронов, оказывающих тормозное влияние на активность спинальных интер- и мотонейронов через ингибиторные ГАМК-ергические системы, которые, переключаясь в зрительном бугре, церебральной коре и/или двигательных ядрах мезодиэнцефальной области и мозгового ствола, идут в составе руброспинального, вестибулоспинального и ретикулоспинального трактов. В спинном мозге ГАМК выполняет функции ингибиторного трансмиттера как на пресинаптических рецепторах, локализованных на терминалях афферентных проекций, так и на постсинаптических рецепторах мотонейронов и интернейронов.
Билет 33.
Основные функции белков в организме. Структурная организация белковой молекулы. Особенности формирования первичной, вторичной, третичной и четвертичной структур белка.
Образование и распад ацетоновых тел. Кетогенез в норме и патологии.
В эксперименте с изолированными митохондриями в качестве субстрата использовали малат. Как изменится показатель Р/О, если: а)в инкубационную смесь добавить ингибитор НАДН-дегидрогиназы? Б)вместе с ингибитором добавить сукцинат?
Белки - высокомолекулярные азотсодержащие органические вещества, молекулы которых построены из остатков АМК, составляют основу и структуры, и функции живых организмов. Каждый организм характеризуется уникальным набором белков.
Многогранность функций белков обеспечивает способность белков строго избирательно, специфически соединяться с широким кругом разнообразных веществ.
На долю белков приходится - 70-80 % в: мышцах, печени, селезёнке, почках. - 45 % во всём теле человека от сухой массы.
Состав белков. Помимо углерода, кислорода, водорода, входящих в состав почти всех органических полимерных молекул, обязательным компонентом белков является азот. Содержание азота в белках довольно постоянно – 16% , поэтому иногда количество белка в биологических объектах определяют по содержанию белкового азота.
Белки - самый многочисленный класс макромолекул, полипептиды, содержащие 100 и более АМК, соединённых пептидными связями. Пептидные связи – ковалентные, уникальны по размерам. Специфические особенности белков определяются - длиной пептидной цепи, различиями АМК состава, порядком чередования АМК.
Аминокислотный состав белков. Помимо 20 АМК в некоторых белках обнаружены и другие АМК, а также их производные: оксипролин, оксилизин в коллагене, дийодтирозин в тироксине, γ-карбоксиглутаминовая кислота в протромбине, селеноцистеин в ГПО.
Первичная структура белка - порядок, последовательность расположения АМК в полипептидной цепи.
Свойства первичной структуры белка - уникальна, детерминирована генетически, её стабильность обеспечивается в основном пептидными связями, возможно участие небольшого числа дисульфидных связей, в первичной структуре детерминированы вторичная, третичная и четвертичная структуры белковой молекулы, в полипептидной цепи могут быть обнаружены разнообразные комбинации АМК: не во всех белках содержатся все 20 АМК, ни в одном белке АМК не содержатся в эквивалентных отношениях, некоторые АМК встречаются редко и в меньшем количестве (гли в 10 раз чаще, чем три). Принцип структурного подобия (в белках встречаются идентичные пептидные структуры), в состав полипептидной цепи входит 100-1000 АМК.
По частоте обнаружения АМК делят на - постоянно встречающиеся, изредка встречающиеся. Для определения АМК состава белки гидролизуют.
Даже небольшие изменения первичной структуры изменяют свойства белков.
HbA1 - у здоровых людей,
HbS - у больных серповидно-клеточной анемией. HbS в шестом положении β-цепи вместо глу имеет валин. Отличается по физическим, химическим и биологическим свойствам.
Вторичная структура - пространственное расположение полипептидной цепи, поддерживаемое водородными связями С=О … Н-N между фрагментами цепи. Связи нековалентные, непрочные.
Типы вторичной структуры - α-спираль - устойчивая винтовая лестница, закрученная по часовой стрелке, NН-группа остатка АМК взаимодействует с СО – группой четвёртого от него остатка, на виток приходится 3,6 АМК остатка, 5,4 Å – шаг спирали (расстояние между витками).
АМК формирующие α-спираль: ала, лей, глн, цис, фен, тир, три, мет, вал, дестабилизирующие α-спираль: сер, иле, тре, глу, лиз, арг, гли, асп, нарушающие α-спираль: про, оксипролин.
Белки с α-спиралью: гемоглобин, миоглобин.
β-складчатость пептидные цепи располагаются параллельно друг другу в один слой, подобно листу, сложенному гармошкой. На каждой плоскости образуются пептидные связи и радикалы выходят из структуры.
Полипептидные цепи могут формировать параллельные или антипараллельные β-структуры.
Складчатые структуры. В белках встречаются области с нерегулярной вторичной структурой, которые называются беспорядочными клубками. Во многих белках присутствует и α-спираль и β-складчатость.
Белки с β-складчатостью β-кератины (фиброин шёлка), фибриллярные белки волос, шёлка.
Надвторичные структуры агрегаты полипептидных цепей, обладающих собственной вторичной структурой и образующихся в белках в результате их термодинамической или кинетической стабильности (βαβαβ-сегменты).
Домен - компактная глобулярная структурная единица внутри полипептидных цепей. Домены создаются объединением и чередованием α-цепей и β-слоёв, между которыми находятся рыхлые структуры. Домены могут выполнять разные функции. Центры связывания белка с лигандом часто располагаются между доменами.
Третичная структура - пространственное расположение пептидной цепи, поддерживаемое межрадикальными связями. Все биологические свойства белков связаны с сохранностью их третичной структуры.
Связи дисульфидная – ковалентная, все остальные связи нековалентны: гидрофобные – между аминогруппами с неполярными радикалами (вал, мет, ала, фен, иле), водородные между полярными радикалами (OH, NH2, SH, COOH), ионные - между заряженными полярными радикалами (лиз, арг, гис, асп, глу).
Белки с известной третичной структурой гемоглобин, трипсин, лизоцим, инсулин, цитохром.
Методы изучения третичной структуры рентгеноструктурный анализ, электронное микроскопирование.
Формы конформаций - Т-форма,R-форма. Фолдинг – процесс укладки синтезированной полипептидной цепи. Описан ряд наследственных заболеваний человека, развитие которых связывают с нарушением вследствие мутаций фолдинга: пигментозы, фиброзы.
Белки теплового шока (шапероны) - располагаются между N-концевым сигнальным пептидом и матричным белком, стресслимитирующая система, играют роль в адаптационной стабилизации клеточных структур, в реализации стресс-реакции.
Функции шаперонов способность предотвращать образование из полипептидной цепи неспецифических (хаотичных) беспорядочных клубков обеспечение транспорта их к субклеточным мишеням, создавая условия для завершения свёртывания белковой молекулы
Четвертичная структура. Белок может состоять из нескольких цепей, число и взаиморасположение в пространстве которых различно. Олигомерные белки состоят из нескольких полипептидных цепей: гемоглобин -4, гексокиназа – 2, ГЛДГ -6, ферритин -24.
Связи, поддерживающие четвертичную структуру - гидрофобные, ионные, водородные.
Белки с известной четвертичной структурой - гемоглобин, ГЛДГ, миоглобин, ГК.
Каждый белок характеризуется уникальной структурой, обеспечивающей уникальность его функций.
Пептиды - органические молекулы, в состав которых входит несколько (до 30) остатков АМК, связанных пептидной связью, низкомолекулярные пептиды содержат от 2 до 10 АМК (трипептиды), пептиды со средней молекулярной массой – от 500 до 5000 Д, так называемые, «средние» молекулы, высокомолекулярные пептиды с молекулярной массой от 5000 до 16000 Д.
Различают: пептиды – гормоны: вазопрессин, окситоцин, глюкагон, пептиды, участвующие в регуляции пищеварения: гастрин, секретин, пептиды крови: глутатион, каллидин, нейропептиды: пептиды памяти, сна, эндорфины, энкефалины, пептиды, участвующие в сокращении мышц, пептиды – внутренние эндотоксины («средние» молекулы).
Функции белков - структурная, каталитическая, регуляторная, рецепторная, иммунологическая, защитная, транспортная, сократительная, опорная, обезвреживающая, энергетическая, геннорегуляторная, создание биопотенциалов мембран, гомеостатическая, индивидуальное строение органов, обеспечивают хорошее зрение.
В соответствии с функциональным принципом различают 12 главных классов белков - ферменты, гормоны-белки, белки-регуляторы активности генома, защитные белки, токсические белки, транспортные белки, мембранные белки, сократительные белки, рецепторные белки, ингибиторы ферментов, белки вирусной оболочки, белки с иными функциями.
Биосинтез и распад ацетоновых тел.
Жирные кислоты поступающие в гепатоциты, активируются и подвергаются b-окислению с образованием ацетилКоА. Именно этот ацетилКоА используется для синтеза ацетоновых тел.
В ходе первой реакции (в первую реакцию вступают 2 молекулы ацетилКоА, фермент ацетилКоА-ацетилтрансфераза = тиолаза) образуется 4-х углеродная молекула ацетоацетилКоА. Эти соединения макроэргические поэтому в этом синтезе не принимает участие АТФ.
В ходе следующей реакции (фермент b-гидрокси-b-метил-глюкоил-КоА-синтетаза) (в последующем вы увидите, что первые этапы биосинтеза ацетоновых тел и холестерина абсолютно равнозначны. Это одна из ключевых реакций синтеза ацетоновых тел) используется еще одна молекула ацетилКоА, вода. Образуется 6-и углеродная молекула - b-гидрокси-b-метил-глютарил-КоА.
Последняя реакция - лиазная (катализирует фермент ГМГ-лиаза), происходит отщепление ацетилКоА и образование 4-х углеродной молекулы - ацетоацетата.
Из ацетоуксусной кислоты спонтанно, чаще всего, или иногда за счет декарбоксилазы происходит отщепление карбоксильной группы в виде углекислого газа и образуется ацетон.
Ацетоуксусная кислота восстанавливается в ходе реакции катализируемой ферментом b-гидроксибутератдегидрог иназой с использованием НАД+Н+, в итоге образуется b-гидроксимасляная кислота. Это третий составной элемент ацетоновых тел.
Образовавшиеся ацетоновые тела поступают из гепатоцитов в кровь и разносятся к клеткам. Процесс синтеза ацетоновых тел идет постоянно и ацетоновые тела всегда присутствуют в крови в концентрации 30мг/л. При голодании их содержание может увеличиваться до 400-500 мг/л. Еще больше концентрация при сахарном диабете в тяжелой форме до 3000-4000 мг/л.
Ацетоновые тела в норме хорошо утилизируются клетками периферических тканей, в особенности это касается скелетных мышц и миокарда. Скелетные мышцы и миокард значительную часть нужной им энергии получают за счет окисления ацетоновых тел. Только нервные клетки в обычных условиях не утилизируют ацетоновые тела, однако при голодании даже головной мозг 50-75% соей потребности в энергии удовлетворяет за счет окисления ацетоновых тел.
Ацетоацетат, поступающий в клетки различных тканей, прежде всего подвергается активации помощью одного из двух механизмов.
Ацетоацетат с участием фермента тиокиназы, за счет энергии АТФ превращается в ацетоацетилКоА.
Второй путь, является превалирующим в активации, это за счет фермента тиофоразы. Реакция, в которой принимают участие сукцениКоА и ацетоацетат, приводит к образованию ацетоацетилКоА и образование сукцината, который далее окисляется в цикле Кребса.
Образующийся ацетоацетилКоА далее дает 2 молекулы ацетилКоА (принимает участие НSКоА, это тиолазная реакция)
АцетилКоА поступает в цикл Кребса, где ацетильные остатки окисляются до углекислого газа и воды.
Биологическая роль
Ацетоновые тела по значимости - 3 тип топливной энергии.В гепатоцитах нет фермента тиофоразы, поэтому образовавшийся в гепатоцитах ацетоацетат не активируется и не окисляется. Таким образом печень экспортирует ацетоацетат, другими словами синтезирует этот вид топлива для других клеток.
b-гидроксибутерат окисляется путем дегидрироания в ацетоацетат, дальше ацетоацетат в ацетилКоА.
Что касается ацетона, возможно 2 варианта окисления. Дело в том, что ацетон очень летуч поэтому большое количество выделяется вместе с выдыхаемым воздухом, кроме того ацетон выделяется с водой. 1 путь: Ацетон расщепляется до ацетильного и формильного остатка. 2 путь: Через пропандиол он превращается в пируват.
Ацетоновые тела накапливаясь в крови и тканях оказывают ингибирующие действие на липолиз, в особенности это касается расщепление триглицеридов в липоцитах. Дело в том, что избыточное накопление в крови ацетоновых тел приводит к развитию ацидоза. Снижение уровня липолиза в клетках жировой ткани приводит к уменьшению притока жирных кислот в гепатоциты, к снижению скорости образования ацетоновых тел и следовательно к снижению содержания в крови.
Кетоновые тела образуются из ацетил-КоА, синтезируются в печени. Содержание кетоновых тел в крови здоровых людей: 0,8 – 1,2 ммоль/л. Источники синтеза кетоновых тел жирные кислоты, кетопластичные АМК. Избыток ацетил-КоА, высвобожденный при окислении жирных кислот и не использованный печенью, превращается в кетоновые тела, которые переносятся кровью в периферические ткани, где используются в ЦТК.
Кетоновые тела – поставщики топлива для мышц, почек, мозга. Для мозга основным энергетическим субстратом являются глюкоза и кетоновые тела.
Инсулин ингибирует образование ацетоновых тел.
Глюкагон - активирует синтез ацетоновых тел, тормозит синтез жирных кислот за счёт блокады ацетил-КоАкарбоксилазы, усиливает β-окисление, тормозит обмен глюкозы.
Кетонемия, кетонурия наблюдаются при сахарном диабете, голодании, длительной мышечной работе, токсикозе беременных, приёме пищи, богатой жирами. Развивается метаболический ацидоз.
В мозге новорожденных кетоновые тела потребляются в 3 раза интенсивнее, чем у взрослых. В раннем детстве они используются тканью мозга для синтеза жирных кислот при миелинизации мозга.
Склонность к кетозу повышена у детей в возрасте от 2 до 10 лет, так как снижена концентрация глюкозы и повышена концентрация НЭЖК, нарушен АМК обмен (кетогенные кислоты).
ОТВЕТ:
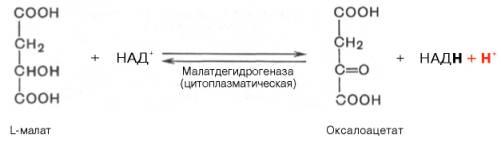

а) При добавлении амитала натрия (ингибитора NADH-дегидрогеназы) ингибируется I комплекс, следовательно P/O = 0
б) При добавлении вместе с амилатом сукцината, ингибируется I комплекс, но при этом сукцинат запускает II комплекс и P/O=2
Билет 34.
Классификация ферментов. Общая характеристика класса гидролаз. Основные подклассы гидролаз.
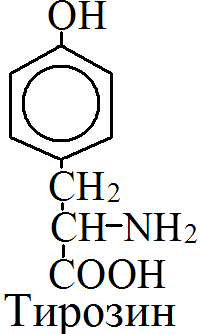
Обмен и биологическое значение фенилаланина и тирозина. Молекулярная патология обмена этих аминокислот.
Сколько молекул глюкозы надо разрушить до лактата, чтобы получить то же количество АТФ, которое образуется при полном распаде молекулы глюкозы (до CO2 и H2O). Обоснуйте ответ.
Классификация ферментов.
Номенклатура ферментов - название субстрата, реакция, катализируемая ферментом, аза – окончание.
В основе классификации лежит тип катализируемой реакции.
Оксидоредуктазы катализируют окислительно-восстановительные реакции.
Трансферазы - реакции с переносом групп.
Гидролазы - гидролитический разрыв связи СС, СN, СS с присоединением воды по месту разрыва.
Лиазы – реакции негидролитического расщепления с образованием двойных связей, некоторые обратные реакции синтеза.
Изомеразы – перенос групп внутри молекулы с образованием изомеров.
Лигазы катализируют соединение двух молекул, сопряжённое с разрывом пирофосфатной связи АТФ.
Гидролазы
– простые белки.
Подкласс определяется типом расщепляемой связи
3.1. – сложноэфирные,
3.2. – гликозильные,
3.4. – пептидные.
Подподкласс уточняет тип связи:
3.1.1. – эфиры карбоновых кислот.
В класс гидролаз входят - пептидогидролазы, эстеразы, гликозидазы.
Пептидогидролазы - аминопептидазы, карбоксипептидазы, дипептидазы, протеиназы (пепсин, трипсин, папаин).
Эстеразы расщепляют эфиры. Карбоксиэстеразы (липаза), фосфоэстеразы (КФ, ЩФ), сульфоэстеразы.
Гликозидазы катализируют гидролиз гликозидов.
Обмен фенилаланина и тирозина
на 50% кетогенные, фен – незаменимая АМК, тир – условно заменимая АМК.









Блок 1. ФенилПВК: токсичен в первые 2-4 года жизни, ингибирует ПК, ГК, обмен триптофана, нарушает обмен серотонина, приводит к развитию фенилпировиноградной олигофрении.
Фенилпировиноградная олигофрения - задержка умственного развития, меняется нейромедиаторная активность, сокращается образование нейромедиаторных производных тирозина (тирамин, катехоламины), нарушается баланс АМК, синтез белка, нейромедиаторов в нервной ткани.
Скорость обмена АМК наиболее высока в нервной ткани.
Наследственные аминоацидопатии – одна из основных причин слабоумия.
Нарушение обмена фенилаланина. При побочном пути метаболизма фенилаланина образуются фенилэтиламин и фенилацетат. Это нейротоксины, они способны нарушать метаболизм липидов в мозге.
Избыток фен и его минорные метаболиты – тератогенны. Приводят к множественным порокам у плода.
Нарушения катаболизма тирозина.
Блок 2. При дефекте йодтирозиназы развивается кретинизм. При этом аутосомно-рецессивном заболевании моно- и дийодтирозин не дейодируются, развивается нехватка тиреоидных гормонов.
Блок 3. При дефекте тирозиназы, развивается альбинизм. При первичной болезни Паркинсона заторможено образование дофамина из ДОФА в ткани мозга. При отсутствии витамина С оксидазы не работают.
Блок 4. на уровне тирозинтрансаминазы, развивается тирозинемия II типа.
Симптомы: умственная отсталость, поражения глаз, кожи.
Блок 5. на уровне гидроксифенилПВКгидроксилазы, развивается тирозинемия новорожденных.
Блок 6. на оксидазе гомогентизиновой кислоты, развивается алкаптонурия.
Симптомы: охроноз, артриты, чёрная моча.
Лабораторная диагностика алкаптонурии: при подщелачивании мочи NаОН гомогентизиновая кислота окисляется с образованием соединения сине-фиолетового цвета. Гомогентизиновая кислота ингибирует лизингидроксилазу.
Блок 7. на фумарилацетоацетатгидролазе, развивается тирозинемия I типа.
Симптомы: в плазме повышено содержание тирозина и метионина, понос, рвота, задержка в развитии, смерть в 6-8 лет.
Аэробное окисление глюкозы до CO2 и воды
Глюкоза → 2 пирувата.
Выход АТФ: -1 -1+2(3 + 1+ 1)+15*2=38 АТФ
анаэробный гликолиз.
Выход АТФ: -1 -1+2( 1 + 1)=2 АТФ т. е. надо разрушить до лактата 19 молекул глюкозы.
Билет 35.
Классификация витаминов. Авитаминозы, гиповитаминозы, гипервитаминозы, причины развития витаминной недостаточности в организме человека. Витамин В1, признаки витаминной недостаточности. Нарушение углеводного обмена при В1-витаминной недостаточности.
Биохимия мышечной ткани. Важнейшие белки мышц. Креатин, креатинфосфат, креатинин, их синтез и биологическая роль.
У двух пациентов тест толерантности к глюкозе дал следующие результаты (глюкоза ммоль/л):
натощак через 60 мин. Через 120 мин.
