
- •Отдельное спасибо ребятам со второго потока лечебного факультета 2012 г.
- •1)Мультиферментные комплексы и изоферменты. Кдз определения активности изоферментов. Энзимодиагностика. Ферментативные лекарственные препараты.
- •2) Окисление жирных кислот. Внутриклеточная локализация и биоэнергетика процесса. Особенности обмена жк с нечетным количеством углеродных атомов и ненасыщенных жк.
- •3) О каком заболевании следует думать, если моча новорожденного ребенка дает положительную реакцию на наличие фенилпирувата? Какой молекулярный блок лежит в основе данной патологии?
- •1)Классификация ферментов. Общая характеристика класса лиаз. Коферменты лиазных рекций.
- •2) Регуляция липидного обмена. Гормоны влияющие на обмен липидов. Патология липидного обмена : гиперлипидемия, атеросклероз, липоидозы, жировое перерождение печени, ожирение.
- •1)Классификация гормонов по локализации рецеторов. Вторичные посредники действия гормонов.
- •2) Гемоглобин, его структура, синтез, виды. Гемоглобинозы.
- •1)Белки плазмы крови, место их синтеза, биологическая роль. Изменение белкового спектра сыворотки при различных заболеваниях. Белки острой фазы.
- •2) Глюкоза крови. Пути ее поступления и использования. Гексокиназная реакция – клучевая реакция углеводного обмена. Пусти превращения глюкозо-6-фосфата.
- •1)Дыхательная цепь. Ферментные комплексы дыхательной цепи, их локализация. Редокс-потенциалы ферментных систем. Ингибиторы переноса электронов.
- •2) Адреналин и норадреналин, их синтез и влияние на обмен веществ.
- •1)Особенности обмена в эритроцитах. Эритроцитарные энзимопатии. Синтез гема. Порфирин.
- •3) Оцените состояние больного по следующим данным анализа крови и мочи: глюкоза крови – 10,0 ммоль/л, рН крови – 7,30, в моче обнаружены глюкоза, кетоновые тела.
- •1)Эндокринная система оргранизма. Классификация гормонов по химической структуре, их роль в регуляции обменных процессов. Причины эндокринных заболеваний. Механизм действия гормонов.
- •Причины заболеваний эндокринной системы.
- •1)Биологические мембраны, их структурные компоненты. Функции биологических мембран.
- •2) Патология углеводного обмена. Сахарный диабет. Нарушение углеводного и липидного обмена при этом заболевании.
- •1. Гипергликемия вызвана:
- •3) В крови больного повышена активность липазы, амилазы, трипсина. О какой патологии следует думать? Какие реакции катализируются данными ферментами?
- •1) Классификация ферментов. Общая характеристика класса трансфераз. Основные подклассы. Коферменты трансферазных реакций.
- •2)Напишите последовательность реакций превращения ацетил-КоА в мевалоновую кислоту в процессе синтеза холестерина. Укажите ферменты и коферменты.
- •3) Биохимический анализ нормальной и патологической мочи. Глюкозурия, протеинурия, кетонурия, билирубинурия.
- •2) Витамины, их классификация. Витамин в12 и фолиевая кислота, участие в обмене веществ и признаки витаминной недостаточности.
- •3) Какие изменения белкового спектра будут наблюдаться при остром воспалении? Что такое белки «острой фазы»? Диагностическое значение определения их концентрации в крови.
- •1)Роль воды в организме. Водный баланс, его регуляция и патология. Макроэлементы: натрий, калий, хлор, магний.
- •2) Биосинтез днк (репликация). Биосинтез рнк (транскрипция). Посттранскрипционный процессинг рнк. Основные положения аминокислотного кода. Обратная транскрипция.
- •2)Витамин в6, биотин, их химическая структура и признаки витаминной недостаточности. Участие в обмене веществ.
- •3)Будет ли протекать глюконеогенез, если в клетке цитратный цикл и дыхательная цепь полностью ингибированы. Ответ поясните.
- •1)Классификация и характеристика сложных белков (липопротеины, хромопротеины, гликопротеины, нуклеопротеины, фосфопротеины).
- •2) Вторичный липолиз триглицеридов. Окисление глицерина до конеч¬ных продуктов (со2 и н2о). Биоэнергетика процесса.
- •1)Структура гликогена, синтез и распад гликогена в печени и мышцах. Гликогенозы.
- •2) Изогидрия. Механизмы поддержания изогидрии. Ацидоз и алкалоз.
- •3) Сипмтомами авитаминоза в1 является расстройство нервной систе¬мы, потеря памяти, изменение психики. Почему к дефициту витамина в1 особо чув¬ствительна центральная нервная система?
- •1)Паратгормон и тиреокальцитонин. Влияние гормонов на обмен кальция и фосфора в организме человека
- •2) Сопряжение обмена углеводов и липидов. Сопряжение обмена углеводов и аминокислот. Пути превращения и образования пировиноградной кислоты.
- •1)Обмен и биологическое значение серосодержащих аминокислот (метионин и цистеин). Участие метионина в реакциях трансметилирования. Молекулярная патология обмена этих аминокислот.
- •2) Микроэлементы: селен, цинк, марганец, стронций, фтор, йод, молибден. Микроэлементозы.
- •3) Оценить состояние больного, если: рН крови - 7,31, рН мочи - 4,8. Общее содержание со2 в крови повышено. РСо2 - 80 мм рт ст. Титрометрическая кислотность мочи повышена.
- •1)Основные пути обмена аминокислот: декарбоксилирование, дезаминирование. Биологическая роль биогенных аминов.
- •2) Витамины р и с, их структура, признаки витаминной недостаточности, влияние на обмен веществ.
- •3) У больного после переливания крови развилась желтуха. Какой вид желтухи можно заподозрить? Как изменились показатели пигментного обмена в крови и моче?
- •1)Классификация ферментов. Общая характеристика класса оксидоредуктаз. Коферменты оксидоредуктазных реакций.
- •Характеристика фермента
- •2) Гормональная регуляция углеводного обмена. Гормоны, повышающие и понижающие уровень глюкозы в крови. Механизм их действия.
- •3) В крови снижено содержание мочевины. Нарушение какого метаболического пути можно предположить, каковы возможные причины этих нарушений?
- •1)Понятие об обмене веществ. Процессы анаболизма и катаболизма, их характеристика и взаимосвязь. Виды метаболических путей. Центральные метаболиты.
- •I . Подготовительная фаза.
- •II фаза. Превращение мономеров в простые соединения - центральные метаболиты (пвк, ацетилКоА)
- •III фаза. Цикл Кребса
- •2) Витамины рр и в2, структура, признаки витаминной недостаточности и участие в обмене веществ.
- •1)Обмен и биологическое значение глутаминовой и аспарагиновой аминокислот в организме человека.
- •2)Микроэлементы: железо, медь и кобальт. Их роль в организме. Понятие о микроэлементозах.
- •3) Пациенту в лечебных целях назначили диету с низким содержанием углеводов. Концентрация глюкозы в крови нормальная. За счет каких процессов преимущественно поддерживается уровень глюкозы в крови?
- •1) Основные пути промежуточного обмена аминокислот. Трансаминирование. Клиническое значение определения активности трансаминаз.
- •2) Антиоксидантная система организма. Неферментативные антиоксиданты. Антиоксидантные ферменты.
- •1)Гормоны передней доли гипофиза, их химическая структура и влияние на обмен веществ. Последствия изменений продукции соматотропного гормона в организме.
- •2)Глюконеогенез. Основные субстраты, ключевые ферменты процесса. Цикл Кори
- •3)Больной 50 лет поступил в клинику с жалобами на резкие боли в области сердца, слабость. Активность каких ферментов следует определить в крови больного для исключения инфаркта миокарда?
- •1)Холестерин, его биологическая роль, биосинтез. Гиперхолестеринемии. Атеросклероз.
- •2) Кровь, ее роль в организме. Химический состав плазмы. Калликреин-кининовая система.
- •3)Для лечения подагры применяется аллопуринол, структурный аналог гипоксантина. Объясните биохимический механизм действия данного лекарственного средства.
- •1)Кинетика ферментативных реакций. Зависимость скорости ферментативных реакции от концентрации субстрата и фермента, рН и температуры среды. Принципы количественного определения активности ферментов.
- •1. Зависимость скорости реакции от температуры
- •2. Зависимость скорости реакции от рН
- •3. Зависимость скорости реакции от концентрации субстрата
- •4. Зависимость от концентрации фермента
- •2) Синтез жирных кислот. Внутриклеточная локализация. Биосинтез триацилглицеролов.
- •1)Нуклеопротеины и нуклеиновые кислоты. Структурная организация молекул днк и рнк. Распад нуклеопротеинов в пищеварительном тракте. Нуклеотидный пул клеток, пути его пополнения и расходования.
- •2)Витамины а, е, к, влияние на обмен веществ, признаки витаминной недостаточности.
- •3)Оценить состояние больного по следующим данным анализа крови: активность креатинфосфокиназы повышена, общая активность лдг повышена, преимущественно за счет лдг1. Коэффициент де Ритиса - 1,90.
- •1)Биологическая роль печени. Роль печени в обмене углеводов, липидов, аминокислот и белков. Антитоксическая роль печени.
- •2)Биосинтез пуриновых и пиримидиновых нуклеотидов. Оротовая ацидурия.
- •1)Распад гемоглобина. Образование билирубина и продуктов его обмена. Характеристика прямого и непрямого билирубина. Диагностическое значиние их определения. Классификация желтух.
- •2)Глюкоза крови. Гипергликемия, гипогликемия, глюкозурия. Диагностическое значение определния глюкозы в крови и моче.
- •1)Гликолиз. Биологическая роль, химизм процесса, биоэнергетика, регуляция. Эффект Пастера.
- •2)Витамин d. Химическая природа витамина, гормонально-активные формы. Участие витамина в обмене веществ. Рахит.
- •3)Какова судьба гемоглобина, попавшего в плазму крови в результате гемолиза эритроцитов?
- •2. Регуляция и патология белкового обмена
- •3. Ответ. Поражение тканей печени. За счет изофермента лдг 4 и 5
- •1. 4,5 8,0 4,3
- •2. 6,1 14,0 10,0
- •2.Биохимия мышечной ткани
- •3. Ответ: 1 пациент – норма, 2 пациент – сахарный диабет.
- •1. Переваривание белков. Диагностическое значение биохимического анализа желудочного и дуоденального сока.
- •Условно заменимые аминокислоты ( могут образоваться из других кислот в организме )
- •Незаменимые аминокислоты ( нужно употреблять каждый день с пищей )
2. Зависимость скорости реакции от рН
Зависимость также описывается колоколообразной кривойс максимумом скорости приоптимальном для данного ферментазначении рН.
Для каждого фермента существует определенный узкий интервал рН среды, который является оптимальным для проявления его высшей активности. Например, оптимальные значения рН для пепсина 1,5-2,5, трипсина 8,0-8,5, амилазы слюны 7,2, аргиназы 9,7, кислой фосфатазы 4,5-5,0, сукцинатдегидрогеназы 9,0.
|
|
3. Зависимость скорости реакции от концентрации субстрата
При увеличении концентрации субстрата скорость реакции сначала возрастает соответственно подключению к реакции новых молекул фермента, затем наблюдается эффект насыщения, когда все молекулы фермента взаимодействуют с молекулами субстрата. При дальнейшем увеличении концентрации субстрата между его молекулами возникает конкуренция за активный центр фермента и скорость реакции снижается.
4. Зависимость от концентрации фермента
При увеличении количества молекул фермента скорость реакции возрастает непрерывно и прямо пропорционально количеству фермента, т.к. большее количество молекул фермента производит большее число молекул продукта.
Основы количественного определения активности ферментов
1. Активность фермента выражается в скорости накопления продукта или скорости убыли субстрата в пересчете на количество материала, содержащего фермент.

В практике обычно используют:
единицы количества вещества – моль (и его производные ммоль, мкмоль), грамм (кг, мг),
единицы времени – минута, час, секунда,
единицы массы или объема – грамм (кг, мг), литр (мл).
Активно используются и другие производные – катал (моль/с), международная единица активности (МЕ, Unit) соответствует мкмоль/мин.
Таким образом, активность фермента может выражаться, например, в ммоль/с×л, г/час×л, МЕ/л, кат/мл и т.д.
Например, известно,
что 1 г пепсина расщепляет 50 кг яичного белка за один час – таким образом, его активность составит 50 кг/час на 1 г фермента,
если 1,6 мл слюны расщепляет 175 кг крахмала в час – активность амилазы слюны составит 109,4 кг крахмала в час на 1 мл слюны или 1,82 кг/мин×г или 30,3 г крахмала/ с×мл.
2. Создание стандартных условий, чтобы можно было сравнивать результаты, полученные в разных лабораториях – оптимальная рН и фиксированная температура, например, 25°С или 37°С, соблюдение времени инкубации субстрата с ферментом.
3. Необходимо наличие избытка субстрата, чтобы работали все имеющиеся в растворе молекулы фермента.
2) Синтез жирных кислот. Внутриклеточная локализация. Биосинтез триацилглицеролов.
Биосинтез жирных кислотидёт в цитоплазме, нужен ацетил-КоА из митохондрий, участвует малонил-КоА,происходит перенос ацетил-КоА в цитоплазму,участвует мультиферментный комплекс синтетаза жирных кислот, требуется биотин, нужен НАДФН2, требуется АПБ на всех этапах.Перенос ацетил-КоА из митохондрий в цитоплазму Ацетил-КоА не проникает через мембрану митохондрий в цитоплазму.
Ацетил-КоА + ЩУК = цитрат + НSКоА
Цитрат с помощью транслоказы переносится в цитоплазму.
В цитоплазме:
цитрат + НSКоА +АТФ = Ацетил-КоА +АДФ+Фн+ЩУК
цитратлиаза
НАДН+ НАД+ НАДФН+Н+ НАДФ+
ЩУК = малат = ПВК+ СО2
Малик-фермент
Реакции синтеза жирных кислот
СН3-CО-S-KoA + биотин-СО2 + АТФ =
Ацетил-КоА-Карбоксилаза(Инсулинзависимая)
НООС-СН2-CО-S-KoA + АДФ + Фн малонил-КоА
Ацетил-КоА-карбоксилаза аллостерический фермент, активатором является цитрат, повышение содержания цитрата в митохондриях приводит к тому, что при помощи челночного механизма он поступает в цитоплазму. Далее действует мультиферментный комплекс – синтетаза жирных кислот, который представляет собой 6 ферментов, связанных с АПБ.
СН3-CО-S-KoA + HS-АПБ = HS-КоА + СН3-CО-S-АПБ
АПБ-ацетилтрансфераза ацетил-АПБ
НООС-СН2-СО-S-КоА + НS-АПБ = HS-KoA + HOOC-CH2-CO-S-АПБ
АПБ-малонилтрансфераза малонил-АПБ
Далее происходит конденсация малонил-АПБ и ацетил-АПБ.
СН3-CО-S-АПБ + НООС-СН2-CО-S-АПБ =
ацетил-АПБ малонил-АПБ B-Кетоацетил-АПБсинтаза
СН3-CО-СН2-CО-S-АПБ + НАДФН+Н+ =
ацетоацетил-АПБ В-Кетоацил-АПБ-редуктаза
СН3-CH(ОH)-СН2-CО-S-АПБ + НАДФ+ =
β-оксибутирил-АПБ В-оксиацил-АПБ-дегидратаза
СН3-CH=СН-CО-S-АПБ + НАДФН+Н+ =
кротонил-АПБ еноилАПБ-редуктаза
СН3-CH2-СН2-CО-S-АПБ +НАДФ+
бутирил-АПБ
Далее цикл повторяется.Малонил-КоА переносится на SH-группу фосфопантетеина АПБ.
Бутирил-АПБ + малонил-АПБ = кетокапронилАПБ + СО2
Пальмитиновая кислота – предшественник для других жирных кислот.
Биосинтез ТАГ
В почках, стенке кишечника, печени высока активность глицеролкиназы.В мышцах, жировой ткани активность глицеролкиназы низкая и образование глицерол-3-фосфата связано с гликолизом и гликогенолизом. Жиры, синтезированные в жировой ткани, там и откладываются, а из печени жиры транспортируются в составе липопротеинов
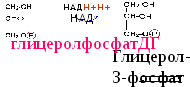




3. Больной жалуется на боли в правом подреберье. Слизистые и кожные покровы желтушны. Оцените состояние больного на основании данных анализа его крови: общий билирубин - 60 мкмоль/л, прямой билирубин - 45 мкмоль/л. Активность щелочной фосфатазы резко повышена.
Механическая желтуха
Билет 25
