
- •Термодинамика
- •Глава 1 Основные понятия и определения термодинамики…………… 11
- •Глава 8 Термохимия…………………………………………………….. 60
- •Глава 9 Термодинамические свойства индивидуальных веществ. Стандартное состояние вещества……………………………… 69
- •Глава 10 Отдельная химическая реакция………………………………… 83
- •Глава 11 Методы расчета термодинамических свойств химически реагирующих систем…………………………………………… 104
- •Глава 12 Термодинамические политропные процессы с идеальными газами……………………………………………………………. 156
- •Глава 13 Тепловые машины и компрессоры……………………………. 171
- •Глава 14 Термодинамика потоков жидкости и газа………………………197
- •Глава 15 Водяные пары……………………………………………………..223
- •Глава 16 Основы эксергетического метода термодинамического анализа………………………………………………………… 241
- •Глава 1. Основные понятия и определения термодинамики
- •Глава 2 уравнения состояния вещества
- •2.1. Термические и калорические уравнения состояния
- •2.2. Термические уравнения состояния для идеального газа
- •2.3. Термические уравнения состояния для реальных газов
- •Глава 3. Смеси веществ
- •3.1. Способы задания состава смеси. Закон Амага.
- •3.2. Соотношения для смесей идеальных газов. Закон Дальтона
- •Глава 4. Теплоемкость
- •4.1. Виды теплоемкости
- •4.2. Уравнение Майера
- •4.3. Теплоемкость химически реагирующей термодинамической системы
- •Глава 5. Первый закон термодинамики
- •5.1. Уравнение первого закона термодинамики для сложной открытой системы в общем виде.
- •5.2. Уравнение 1-го закона термодинамики для проточной термодинамической системы
- •Глава 6. Второй закон термодинамики
- •6.1. Сущность второго закона термодинамики. Равновесные и неравновесные состояния, обратимые и необратимые процессы
- •6.2. Математическое выражение 2-го закона термодинамики. Три составляющие изменения энтропии термодинамической системы
- •6.3. Энтропия изолированной термодинамической системы
- •Глава 7. Объединенные выражения первого и второго законов термодинамики
- •7.1. Различные формы записи объединенных выражений
- •7.2. Характеристические функции и дифференциальные соотношения взаимности термодинамики
- •7.3. Максимальная и минимальная работы процесса. Термодинамические потенциалы
- •7.4. Условия равновесия термодинамической системы. Термодинамическое сродство
- •7.5. Связь между изобарной и изохорной теплоемкостями в общем виде
- •7.6.Расчетные выражения для скорости звука в общем виде
- •7.7. Максимальная и минимальная теплоты процесса
- •Глава 8. Термохимия
- •8.1. Формы записи уравнений химических реакций в общем виде
- •8.2. Понятие пробега химической реакции
- •8.3. Изохорный и изобарный тепловые эффекты химических реакций и связь между ними
- •8.4. Зависимости тепловых эффектов хр от температуры. Формула Кирхгофа.
Глава 3. Смеси веществ
3.1. Способы задания состава смеси. Закон Амага.
Для проведения термодинамических расчетов систем с газовыми смесями или растворами необходимо знать их состав. Состав смеси может быть задан:
- массовыми долями
![]() ,
где
,
где![]()
![]() - молярная массаi-го
компонента, кг/моль;Mi– относительная молекулярная массаi-го компонента;ni– количествоi-го
вещества, моль;
- молярная массаi-го
компонента, кг/моль;Mi– относительная молекулярная массаi-го компонента;ni– количествоi-го
вещества, моль;
для каждой фазы
![]() ;
;
- молярными долями
![]() ,
где
,
где![]() - количество вещества смеси, моль; для
каждой фазы сумма молярных долей
компонентов смеси
- количество вещества смеси, моль; для
каждой фазы сумма молярных долей
компонентов смеси![]() ;
;
- объемными долями, которые равны молярным
долям
![]() ,
где
,
где![]() - объемi-го компонента
смеси, который при температуре и давлении
смеси газов называется приведенным
объемом;
- объемi-го компонента
смеси, который при температуре и давлении
смеси газов называется приведенным
объемом;![]() ,
м3/моль – молярный объемi-го
компонента смеси. В соответствии с
законом Авагадро молярные объемы всех
компонентов смеси газов равны и
,
м3/моль – молярный объемi-го
компонента смеси. В соответствии с
законом Авагадро молярные объемы всех
компонентов смеси газов равны и![]() ,
где
,
где![]() .
Сумма приведенных объемов компонентов
смеси газов равна объему смеси (закон
Амага), т.е.
.
Сумма приведенных объемов компонентов
смеси газов равна объему смеси (закон
Амага), т.е.![]() .
.
Состав смеси идеальных газов может быть
также задан парциальными давлениями
рi, массовыми
концентрациями![]() и молярными концентрациями
и молярными концентрациями![]() .
.
При задании состава растворов пользуются массовыми и молярными концентрациями.
Парциальное давление рi – это давлениеi-го компонента газовой смеси при условии, что он занимает весь объем, предназначенный для смеси, при температуре смеси.
3.2. Соотношения для смесей идеальных газов. Закон Дальтона
Средняя молярная масса смеси газов
определяется выражением
![]() ,
кг/моль, где
,
кг/моль, где![]() - масса смеси;
- масса смеси;![]() - количество вещества смеси. Тогда
- количество вещества смеси. Тогда
![]() .
.
Удельная газовая постоянная смеси газов
![]() ,
Дж/(кгК),
,
Дж/(кгК),
где
![]() Дж/(мольК) – молярная газовая постоянная;
Дж/(мольК) – молярная газовая постоянная;![]() - молярная масса смеси.
- молярная масса смеси.
Закон Дальтона:
![]() ,
Па,
,
Па,
т.е. сумма парциальных давлений отдельных газов, входящих в смесь, равна полному давлению смеси. Таким образом, каждый газ в сосуде занимает весь объем при температуре смеси, находясь под собственным парциальным давлением.
Уравнение состояния для смеси идеальных газов имеет вид:
![]() .
.
Для парциального давления и для приведенного объема i-го компонента смеси уравнения состояния имеют вид:
![]()
Тогда, разделив эти уравнения почленно первое на второе, имеем
![]() .
.
Разделив уравнение
![]() на уравнение
на уравнение![]() почленно, получим:
почленно, получим:
![]() .
.
Глава 4. Теплоемкость
4.1. Виды теплоемкости
Теплоемкость – это свойство тел поглощать и выделять теплоту при изменении температуры на один градус в различных термодинамических процессах. Различают общую среднюю и общую истинную теплоемкости.
Общая средняя теплоемкость термодинамического процесса (ТП) – это теплоемкость тела массой m, кг за конечный отрезок ТП:
![]() ,[Дж/К].
,[Дж/К].
Общая истинная теплоемкость ТП – это теплоемкость тела массой m, кг в каждый данный момент ТП:
![]() ,
[Дж/К].
,
[Дж/К].
Рассмотрим произвольный ТП 1-2 в координатах
![]() ,
гдеQ– подведенная
теплота в [Дж];t –
температура в [0C].
Тогда
,
гдеQ– подведенная
теплота в [Дж];t –
температура в [0C].
Тогда![]() ,
,![]() .
.
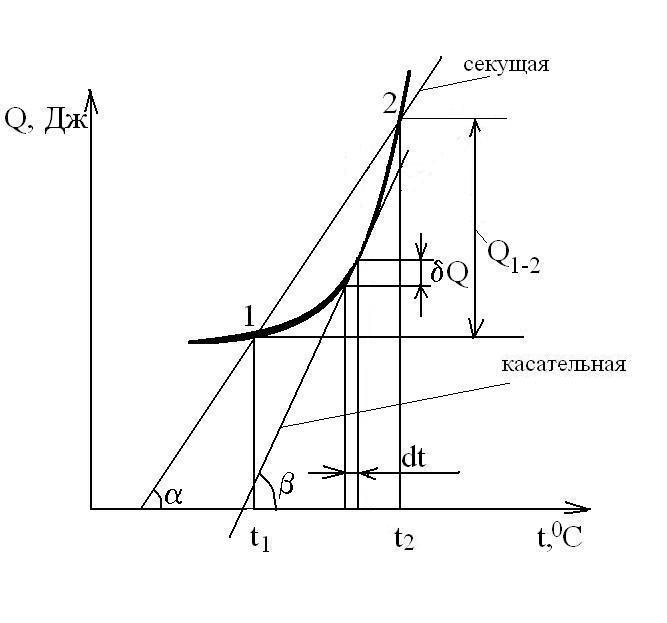
Если ТС – однородное рабочее тело, то в расчетах применяются относительные теплоемкости:
- удельная теплоемкость – теплоемкость, отнесенная к 1 кг вещества с=С/m, Дж/кгК;
- молярная теплоемкость – теплоемкость,
отнесенная с 1 молю вещества
![]() ,
Дж/мольК;
,
Дж/мольК;
- объемная теплоемкость – теплоемкость,
отнесенная к 1м3вещества![]() ,
Дж/м3К.
,
Дж/м3К.
Теплоемкость – функция процесса и зависит от рода рабочего тела, характера процесса и параметров состояния. Так, теплоемкость в процессе с постоянным давлением называется изобарной теплоемкостью:
![]() ,
,
где H, Дж – энтальпия.
Теплоемкость в процессе с постоянным объемом называется изохорной теплоемкостью:
![]() ,
,
где U, Дж – внутренняя энергия.
Теплоемкость идеального газа не зависит
от температуры и давления и зависит
только от числа степеней свободы движения
молекул и в соответствии с законом о
равном распределении энергии по степеням
свободы движения молекул теплоемкость:
![]() ,
где
,
где![]() - вращательные степени свободы, равные
для одноатомного газа нулю
- вращательные степени свободы, равные
для одноатомного газа нулю![]() ,
для двухатомного газа -
,
для двухатомного газа -![]() =2
и для трехатомных газов
=2
и для трехатомных газов![]() =3;
=3;![]() Дж/мольК – молярная газовая постоянная.
Теплоемкость
Дж/мольК – молярная газовая постоянная.
Теплоемкость![]() определяется по уравнению Майера:
определяется по уравнению Майера:
![]() .
.
Для одноатомного газа
![]() и
и![]() ,
для двухатомного газа
,
для двухатомного газа![]() и
и![]() ,
для трех и более атомных газов
,
для трех и более атомных газов![]() и
и![]() .
.
Теплоемкость реальных газов зависит от давления и температуры. В ряде случаев можно пренебречь влиянием давления на теплоемкость и принять, что теплоемкость реальных газов зависит только от температуры: C=f(t). Эта зависимость определяется экспериментально.
Эмпирическая зависимость удельной истинной теплоемкости от температуры может быть представлена в виде многочлена:
![]() ,
Дж/кгК,
,
Дж/кгК,
где
![]() при температуреt=00C.
Для двухатомных газов можно ограничиться
двумя слагаемыми:
при температуреt=00C.
Для двухатомных газов можно ограничиться
двумя слагаемыми:![]() ,
или
,
или![]() ,
где
,
где![]() .
.
Для конечного участка процесса 1-2 количество теплоты равно:
![]() .
.
Тогда средняя теплоемкость на этом участке процесса будет равна:
![]() ,
Дж/кгК.
,
Дж/кгК.
В области низких температур при Т<100К прекращается вращательное движение молекул и колебательное движение атомов, а при температуреТ→0К прекращается и поступательное движение молекул, т.е. приТ=0КСр=Cv=0 и прекращается тепловое движение молекул (опытные данные Нернста и др., 1906-1912гг.). При температуреТ→0К свойства веществ перестают зависеть от температуры, как это иллюстрируется на приведенном графике зависимости теплоемкости от абсолютной температуры.

