
- •Термодинамика
- •Глава 1 Основные понятия и определения термодинамики…………… 11
- •Глава 8 Термохимия…………………………………………………….. 60
- •Глава 9 Термодинамические свойства индивидуальных веществ. Стандартное состояние вещества……………………………… 69
- •Глава 10 Отдельная химическая реакция………………………………… 83
- •Глава 11 Методы расчета термодинамических свойств химически реагирующих систем…………………………………………… 104
- •Глава 12 Термодинамические политропные процессы с идеальными газами……………………………………………………………. 156
- •Глава 13 Тепловые машины и компрессоры……………………………. 171
- •Глава 14 Термодинамика потоков жидкости и газа………………………197
- •Глава 15 Водяные пары……………………………………………………..223
- •Глава 16 Основы эксергетического метода термодинамического анализа………………………………………………………… 241
- •Глава 1. Основные понятия и определения термодинамики
- •Глава 2 уравнения состояния вещества
- •2.1. Термические и калорические уравнения состояния
- •2.2. Термические уравнения состояния для идеального газа
- •2.3. Термические уравнения состояния для реальных газов
- •Глава 3. Смеси веществ
- •3.1. Способы задания состава смеси. Закон Амага.
- •3.2. Соотношения для смесей идеальных газов. Закон Дальтона
- •Глава 4. Теплоемкость
- •4.1. Виды теплоемкости
- •4.2. Уравнение Майера
- •4.3. Теплоемкость химически реагирующей термодинамической системы
- •Глава 5. Первый закон термодинамики
- •5.1. Уравнение первого закона термодинамики для сложной открытой системы в общем виде.
- •5.2. Уравнение 1-го закона термодинамики для проточной термодинамической системы
- •Глава 6. Второй закон термодинамики
- •6.1. Сущность второго закона термодинамики. Равновесные и неравновесные состояния, обратимые и необратимые процессы
- •6.2. Математическое выражение 2-го закона термодинамики. Три составляющие изменения энтропии термодинамической системы
- •6.3. Энтропия изолированной термодинамической системы
- •Глава 7. Объединенные выражения первого и второго законов термодинамики
- •7.1. Различные формы записи объединенных выражений
- •7.2. Характеристические функции и дифференциальные соотношения взаимности термодинамики
- •7.3. Максимальная и минимальная работы процесса. Термодинамические потенциалы
- •7.4. Условия равновесия термодинамической системы. Термодинамическое сродство
- •7.5. Связь между изобарной и изохорной теплоемкостями в общем виде
- •7.6.Расчетные выражения для скорости звука в общем виде
- •7.7. Максимальная и минимальная теплоты процесса
- •Глава 8. Термохимия
- •8.1. Формы записи уравнений химических реакций в общем виде
- •8.2. Понятие пробега химической реакции
- •8.3. Изохорный и изобарный тепловые эффекты химических реакций и связь между ними
- •8.4. Зависимости тепловых эффектов хр от температуры. Формула Кирхгофа.
Глава 2 уравнения состояния вещества
2.1. Термические и калорические уравнения состояния
Общее число термических и калорических уравнений состояния ТС определяется числом ее степеней свободы, т.е. числом воздействующих на ТС обобщенных сил. Эти уравнения устанавливаются опытным путем или находится методами статистической физики.
Для простой ТС (число степеней свободы N=2), на которую действует одна обобщенная сила механического характера – давлениер, сопряженная внешнему параметруV, взаимодействие с окружающей средой характеризуется только одним внешним параметром, изменяющимся при данном взаимодействии, (обобщенной координатой) – объемомVи температуройТ(независимый параметр). Тогда равновесные внутренние параметры состояния: давление и внутреннюю энергиюUможно выразить в виде функциональных зависимостей:p=p(V,T) – термического уравнения состояния иU=U(V,T) – калорического уравнения состояния.
Термическое уравнение состояния для простой ТС можно представить в виде связи: F(p,V,T)=0. Это уравнение является уравнением термодинамической поверхности или поверхности состояний. Для идеального газа термическим уравнением состояния является уравнение Клапейрона:pV=mRT, гдеR– удельная газовая постоянная.
Калорическое уравнение состоянияидеального газаможно получить из закона Джоуля: «Внутренняя энергия термодинамической системыUприТ=constне зависит от объемаV:
![]() .
.
Продифференцировав уравнение U=U(V,T), получим:
![]() ,
,
где
![]() - теплоемкость идеального газа в процессеV=const(по определению).
- теплоемкость идеального газа в процессеV=const(по определению).
Тогда
![]() ,
,
т.е. внутренняя энергия идеального газа является функцией только температуры:
![]() .
.
Калорическое и термическое уравнения состояния идеального газа можно также получить из молекулярно-кинетических представлений.
2.2. Термические уравнения состояния для идеального газа
Формальноидеальный газможно
определитькак газ, подчиняющийся
уравнению Клапейрона:![]() .
.
С физической точки зрения идеальный газ – это газ, молекулы которого лишены пространственной протяженности (объем молекул газа в сосуде – Vмол<<Vсосуда), а силы межмолекулярного взаимодействия практически отсутствуют, т.е. потенциальная энергия взаимодействия пренебрежимо мала по сравнению с энергией теплового движения молекул:
![]() ,
,
где к=1,380658(12)10-23[Дж/К] – постоянная Больцмана;![]() – закон равнораспределения энергии по
степеням свободы молекул.
– закон равнораспределения энергии по
степеням свободы молекул.
Для 1 кг: pv=RT, гдеR, Дж/кгК – удельная газовая постоянная, зависящая от рода газа;р, Па;v, м3/кг; Т, К.
Для mкг:pV=mRT, гдеV=mv, м3;
Для 1 моля:
 ,
где
,
где
 =8,31441,
Дж/мольК – молярная газовая постоянная,
одинаковая для всех газов,
=8,31441,
Дж/мольК – молярная газовая постоянная,
одинаковая для всех газов,
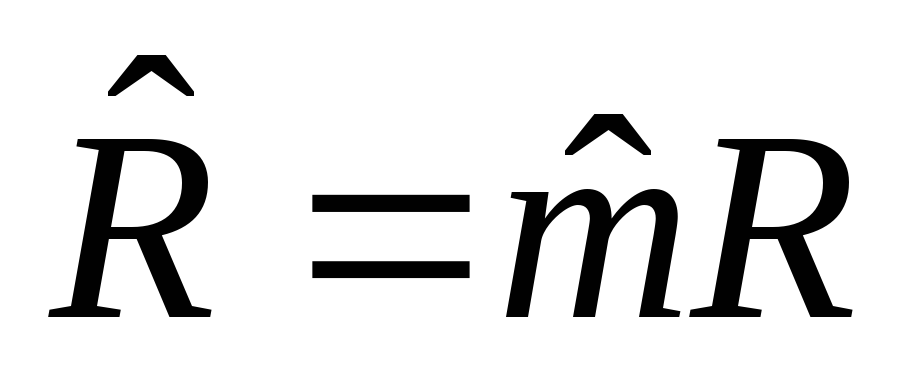 ;
;
 =М‧10-3,
кг/моль – молярная масса,
=М‧10-3,
кг/моль – молярная масса,
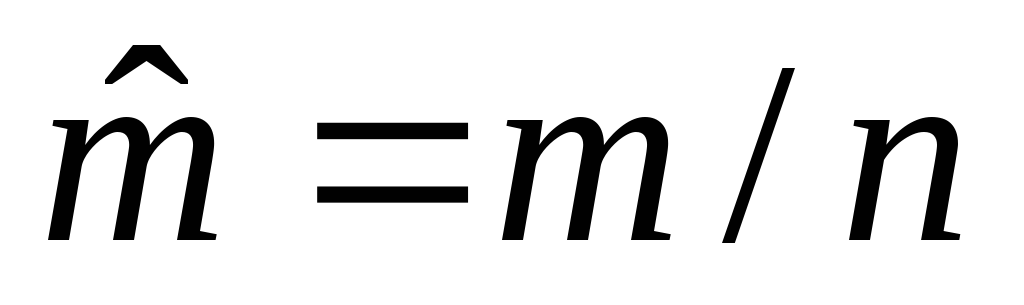 ;
;
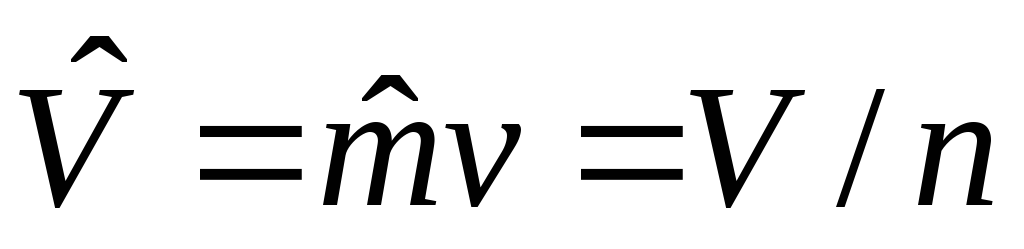 ,
м3/моль – молярный объем;n,
моль – количество вещества.
,
м3/моль – молярный объем;n,
моль – количество вещества.
4. Для nмолей:![]() .
.
5. Для 1м3:![]() ,
где
,
где![]() ,
кг/м3. В таком виде уравнение
состояния используется в аэродинамике.
,
кг/м3. В таком виде уравнение
состояния используется в аэродинамике.
6. Для 1м3:![]() ,
где
,
где![]() ,
моль/м3– молярная концентрация.
В таком виде уравнение состояния
используется в химии.
,
моль/м3– молярная концентрация.
В таком виде уравнение состояния
используется в химии.
2.3. Термические уравнения состояния для реальных газов
Конкретный вид термического уравнения зависит от агрегатного состояния и рода вещества. В настоящее время хорошо разработаны уравнения состояния только для реальных газов. Для конденсированных веществ уравнения состояния встречаются крайне редко, поскольку для практических расчетов они и не требуются.
Вид уравнения состояния для реальных газов сильно зависит от размера частиц, их структуры и характера взаимодействия между ними. Потенциальная энергия взаимодействия Uдвух молекул зависит от расстояния между их центрами –r, т.е.U=f(r). Молекулы реальных газов имеют конечные размеры и притягиваются друг к другу с силами, которые возрастают с уменьшением среднего расстояния между молекулами, в отличие от идеального газа, у которогоU(r)=0.
Для расчетов потенциальной энергии Uв большинстве случаев используется потенциал Леннарда-Джонса:
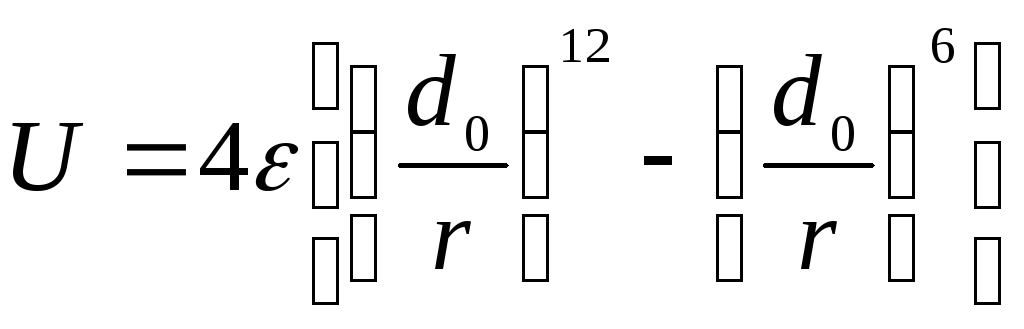 .
.
Обозначения величин
![]() иd0приведены
на рисунке, изображающем данную
зависимостьU=f(r).
иd0приведены
на рисунке, изображающем данную
зависимостьU=f(r).
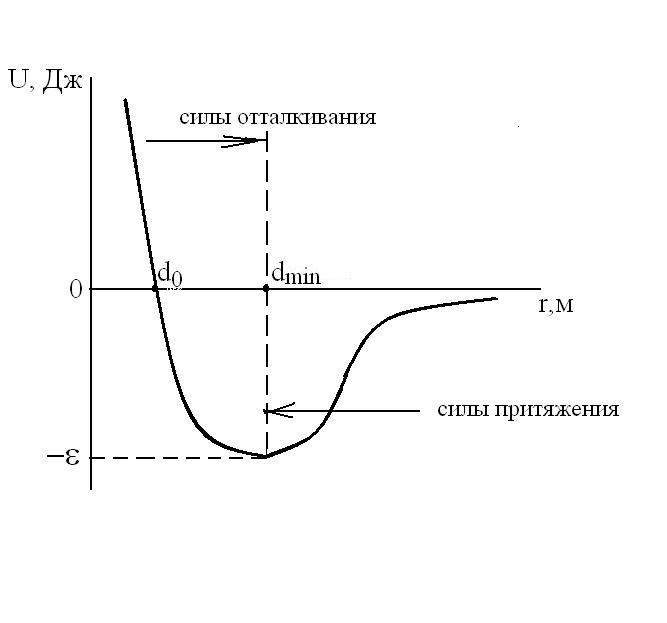
Силы взаимодействия между молекулами
![]() ,
[Н], очень велики при малых расстояниях
между молекулами (силы отталкивания) и
не позволяют уменьшить объем газа ниже
определенного предела (ниже расстоянияr=dmin).
Этот потенциал относится к группе
вандерваальсовских (дальнедействующих)
сил. Для больших расстоянийrпотенциалU~1/r6,
а сила взаимодействияF~1/r7.
Для малых расстоянийr(при сильном сближении молекул)U~1/r12,
аF~1/r13.
,
[Н], очень велики при малых расстояниях
между молекулами (силы отталкивания) и
не позволяют уменьшить объем газа ниже
определенного предела (ниже расстоянияr=dmin).
Этот потенциал относится к группе
вандерваальсовских (дальнедействующих)
сил. Для больших расстоянийrпотенциалU~1/r6,
а сила взаимодействияF~1/r7.
Для малых расстоянийr(при сильном сближении молекул)U~1/r12,
аF~1/r13.
Для сравнения отметим, что для кулоновских взаимодействий потенциал U~1/r, а силаF~1/r2. Таким образом, вандерваальсовские силы убывают с ростом расстоянияrмежду частицами гораздо быстрее, чем кулоновские силы. Поэтому уравнение состояния для реальных газов обычно не пригодны для плазмы. Для плазмы уравнение состояния выводится отдельно (Дебай).
Зависимости сил взаимодействия от расстояния между частицами (F=f(r)) используются для вычисления коэффициентов, входящих в различные уравнения состояния реальных газов и плазмы.
Наиболее простым уравнением состояния для реальных газов является уравнение Ван-дер-Ваальса (1873г.) (в настоящее время имеется более 150 эмпирических уравнений). Это уравнение имеет вид:
![]() ,
,
где b– поправка на объем молекул,a/v2– поправка на внутреннее или молекулярное давление, определяемое взаимным притяжением молекул газа. Константыaиbзависят от рода газа (от природы вещества).
Для жидкостей это уравнение сильно
расходится с данными опыта. Это уравнение
указывает на возможность существования
двух фаз и приводит к выводу о существовании
критической точки. Если отнести параметры
p, T,
vк критическим
параметрамpк,
Тк,vкв критической точке фазовой диаграммы
и обозначить![]() ,
,![]() ,
,![]() ,
то получим приведенное уравнение
Ван-дер-Ваальса:
,
то получим приведенное уравнение
Ван-дер-Ваальса:
![]() ,
,
которое выражает закон соответственных состояний.
Соответственными состояниями называются
состояния различных веществ, имеющих
одинаковые приведенные параметры
![]() ,
,![]()
![]() .
Вещества одинаковой химической природы,
удовлетворяющие этому уравнению являются
термодинамически подобными, если их
критические коэффициенты одинаковы:
.
Вещества одинаковой химической природы,
удовлетворяющие этому уравнению являются
термодинамически подобными, если их
критические коэффициенты одинаковы:
![]() .
.
Для вадерваальсовского газа Кк=2,67.
Отклонение свойств реальных газов от свойств идеального газа можно охарактеризовать величиной сжимаемости или коэффициента сжимаемости
![]() или
или![]() .
.
Для идеального газа Z=1. Для реального газаZ≠1. Величина коэффициента сжимаемости зависит от давления, температуры и рода газа и может быть как больше, так и меньше единицы в зависимости от этих факторов.
Уравнения состояния могут быть получены для реального газа, рассматривая взаимодействие частиц. Эти уравнения называются вириальными уравнениями состояния, которые в V– форме имеют вид:
![]() ,
,
где А(Т), В(Т), С(Т) – первый, второй и третий вириальные коэффициенты, зависящие от температуры. В р-форме вириальное уравнение имеет вид:
![]()
Коэффициенты А(Т), В(Т), С(Т) связаны с коэффициентами А´(Т), В´(Т), С´(Т).
Первый коэффициент А(Т) определяется парными столкновениями частиц, второй коэффициент В(Т) – тройными столкновениями частиц и т.д. Одновременное столкновение большого числа частиц – маловероятно. Наибольшую роль играют парные столкновения частиц. При их учете в правой части вириального уравнения сохраняются только два слагаемых. Примером такого уравнения является уравнение Ван-дер-Ваальса. Коэффициент А(Т) определяется путем интегрирования потенциала парного столкновения. Чем выше давление, тем большее число слагаемых в правой части вириального уравнения следует учитывать.
Термические уравнения состояния для
различных веществ устанавливаются
также по опытным данным для сжимаемости
Z=p![]() ,
для теплоемкостиС=f(p,T)
и для температурного эффекта
дросселирования. Надо иметь в виду, что
использование уравнения состояния для
идеальных газов дает приближенные
результаты, справедливые для реальных
газов, обладающих малой плотностью,
т.е. при небольших давлениях и больших
температурах.
,
для теплоемкостиС=f(p,T)
и для температурного эффекта
дросселирования. Надо иметь в виду, что
использование уравнения состояния для
идеальных газов дает приближенные
результаты, справедливые для реальных
газов, обладающих малой плотностью,
т.е. при небольших давлениях и больших
температурах.
