
- •Термодинамика
- •Глава 1 Основные понятия и определения термодинамики…………… 11
- •Глава 8 Термохимия…………………………………………………….. 60
- •Глава 9 Термодинамические свойства индивидуальных веществ. Стандартное состояние вещества……………………………… 69
- •Глава 10 Отдельная химическая реакция………………………………… 83
- •Глава 11 Методы расчета термодинамических свойств химически реагирующих систем…………………………………………… 104
- •Глава 12 Термодинамические политропные процессы с идеальными газами……………………………………………………………. 156
- •Глава 13 Тепловые машины и компрессоры……………………………. 171
- •Глава 14 Термодинамика потоков жидкости и газа………………………197
- •Глава 15 Водяные пары……………………………………………………..223
- •Глава 16 Основы эксергетического метода термодинамического анализа………………………………………………………… 241
- •Глава 1. Основные понятия и определения термодинамики
- •Глава 2 уравнения состояния вещества
- •2.1. Термические и калорические уравнения состояния
- •2.2. Термические уравнения состояния для идеального газа
- •2.3. Термические уравнения состояния для реальных газов
- •Глава 3. Смеси веществ
- •3.1. Способы задания состава смеси. Закон Амага.
- •3.2. Соотношения для смесей идеальных газов. Закон Дальтона
- •Глава 4. Теплоемкость
- •4.1. Виды теплоемкости
- •4.2. Уравнение Майера
- •4.3. Теплоемкость химически реагирующей термодинамической системы
- •Глава 5. Первый закон термодинамики
- •5.1. Уравнение первого закона термодинамики для сложной открытой системы в общем виде.
- •5.2. Уравнение 1-го закона термодинамики для проточной термодинамической системы
- •Глава 6. Второй закон термодинамики
- •6.1. Сущность второго закона термодинамики. Равновесные и неравновесные состояния, обратимые и необратимые процессы
- •6.2. Математическое выражение 2-го закона термодинамики. Три составляющие изменения энтропии термодинамической системы
- •6.3. Энтропия изолированной термодинамической системы
- •Глава 7. Объединенные выражения первого и второго законов термодинамики
- •7.1. Различные формы записи объединенных выражений
- •7.2. Характеристические функции и дифференциальные соотношения взаимности термодинамики
- •7.3. Максимальная и минимальная работы процесса. Термодинамические потенциалы
- •7.4. Условия равновесия термодинамической системы. Термодинамическое сродство
- •7.5. Связь между изобарной и изохорной теплоемкостями в общем виде
- •7.6.Расчетные выражения для скорости звука в общем виде
- •7.7. Максимальная и минимальная теплоты процесса
- •Глава 8. Термохимия
- •8.1. Формы записи уравнений химических реакций в общем виде
- •8.2. Понятие пробега химической реакции
- •8.3. Изохорный и изобарный тепловые эффекты химических реакций и связь между ними
- •8.4. Зависимости тепловых эффектов хр от температуры. Формула Кирхгофа.
Глава 1. Основные понятия и определения термодинамики
Формы движения материи, виды энергии, работа и теплообмен
В природе существуют различные формы движения материи: механическая, тепловая, химическая, электрическая, магнитная и др. Так, механическая форма движения состоит в изменении пространственного расположения макроскопических тел, а тепловая форма движения представляет собой хаотическое механическое движение большой совокупности микрочастиц, составляющих макроскопические тела. При передаче движения от одних тел к другим уменьшение движения рассматриваемой формы в одном теле сопровождается эквивалентным увеличением движения той же или иной формы в другом теле в соответствии с принципами сохранения и превращения движения. В случае изменения формы движения наблюдается их количественная эквивалентность. Количественной мерой для всех форм движения материи, способных превращаться одна в другую, является энергия. В природе существует множество видов энергии: кинетическая, химическая, тепловая, гравитационная, электрическая и др. При передаче движения материи с превращением его форм энергия не может быть ни уничтожена, ни создана. Передача движения и энергии от одних тел к другим телам происходит в результате взаимодействия этих тел. Современная физика различает четыре основных вида взаимодействия между элементарными частицами:
- сильное (ядерные реакции) с радиусом взаимодействия 10-13см;
- электромагнитное;
- гравитационное;
- слабое (с радиусом взаимодействия ~210-16см).
На микроскопическом уровне проявляются лишь электромагнитные взаимодействия, которые имеют разнообразные проявления для различных макропроцессов. Так, если явления упругости связаны с взаимодействием между одноименно заряженными электронными оболочками соседних атомов твердого тела, то электромагнитное излучение нагретого тела связано с электромагнитным взаимодействием между ядрами и электронными оболочками. Что касается химических реакций, то они связаны с электромагнитным взаимодействием ядер и электронных оболочек различных химических элементов, участвующих в реакции.
Все виды термодинамического взаимодействия (все способы обмена энергией) можно свести к двум принципиально различным способам: совершению работы и теплообмену.
Работа – это передача энергии в результате макроскопического, упорядоченного, организованного, направленного движения тел. Количество передаваемой при этом энергии называют работой или работой процесса. Работа является функцией процесса, т.к. зависит от пути, по которому шел процесс. Это макроскопическая форма передачи энергии.
Различают следующие виды работ:
- механическая работа, совершаемая механической силой по перемещению тел в пространстве;
- работы немеханического характера (электрическая работа перенесения заряда в электрическом поле, магнитная работа, химическая работа и др.).
Теплообмен – это передача энергии под воздействием хаотического, теплового движения микрочастиц, составляющих макроскопические тела, при наличии разности температур соприкасающихся тел. В этом случае количество передаваемой энергии называют теплотой или теплотой процесса. Теплота является функцией процесса, так как зависит от пути процесса. Теплота – это микроскопическая форма передачи энергии.
Надо иметь в виду, что работа и теплота не являются энергией или ее видом, а является лишь двумя способами передачи энергии, двумя способами обмена энергией. Они могут вызывать во взаимодействующих телах изменение движения материи любой формы.
Термодинамическая система
Термодинамической системой (ТС) называется совокупность тел, обменивающихся между собой и окружающей средой энергией и веществом. Объектом изучения может быть вещество - термодинамическое рабочее тело (ТРТ), как частный случай ТС, или совокупность тел, состоящая из источника тепла, холодильника, ТРТ и аккумулятора работы и составляющая ТС. Тела, не входящие в состав исследуемой ТС, объединяются общим понятием «окружающая среда». На границе ТС и окружающей среды происходит взаимодействие между ТС и окружающей средой, которое заключается в передаче энергии и вещества в ТС и из нее. Число воздействующих на ТС сил определяется числом степеней свободы ТС-N.
Если на ТС воздействуют только силы нормального давления – ри температуры –Т, т.е. число степеней свободы ТСN=2, то такая ТС называется простой или термодеформационной. Примером такой ТС может служить рабочее тело в цилиндре поршневого двигателя. Если число степеней свободы ТСN>2, то такие ТС называются сложными. Например, если кроме давленияри температуры Т на ТС воздействуют электрические и магнитные поля (N=4).
В зависимости от характера взаимодействия между ТС и окружающей средой, т.е. в зависимости от свойств границы между ТС и окружающей средой различают:
- закрытые или замкнутые термодинамические системы, если граница ТС непроницаема для вещества, т.е. отсутствует массообмен между ТС и окружающей средой;
- открытые термодинамические системы, если имеется массообмен между ТС и окружающей средой и через границу ТС переходит вещество;
- проточные термодинамические системы, как частный случай открытых ТС, когда на одних участках границы вещество входит в ТС, а на других участках границы выходит из ТС;
- изолированные ТС, когда границу системы не пересекают ни потоки вещества, ни потоки энергии;
- адиабатные ТС, когда система не обменивается с окружающей средой теплотой, т.е. термодинамическая система находится в тепловой изоляции.
В термодинамике обычно рассматриваются неподвижные макроскопические ТС в системе координат, связанной с центром масс ТС.
Вещество. Фазы. Агрегатные состояния
Под веществом понимается материя, обладающая массой покоя.
Чистое вещество – это вещество, состоящее из одинаковых структурных частиц, т.е. из частиц одинакового вида. При этом под частицами понимаются молекулы, атомы, положительные или отрицательные ионы, электроны.
Индивидуальным веществом называется чистое вещество в определенном фазовом состоянии. Например, С (графит), С (алмаз), С (газ).
Тела могут находиться в ТС в различных агрегатных состояниях: твердом (т), жидком (ж) и газообразном (г). Плазма с точки зрения термодинамики – это ионизированный газ со специфическими свойствами. Пар – это газ, контактирующий со своей конденсированной фазой, и деление на пар и газ является условным. Примеры обозначения агрегатного состояния: СО2(т), Н2О (ж), Н2О (г).
Фаза – это гомогенная часть гетерогенной ТС, ограниченная поверхностью раздела. Гетерогенная ТС – это ТС, состоящая из двух и более фаз.
Гомогенная ТС – это ТС, между любыми частями которой нет поверхностей раздела. Гомогенная ТС, во всех частях которой свойства системы одинаковые, называется однородной ТС.
Фаза, содержащая одно вещество, называется чистой фазой.
Конденсированная ТС – это ТС, состоящая только из твердых и жидких фаз.
Многокомпонентрая ТС – это ТС, состоящая из двух и более индивидуальных веществ (компонентов ТС). Такими ТС являются растворы, сплавы и смеси. Если в фазе находится несколько газообразных веществ, то это газовая смесь.
Состояние термодинамической системы. Параметры и функции состояния.
Состояние рассматриваемой ТС определяется совокупностью физических величин, характеризующих данную ТС. По изменениям этих величин можно проследить за изменениями в ТС при ее взаимодействии с окружающей средой.
Состояние ТС является равновесным, если в ТС наблюдается равномерное распределение физических величин. Так, для простой ТС во всех ее точках должны быть одинаковыми температура и давление. Если в ТС идут процессы выравнивания неравномерностей физических величин, то состояние системы является неравновесным. Состояние ТС изменяется в результате обмена энергией и массой между ТС и окружающей средой.
Параметрами и функциями состояния ТС называют физические величины, значения которых не зависят от пути, по которому ТС пришла в данное состояние, т.е. от предыстории ТС. К параметрам состояния относятся величины, которые имеют простую физическую природу и могут быть непосредственно измерены: температура Т, давлениер, плотностьи удельный объемv. Эти параметры выражают интенсивные свойства. Функции состояния имеют сложную физическую природу и не могут быть непосредственно измерены. К ним относятся: внутренняя энергияU, энтальпияН, энтропияSи другие величины.
На ТС при взаимодействии ее с окружающей средой действуют термодинамические силы, которые называются потенциалами термодинамических воздействий или обобщенными силами. К ним относятся механические силы: давление р [Па], касательное напряжениер[Па], силаF[Н] и обобщенные силы немеханического характера: температураТ[К], напряженность магнитного поляН[А/м], напряженность электрического поляЕ [В/м].
Каждой обобщенной силе соответствует обобщенная координата. Обобщенными координатами называются параметры состояния, изменяющиеся при наличии взаимодействия данного рода. Так для простой ТС обобщенной силе – давлению рсоответствует обобщенная координата – объемv, поскольку перемещение поршня приводит к изменению объема ТС. Для обобщенной силы – температурыТроль обобщенной координаты выполняет энтропияS [Дж/К].
Различие значений обобщенной силы на границе между ТС и окружающей средой приводит к взаимодействию данного рода, т.е. к передаче энергии в данной форме. Это необходимое условие возникновения в ТС различных процессов: теплообмена и различных видов работ.
Все физические величины, характеризирующие ТС, подразделяются на независимые, которые задаются, и зависимые, которые вычисляются через известные параметры, а также на калорические и термические, интенсивные и экстенсивные, полные и относительные.
Калорические величины – это величины, которые выражаются в единицах энергии. Например: внутренняя энергия U[Дж], энтропияS[Дж/К], теплотаQ[Дж], работаL[Дж], теплоемкостьС[Дж/К] и др. Термические величины – это величины, чей физический смысл не связан непосредственно с понятием энергии. Например: термодинамическая температураТ [К], давлениер [Па] и др.
Параметры, не зависящие от количества вещества ТС, выражают интенсивные свойства ТС. К ним относится:
термодинамическая температура Т,[К] (абсолютная термодинамическая шкала температур Кельвина), которая связана с эмпирической шкалой температур Цельсия t,0С (стоградусная международная температурная шкала) формулой:
![]()
Абсолютная термодинамическая шкала температур определяется с помощью тройной точки воды в качестве реперной точки со значением 273,15К, а нижней границей шкалы служит абсолютный нуль температур.
Эмпирической температурой называется мера отклонения тела от состояния теплового равновесия с тающим льдом, находящимся под давлением в 1 физическую атмосферу. Измеряется эта температура термометрами: ртутным, спиртовым, газовым и др. На термометре наносят исходные опорные точки-реперы, отвечающие устойчивым тепловым состоянием: таяния льда (00С) и кипения воды (1000С) прир=1 физ.атм.
Эмпирическая шкала температур Фаренгейта имеет реперную точку при температуре тающей смеси равных долей льда и нашатырного спирта, которая принимается за 00F. Эта точка лежит на 320 Fниже 00С, а интервал от 00С до 1000С соответствует 1800F. Таким образом, шкала Цельсия связана со шкалой Фаренгейта формулой:
![]() .
.
Цена деления шкалы Реомюра больше, чем шкалы Цельсия, т.к. интервал от 00С до 1000С разбит на 80 частей.
Термодинамическое абсолютное давление:
![]() ,
,![]() ,
[Па]
,
[Па]
где рМ- манометрическое (избыточное) давление, измеряемое манометром;рБ– барометрическое (атмосферное) давление, измеряемое барометром;рВ– давление, измеряемое вакуумметром (избыток барометрического давления над абсолютным давлением).
Давление газа рчисленно равно силе, действующей на единицу площади поверхности и направленной по нормали к стенкам оболочки, в которой заключен газ. В системе СИ давление измеряется в Ньютонах на м2или Паскалях, т.е. 1Н/м2=1Па. Связь с другими системами единиц:
1техн.атм = 0,968физ.атм = 9,81104Па = 1кгс/см2 = 104кгс/м2 = 735ммНg= = 10000,3ммН2О = 0,981бар.
Удельный объем рабочего тела v=V/m, м3/кг, гдеV, м3– объем ТС;m, кг – масса ТС.
Плотность – масса единицы объема рабочего тела, или массовая концентрация:
![]() ,
кг/м3.
,
кг/м3.
К параметрам, выражающим интенсивные свойства ТС относятся также напряженности электрического и магнитного полей и др.
Экстенсивными или аддитивными (суммируемыми) называются величины, значения которых пропорциональны количеству вещества ТС. Будем их обозначать прописными (заглавными) буквами. К ним относятся: внутренняя энергия U, энтальпияH, объемV, энтропияSи др. Эти величины называются также полными дляmкг ТС.
Если ТС состоит из отдельных частей, то значение экстенсивной величины для ТС равно сумме значений этой величины для всех частей ТС.
Для гомогенной, однородной ТС удобно использовать относительные величины:
Удельные величины, отнесенные к 1 кг вещества. Например: v=V/m– удельный объем, м3/кг;h=H/m– удельная энтальпия, Дж/кг;u=U/m- удельная внутренняя энергия, Дж/кг;s=S/m– удельная энтропия, Дж/кгК и др.
объемные величины, отнесенные к 1м3вещества:
 - массовая концентрация, кг/м3и
др.
- массовая концентрация, кг/м3и
др.Молярные величины, отнесенные к 1 молю вещества. Будем обозначать эти величины прописными (заглавными) буквами со знаком «» сверху буквы:
 - молярный объем, м3/моль, гдеn– количество вещества, моль;
- молярный объем, м3/моль, гдеn– количество вещества, моль;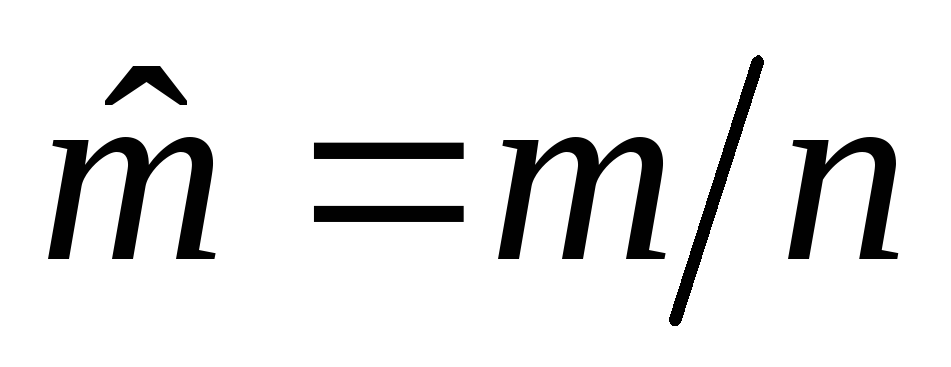 - молярная масса, кг/моль;
- молярная масса, кг/моль;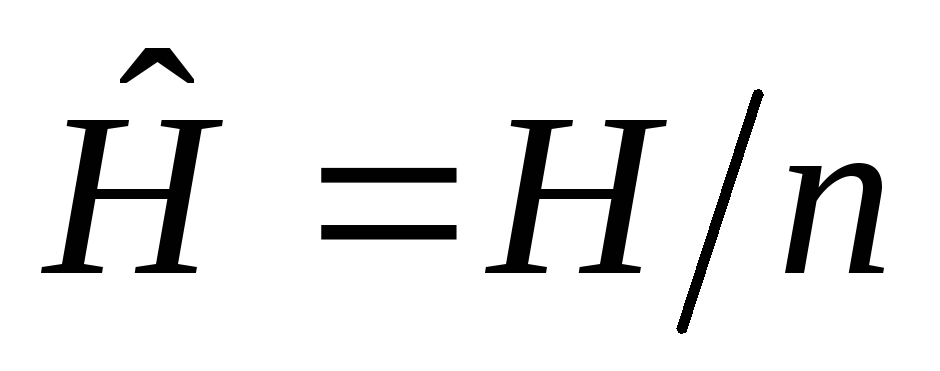 - молярная энтальпия, Дж/моль;
- молярная энтальпия, Дж/моль;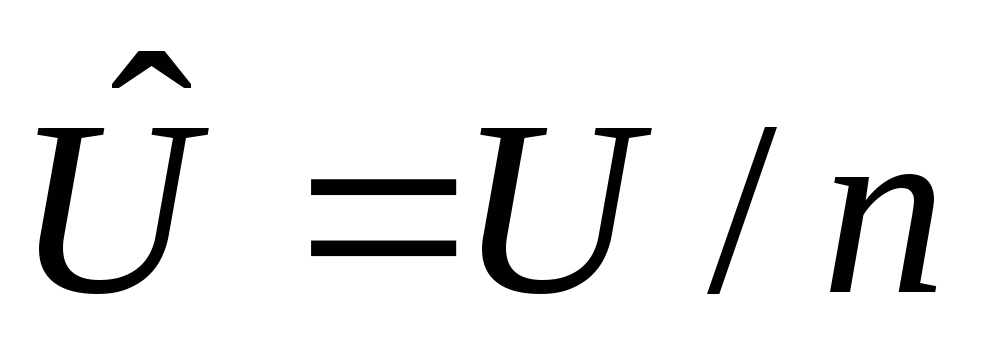 - молярная внутренняя энергия, Дж/моль;
- молярная внутренняя энергия, Дж/моль; - молярная энтропия, Дж/(мольК) и др.
- молярная энтропия, Дж/(мольК) и др.
Молем газа называется количество газа, весящего столько граммов, сколько единиц в относительной молекулярной массе М:
![]() кг/моль.
кг/моль.
Напомним, что в одном моле любого вещества содержится NА=6,0221023, моль-1, частиц (молекул) газа, гдеNA– число (постоянная) Авагадро. В соответствии с законом Авагадро в равных объемах разных газов при одинаковых давлении и температуре содержится равное число молекул. Массы молей разных газов различны, но их молярные объемы при одинаковых физических условиях одинаковы, т.е. не зависят от природы газа.
При t=00Cи 1физ.атм![]() м3/моль,
м3/моль,
при t=150С и 1техн.атм![]() м3/моль.
м3/моль.
Для характеристики масс частиц вещества будем использовать величины:
Молекулярная масса – масса одной структурной частицы – m1, кг.
Относительная молекулярная масса
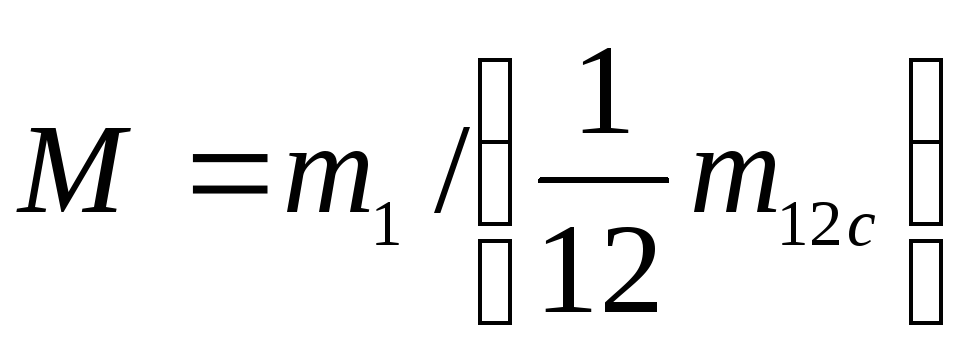 .
М – величина безразмерная и приводится
в таблицах для каждого индивидуального
вещества в справочниках.
.
М – величина безразмерная и приводится
в таблицах для каждого индивидуального
вещества в справочниках.Молярная масса – масса одного моля данного вещества
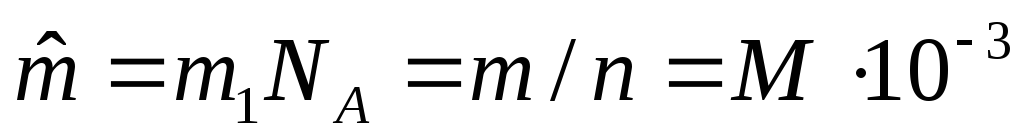 ,
кг/моль, гдеNA– число Авагадро.
,
кг/моль, гдеNA– число Авагадро.
Термодинамические процессы и их классификация
Термодинамическим процессом называется изменение состояния ТС в результате ее взаимодействия с окружающей средой. Термодинамические процессы могут быть равновесными и неравновесными.
Непрерывная последовательность равновесных состояний образует равновесный процесс, при котором отсутствуют потери энергии на трение, завихрение, излучение и др., а ТС совершает максимальную работу против внешних сил. Равновесный процесс можно изобразить на координатной плоскости в p-Vкоординатах графически в виде плавно сменяющихся равновесных состояний.

При расширении газа процесс идет с увеличением объема ТС. При этом ТС совершает работу
![]() ,
Дж.
,
Дж.
Работа расширения положительна (L>0). Процесс, идущий с уменьшением объема ТС, называется процессом сжатия. Работа, затрачиваемая на сжатие газа, отрицательна (L<0).
В термодинамике большое применение
получили частные случаи термодинамических
процессов: изохорный процесс, протекающий
при постоянном объеме (V=const);
изобарный процесс, протекающий при
постоянном давлении (p=const);
изотермический процесс, протекающий
при постоянной температуре (T=const)
и адиабатный процесс, протекающий без
теплообмена ТС с окружающей средой (![]() иq=0).
иq=0).
Круговой процесс (цикл) – это процесс, при котором ТС, претерпев ряд изменений, возвращается в исходное состояние.
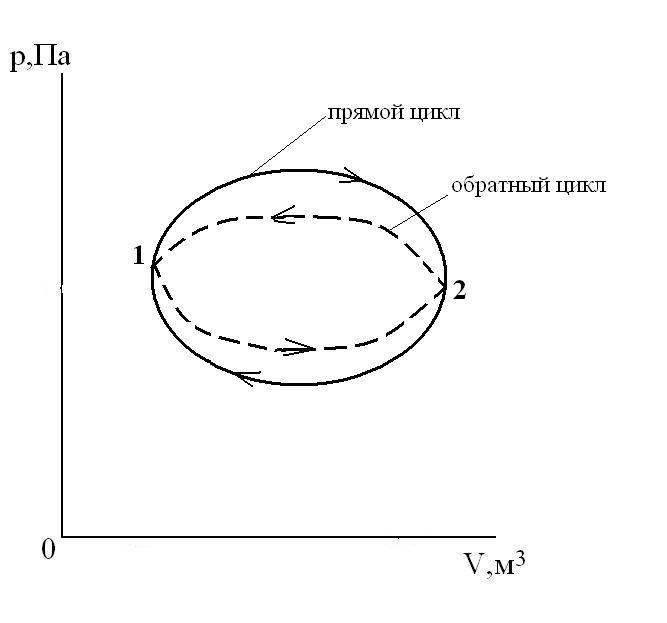
Прямой цикл – цикл тепловых двигателей, идущий в p-Vкоординатах по часовой стрелке (линия расширения лежит выше линии сжатия). Обратный цикл – цикл холодильных установок и машин-орудий, идущий вp-Vкоординатах против часовой стрелки (линия расширения лежит ниже линии сжатия).
Процессы могут быть обратимыми и необратимыми. При обратимом процессе ТС, пройдя ряд состояний, может вернуться в начальное состояние через те же промежуточные состояния. При этом в ТС и окружающей среде не происходит никаких изменений. При этом процесс является равновесным, т.е. отсутствуют потери энергии на трение, теплообмен и др., а также обеспечивается механическое и термическое равновесие на границе ТС с окружающей средой (обеспечивается бесконечно малая разность давлений и температур в каждый момент процесса).
Все реальные процессы являются неравновесными и необратимыми и могут рассматриваться как равновесные и обратимые только в рамках некоторой идеализации, в рамках определенных допущений.
