
- •Термодинамика
- •Глава 1 Основные понятия и определения термодинамики…………… 11
- •Глава 8 Термохимия…………………………………………………….. 60
- •Глава 9 Термодинамические свойства индивидуальных веществ. Стандартное состояние вещества……………………………… 69
- •Глава 10 Отдельная химическая реакция………………………………… 83
- •Глава 11 Методы расчета термодинамических свойств химически реагирующих систем…………………………………………… 104
- •Глава 12 Термодинамические политропные процессы с идеальными газами……………………………………………………………. 156
- •Глава 13 Тепловые машины и компрессоры……………………………. 171
- •Глава 14 Термодинамика потоков жидкости и газа………………………197
- •Глава 15 Водяные пары……………………………………………………..223
- •Глава 16 Основы эксергетического метода термодинамического анализа………………………………………………………… 241
- •Глава 1. Основные понятия и определения термодинамики
- •Глава 2 уравнения состояния вещества
- •2.1. Термические и калорические уравнения состояния
- •2.2. Термические уравнения состояния для идеального газа
- •2.3. Термические уравнения состояния для реальных газов
- •Глава 3. Смеси веществ
- •3.1. Способы задания состава смеси. Закон Амага.
- •3.2. Соотношения для смесей идеальных газов. Закон Дальтона
- •Глава 4. Теплоемкость
- •4.1. Виды теплоемкости
- •4.2. Уравнение Майера
- •4.3. Теплоемкость химически реагирующей термодинамической системы
- •Глава 5. Первый закон термодинамики
- •5.1. Уравнение первого закона термодинамики для сложной открытой системы в общем виде.
- •5.2. Уравнение 1-го закона термодинамики для проточной термодинамической системы
- •Глава 6. Второй закон термодинамики
- •6.1. Сущность второго закона термодинамики. Равновесные и неравновесные состояния, обратимые и необратимые процессы
- •6.2. Математическое выражение 2-го закона термодинамики. Три составляющие изменения энтропии термодинамической системы
- •6.3. Энтропия изолированной термодинамической системы
- •Глава 7. Объединенные выражения первого и второго законов термодинамики
- •7.1. Различные формы записи объединенных выражений
- •7.2. Характеристические функции и дифференциальные соотношения взаимности термодинамики
- •7.3. Максимальная и минимальная работы процесса. Термодинамические потенциалы
- •7.4. Условия равновесия термодинамической системы. Термодинамическое сродство
- •7.5. Связь между изобарной и изохорной теплоемкостями в общем виде
- •7.6.Расчетные выражения для скорости звука в общем виде
- •7.7. Максимальная и минимальная теплоты процесса
- •Глава 8. Термохимия
- •8.1. Формы записи уравнений химических реакций в общем виде
- •8.2. Понятие пробега химической реакции
- •8.3. Изохорный и изобарный тепловые эффекты химических реакций и связь между ними
- •8.4. Зависимости тепловых эффектов хр от температуры. Формула Кирхгофа.
7.5. Связь между изобарной и изохорной теплоемкостями в общем виде
Функция состояния ТС – энтропия может быть представлена в виде функциональной связи S=S(T,V). Дифференциал энтропии – полный дифференциал, т.е.
![]() . (1)
. (1)
Разделим уравнение (1) на dTи умножим наТприр=const. Тогда имеем:
![]() . (2)
. (2)
По определению
![]() и
и![]() .
После их подстановки в (2) получим:
.
После их подстановки в (2) получим:
![]() . (3)
. (3)
Производная
![]() включает калорическую величину –
энтропию и неудобна при расчетах. Поэтому
заменим эту производную, используя
соотношения взаимности Максвелла для
смешанных производных от свободной
энергии Гельмгольца:
включает калорическую величину –
энтропию и неудобна при расчетах. Поэтому
заменим эту производную, используя
соотношения взаимности Максвелла для
смешанных производных от свободной
энергии Гельмгольца:
![]() .
.
Тогда, используя уравнение связи в виде:
![]() ,
получим:
,
получим:
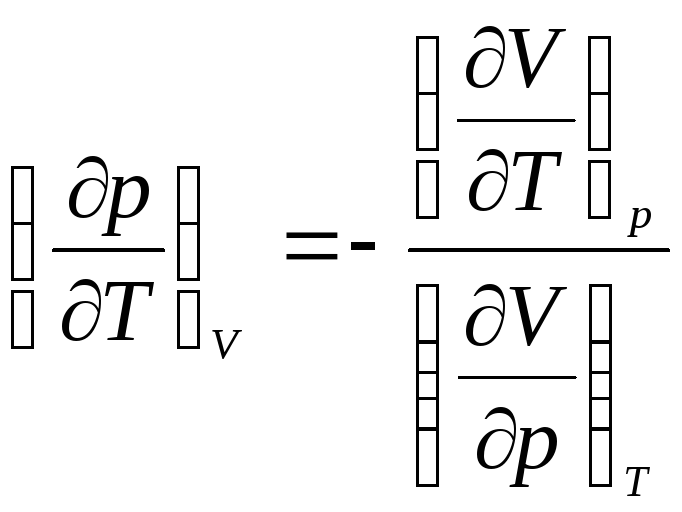 . (4)
. (4)
Подставим выражение (4) вместо
![]() в (3) и получим:
в (3) и получим:
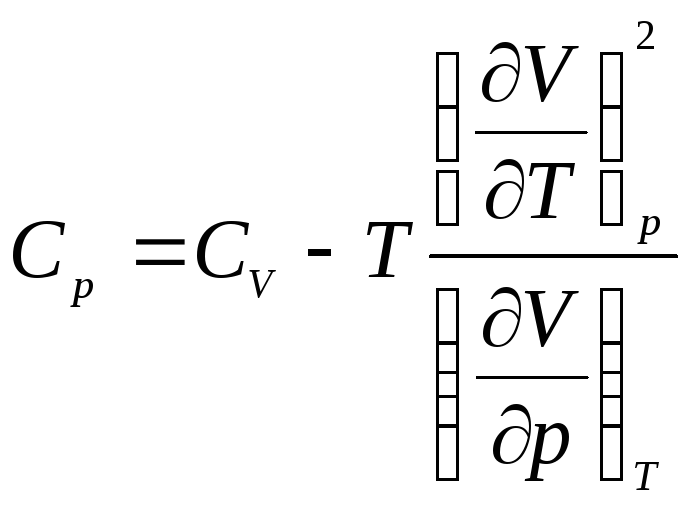 . (5)
. (5)
Покажем, как из уравнения (5) можно получить уравнение Майера для идеального газа, дифференцируя уравнение состояния:
![]() .
Тогда
.
Тогда![]() и
и![]() .
.
После подстановки этих производных в (5) получим:
![]() ,
Дж/К.
,
Дж/К.
Таким образом, получили уравнение Майера для общих теплоемкостей Ср и СVсистемы:
![]() .
.
Получим связь между СриCVв другом виде, используя производные
от натуральных логарифмов параметров
и учитывая, что![]() .
.
Тогда получим, что
![]() и
и![]() . (6)
. (6)
После подстановки выражений (6) в уравнение
(5) с учетом, что
![]() ,
окончательно получим связь между
изобарной и изохорной теплоемкостями
в общем виде:
,
окончательно получим связь между
изобарной и изохорной теплоемкостями
в общем виде:
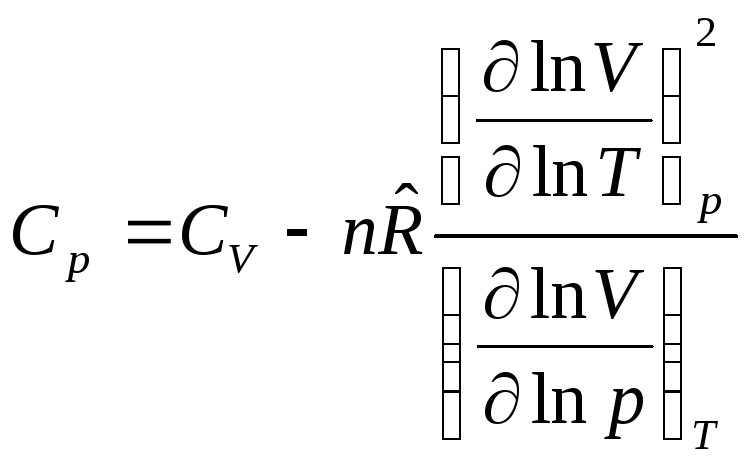 .
.
7.6.Расчетные выражения для скорости звука в общем виде
По определению адиабатная скорость звука равна:
![]() ,
(1)
,
(1)
где плотность газа
![]() и
и![]() .
Тогда:
.
Тогда:
![]() . (2)
. (2)
По уравнению связи частных производных одного параметра по другому имеем:
![]() ,
откуда:
,
откуда:
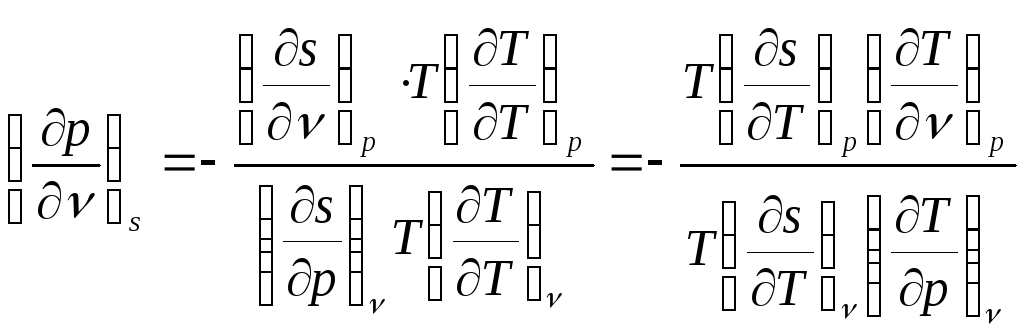 .
.
По определению изобарная и изохорная удельные теплоемкости равны:
![]() и
и![]() .
Тогда
.
Тогда
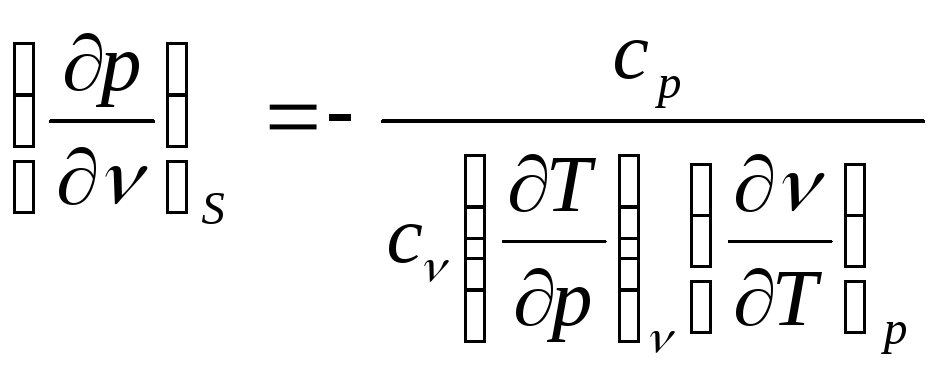 . (3)
. (3)
После подстановки выражения (3) в (2) имеем:
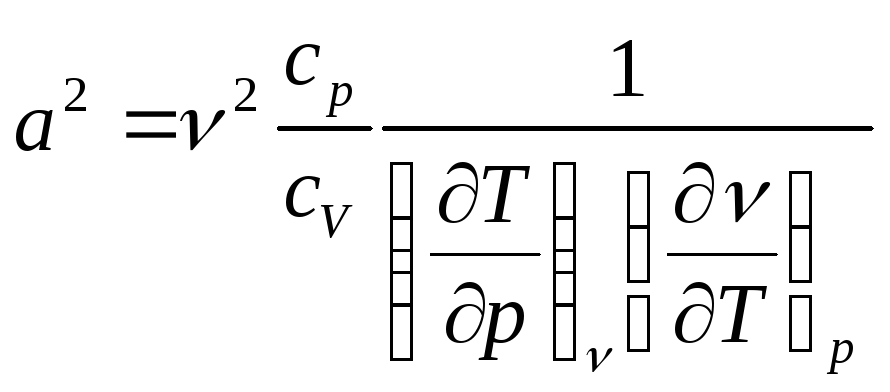 . (4)
. (4)
По уравнению связи:
![]() ,
имеем:
,
имеем:
![]() . (5)
. (5)
После подстановки выражения (5) в (4) окончательно имеем выражение для расчета скорости звука в общем виде:
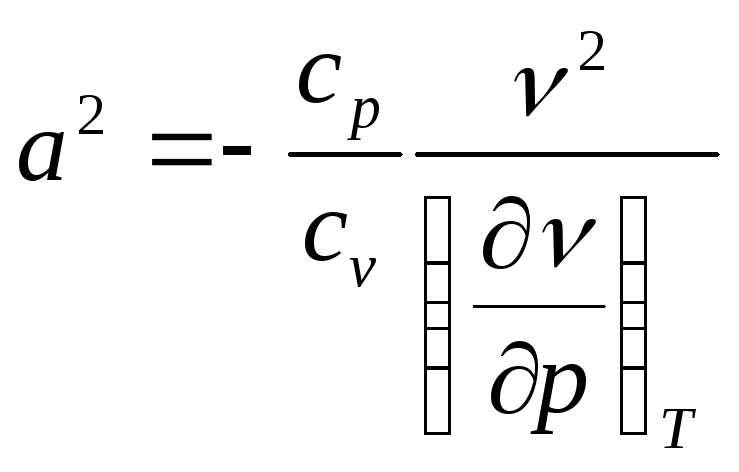 . (6)
. (6)
Из формулы (6) получим формулу для расчета
скорости звука в идеальном газе при
условии, что удельная газовая постоянная
Rне зависит от давления
и температуры. Тогда из уравнения
состояния для 1 кг идеального газа:![]() ,
имеем
,
имеем![]() и производную
и производную![]() .
После подстановки выражения для
.
После подстановки выражения для![]() в формулу (6) получим:
в формулу (6) получим:
![]() ,
где
,
где![]() - показатель адиабаты,
- показатель адиабаты,![]() .
Тогда:
.
Тогда:![]() - скорость звука в идеальном газе.
- скорость звука в идеальном газе.
7.7. Максимальная и минимальная теплоты процесса
Уравнения первого закона термодинамики в сложных закрытых ТС при двух фиксированных параметрах имеют вид:
- для изохорно-изотермического процесса
(T,V=const):![]() ℒТ,V
;
ℒТ,V
;
- для изобарно-изотермического процесса
(T,p=const):![]() ℒТ,р.
ℒТ,р.
При написании этих уравнений использовалось
правило знаков, принятое в термодинамике,
т.е.
![]() ,
если теплота подводится к ТС, и
,
если теплота подводится к ТС, и![]() ℒ>0,
если работа совершается термодинамической
системой. В термохимии принято
противоположное правило знаков для
теплоты, т.е. теплота
ℒ>0,
если работа совершается термодинамической
системой. В термохимии принято
противоположное правило знаков для
теплоты, т.е. теплота![]() ,
(положительна), если она отводится от
ТС. Тогда для конечных процессов 1-2
уравнение 1-го закона термодинамики
будет иметь вид:
,
(положительна), если она отводится от
ТС. Тогда для конечных процессов 1-2
уравнение 1-го закона термодинамики
будет иметь вид:
![]() ℒТ,V, (1)
ℒТ,V, (1)
![]() ℒТ,р, (2)
ℒТ,р, (2)
Соотношения (1) и (2) справедливы для любых процессов, обратимых и необратимых.
Для обратимого процесса
ℒ=ℒmax ,
![]() :
:
![]() ℒТ,V
max, (3)
ℒТ,V
max, (3)
![]() ℒТ,p
max, (4)
ℒТ,p
max, (4)
Для максимально возможного необратимого
процесса ℒ=ℒmin=0,
![]() :
:
![]() , (5)
, (5)
![]() .(6)
.(6)
Соотношения (5) и (6) используются в
химической термодинамике для расчета
изохорного и изобарного тепловых
эффектов химических реакций (ТЭХР). В
этом случае работа ℒmaxпреобразуется в тепловую энергию
неупорядоченного движения частиц (в
теплоту![]() и
и![]() ).
).
В случае обратимого равновесного
процесса перераспределения масс
(уравнения (3) и (4)) величины
![]() и
и![]() - это количества теплоты, которыми ТС
обменивается с окружающей средой в
процессах
- это количества теплоты, которыми ТС
обменивается с окружающей средой в
процессах![]() и
и![]() .ℒТ,VmaxиℒТ,pmax- максимальные количества работы
немеханического характера, которые
могут быть получены от ТС в процессах
.ℒТ,VmaxиℒТ,pmax- максимальные количества работы
немеханического характера, которые
могут быть получены от ТС в процессах![]() и
и![]() .
.
В случае необратимого процесса
перераспределения массы в соответствии
со вторым законом термодинамики работа
ℒmaxпреобразуется в теплоту, количество
которого равно изменению внутренней
энергии![]() в процессе
в процессе![]() ,
или изменению энтальпии
,
или изменению энтальпии![]() в процессе
в процессе![]() ,
протекающем в сложных термодинамических
системах.
,
протекающем в сложных термодинамических
системах.
Химические реакции, при которых теплота
отводится от термодинамической системы
![]() ,
чтобы конечные продукты имели ту же
температуру, что и начальные реагенты,
называются экзотермическими химическими
реакциями. Химические реакции,
сопровождающиеся поглощением теплоты
,
чтобы конечные продукты имели ту же
температуру, что и начальные реагенты,
называются экзотермическими химическими
реакциями. Химические реакции,
сопровождающиеся поглощением теплоты![]() ,
приT=const, называются эндотермическими химическими
реакциями.
,
приT=const, называются эндотермическими химическими
реакциями.
Рассмотрим два примера: 1. разрядка
химического источника электроэнергии
(аккумулятор, батарея карманного фонаря)
– процесс обратимый: ℒТ,pmax- преобразуется в электрическую энергию,
а![]() - отводится от системы. 2. Если замкнуть
клеммы батареи накоротко, то получим
максимально необратимый процесс:ℒ
- отводится от системы. 2. Если замкнуть
клеммы батареи накоротко, то получим
максимально необратимый процесс:ℒ![]() ,
,![]() .
.
