
- •Начала квантовой химии и строение молекул
- •Решаемые задачи:
- •Модель Томсона (1904 г.)
- •Взаимное расположение электронов в атоме
- •Х. Гейгер и е. Марсден (1906-1909 г.)
- •Планетарная модель атома:
- •Серия Бальмера в спектре атома водорода (снизу указаны длины волн соответствующих линий в нм).
- •II. Способность атома поглощать и испускать излучение подчиняется закону, по которому излучение, связанное с переходом, должно быть монохроматическим и иметь частоту ν, определяемую соотношением
- •Зависимость силы анодного тока в цепи от ускоряющей разности потенциалов eVа.
- •Некоторые допустимые решения волнового уравнения для одномерных колебаний натянутой струны.
- •УравнениеШредингера
- •Решение уравнения Шредингера для простейших модельных систем
- •Квантовое число m может принимать значения
- •Спиновые квантовые числа некоторых элементарных частиц и атомных ядер.
- •Физический смысл квантовых чисел электрона
- •1. Размеры орбитали.
- •2. Энергию электронов, находящихся на орбитали.
- •Радиальное распределение для орбиталей атома водорода.
- •Теория и методы описания химической связи и строения молекул Метод валентных связей
- •В молекуле н2.
- •Зависимость полной энергии молекулы водорода от межъядерного расстояния
- •Результаты теоретических и экспериментальных определений энергии и длины связи в молекуле н2
- •Основные принципы метода
- •1. Перекрывающиеся ао должны иметь близкие энергии.
- •2. Взаимодействующие ао должны перекрываться в значительной области пространства.
- •3. Ао должны обладать одинаковыми свойствами симметрии относительно оси связи в молекуле.
- •Изменение значений scc в зависимости от межатомного расстояния с─с
- •Водородоподобные.
- •Слетеровские функции (sto).
- •Гауссовские функции (gto). Наименьшие базисные наборы, обеспечивающие описание
- •Число кулоновскихинтеграллов для молекуле пропана, возникающих в различных методах расчета.
- •Сравнительная характеристика полуэмпирических методов.
- •Indo – Intermediate Neglect of Differential Overlap – частичное пренебрежение дифференциальным перекрыванием.
- •Симметрия молекулярных систем Элементы и операции симметрии
- •Оси и плоскости симметрии куба
- •Плоскости симметрии на примере комплексного иона [CuF4]─.
- •1. Правило соответствия
- •2. Правило ассоциативности группового умножения
- •Квантово-химическое описание реакций Квантовая теория химических реакций Понятие о поверхностях потенциальной энергии.
- •Симметрия и относительная энергия мо бутадиена (а) и этилена (б).
- •Схемы строения переходных комплексов для реакции димеризации этилена и взаимодействия этилена с бутадиеном.
- •Симметрия переходного состояния реакции взаимодействия этилена с бутадиеном
Indo – Intermediate Neglect of Differential Overlap – частичное пренебрежение дифференциальным перекрыванием.
MINDO3 – Modified INDO – version 3, улучшенный метод INDO, версия 3.
MNDO – Modified Neglecting of Diatomic Overlap – модифицированное пренебрежение двухатомным перекрыванием.
AM1 – Austin Model 1 – «остиновская модель № 1». Метод назван в честь города Остин (штат Техас, США), в университете которого Ра ботали разработчики метода под руководством М. Дьюара.
PM3 – Parameter Model 3 - «параметрическая модель № 3».
Симметрия молекулярных систем Элементы и операции симметрии
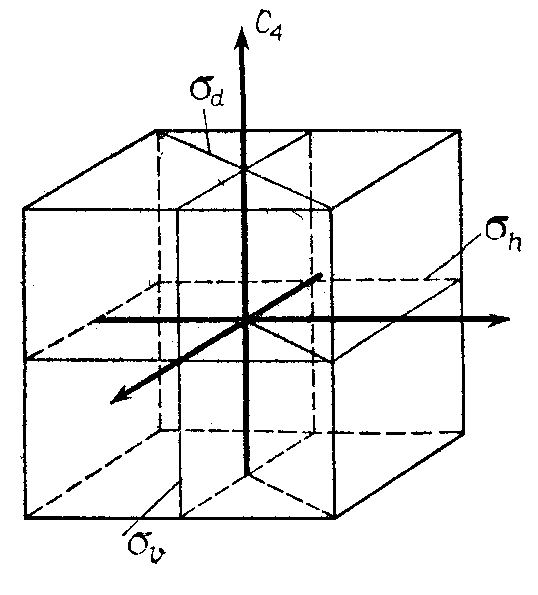
Оси и плоскости симметрии куба
Элементы симметрии и соответствующие им преобразования
Элементы симметрии |
Операции симметрии |
Ось n-го порядка |
Один или несколько поворотов относительно оси на угол 2π/n (Сn) |
Плоскость |
Отражение в плоскости (σ) |
Центр симметрии |
Инверсия всех атомов относительно центра (i) |
Зеркально-поворотная ось n-го порядка |
Поворот на угол 2π/n и последующее отражение в плоскости, перпендикулярной оси поворота (Sn) |
|
(11.1.) |
|
(11.2.) |
|
|

Плоскости симметрии на примере комплексного иона [CuF4]─.
|
(11.3.) |
|
|
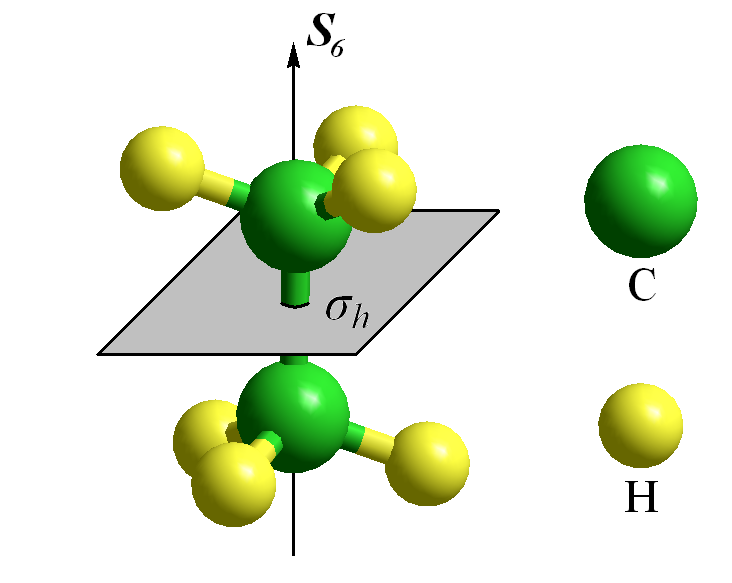
Зеркально-поворотная ось 6-го порядка на примере молекулы этана.
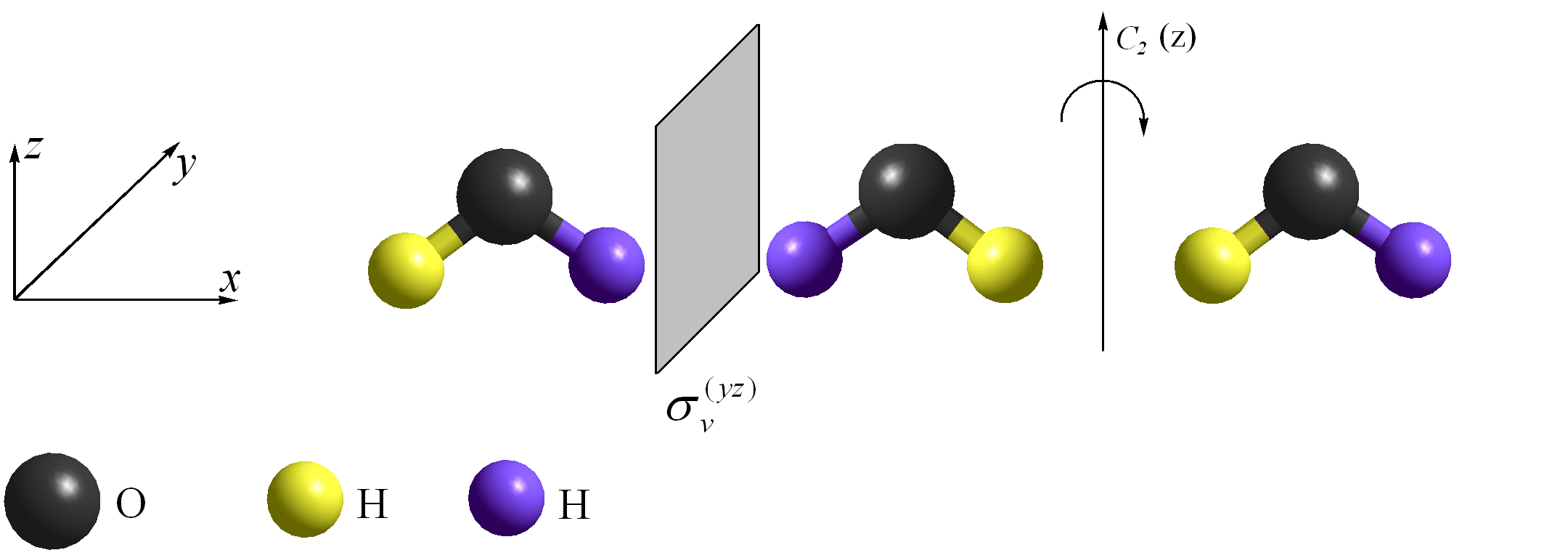
Группа симметрии –некоторое множество объектов с установленными для него правилами комбинации элементов на основе ряда аксиом.
1. Правило соответствия
ab = c |
(11.4.) |
2. Правило ассоциативности группового умножения
c(ab) = a(cb) |
(11.5.) |
3. Правило существования единичного элемента.
aE = Ea = a |
(11.6.) |
4. Каждый элемент a группы должен иметь обратный элемент а–1, для которого выполняется отношение:
a∙а–1 = а–1∙а |
(11.7.) |
Элементы симметрии некоторых точечных групп
Обозначение группы |
Число и тип элементов симметрии |
С2 |
С2 |
С3 |
С3 |
Сi |
i |
S6 |
S6; C3(||S6) |
СS |
σ |
С2v |
С3; 2σv |
С3v |
С3; 3σv |
С4v |
С4; С2 (||С4); 4σv |
С6v |
С6; С3 (||С6); С2 (||С6); 6σv |
D2 |
3
(С2(1) |
D3 |
С3, 3С2 (С2(1) С2(2) С2(3) С3) |
C2h |
С2; σh; i |
C3h |
С2; σh; S3(||С3) |
D2d |
3С2(С2(1) С2(2) С2(3)); S4(||С2);2 σd(||S4) |
D3d |
С3; 3С2( С3); S6(||С3); i; 3σd |
D2h |
3С2(С2(1) С2(2) С2(3)); 3σ(σ(1) σ(2) ) σ(3)) |
D3h |
С3; 3С2( С3); 3σv; σh |
D4h |
С4; 4C2( C4); 4σv; σh; C2(||C4); S4(||C4); i |
D6h |
С6; 6C2( C6); 6σv; σh; C2(||C6); C3(||C4); S6(||C6); i |
T |
3C2(С2(1) С2(2) С2(3)); 4C3 |
Td |
3C2(С2(1) С2(2) С2(3)); 4C3; 6σ; 3S4(||C2) |
Oh |
3C4; 4C3;6C2 ; 9S; i |
Примечание. Cn( Cn') — ось симметрии Сn, перпендикулярная к оси симметрии Cn'; Cn(||Cn') — ось симметрии Сn, совпадающая с осью Cn'.
Группы Сn. Ось симметрии n-го порядка является единственным элементом симметрии.

Геометрия молекулы транс-1,2-дихлорэтана.
Группы Сnh. Молекулы имеют ось симметрии n-го порядка и плоскость симметрии, перпендикулярную этой оси (мета-С6H4ClBr)
Группы Cnv. Молекулы содержат ось симметрии n-го порядка и п плоскостей симметрии, проходящих через эту ось (молекулы, Н2О, H2S, SО2, NО2, фенантрен, транс-C2H2Cl2).
Группы Dn, Dnh и Dnd имеют ось симметрии n-го порядка и п перпендикулярных к ней осей симметрии второго порядка, пересекающихся под углом π/2.

Элементы симметрии молекулы бензола.
Плоские молекулы состава АХ3 относятся к группе симметрии D3h

Элементы симметрии молекулы аллена.
Кубические группы симметрии - каждая из них имеет элементы симметрии, присущие кубу.
Непрерывные группы симметрии - Если в линейной молекуле имеет плоскость симметрии, перпендикулярная к ее оси, то она относится к точечной группе симметрии D∞h.
Определение точечной группы симметрия молекулы

Геометрия молекулы ферроцена
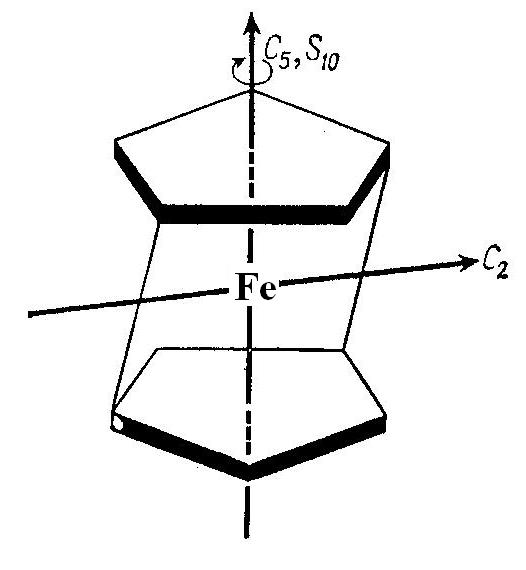
1 шаг: молекула ферроцена нелинейна и потому не принадлежит к группам С∞v и D∞h.
2 шаг: молекула не относится к кубическим группам, так как имеет только одну ось порядка выше второго — С5.
3 шаг: определяем наличие осей Sn.
4 и 5 шаги: проверяем наличие осей второго порядка, перпендикулярных оси С5. Такие оси в молекуле ферроцена имеются. Таким образом, осталось определить, к какой из трех групп – Dn, Dnh или Dnd – относится рассматриваемая молекула. Так как между любыми двумя осями второго порядка можно провести вертикальную плоскость σd, то молекула ферроцена относится к точечной группе симметрии D5d.
Квантово-химические теории строения
координационных соединений.
Теория кристаллического поля.
d-d*-Переходы
[Ti(H2O)6]3+. ls22s22p63s23p6d1.

Положение
d-АО
атома металла относительно лигандов в
октаэдрическом окружении: a
– орбитали
![]() и
,
б – орбитали dxz,
dyz
и dxy.
и
,
б – орбитали dxz,
dyz
и dxy.
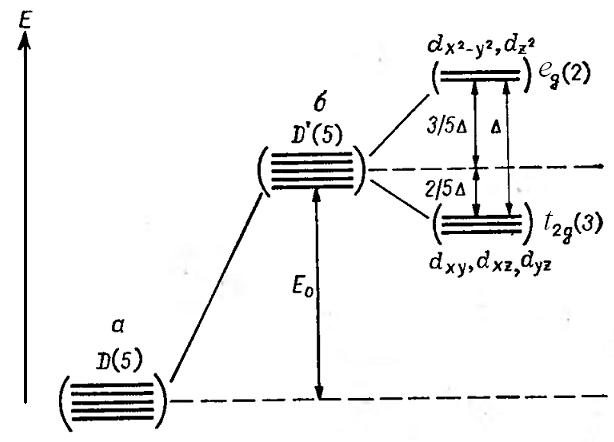
Расщепление d- АО в октаэдрическом поле лигандо.
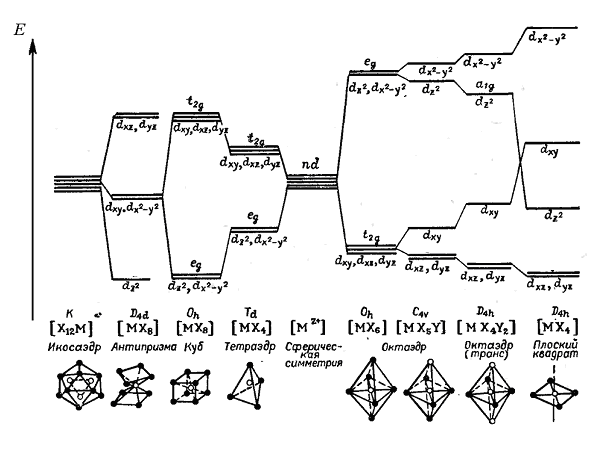
Расщепление d- АО в полях различной симметрии.
Mn(II) < Со(II) ≈ Ni(II) < V(II) < Fе(III) < Сr(III) < Со(III) < Мn(IV) < Mo(III) < <Rh(III) < Ir(III) < Re(IV) < Pt(IV)
Спектрохимический ряд
I– < Вr– < Cl– ≈ SCN– < F– < ОН– < Н2О < NCS– < CN– < NH3 < <H2NC2H4NH2 < NO2– < CN–
Распределение d-электронов в октаэдрических комплексах
Конфигурация ЦИ |
Пример |
Слабое поле |
Сильное поле |
||||
t2g |
eg |
ЭСКП (в ед. Δ) |
t2g |
eg |
ЭСКП (в ед. Δ) |
||
d0 |
Sc3+, Ca2+ |
|
|
0 |
|
|
0 |
d1 |
Ti3+, V4+ |
↑ |
|
0,4 |
↑ |
|
0,4 |
d2 |
Ti2+, V3+ |
↑↑ |
|
0,8 |
↑↑ |
|
0,8 |
d3 |
V2+, Cr3+ |
↑↑↑ |
|
1,2 |
↑↑↑ |
|
1,2 |
d4 |
Cr2+, Mn3+ |
↑↑↑ |
↑ |
0,6 |
↑↓↑↑ |
|
1,6 |
d5 |
Mn2+, Fe3+ |
↑↑↑ |
↑↑ |
0 |
↑↓↑↓↑ |
|
2,0 |
d6 |
Fe2+, Co3+ |
↑↓↑↑ |
↑↑ |
0,4 |
↑↓↑↓↑↓ |
|
2,4 |
d7 |
Co2+, Rh2+ |
↑↓↑↓↑ |
↑↑ |
0,8 |
↑↓↑↓↑↓ |
↑ |
1,8 |
d8 |
Ni2+, Au3+ |
↑↓↑↓↑↓ |
↑↑ |
1,2 |
↑↓↑↓↑↓ |
↑↑ |
1,2 |
d9 |
Cu2+, Ag2+ |
↑↓↑↓↑↓ |
↑↓↑ |
0,6 |
↑↓↑↓↑↓ |
↑↓↑ |
0,6 |
d10 |
Ag+, Hg2+ |
↑↓↑↓↑↓ |
↑↓↑↓ |
0 |
↑↓↑↓↑↓ |
↑↓↑↓ |
0 |
1. Слабое поле лигандов. Средняя энергия отталкивания электронов, расположенных на одной орбитали (Р) меньше параметра расщепления (Δ). Влияние лигандов можно рассматривать лишь как некоторое возмущение.
2. Сильное поле лигандов. Средняя энергия отталкивания электронов больше параметра расщепления, Р > Δ. Состояние с максимальным спином в этом случае является основным.
Теория поля лигандов
[ML6In+, где М – d-элемент 3-го периода.
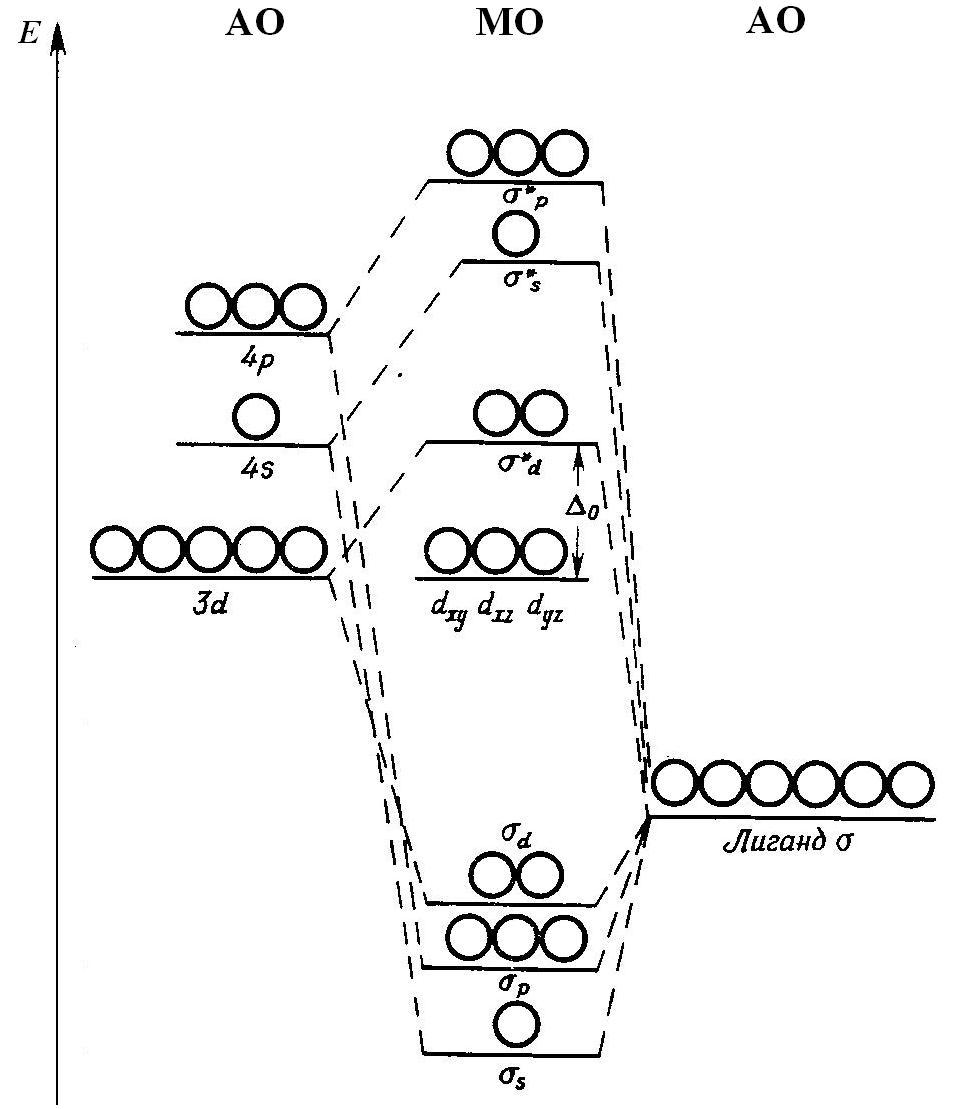
Диаграмма уровней МО октаэдрического комплекса [ML6In+, где L – σ-донорные лиганды.
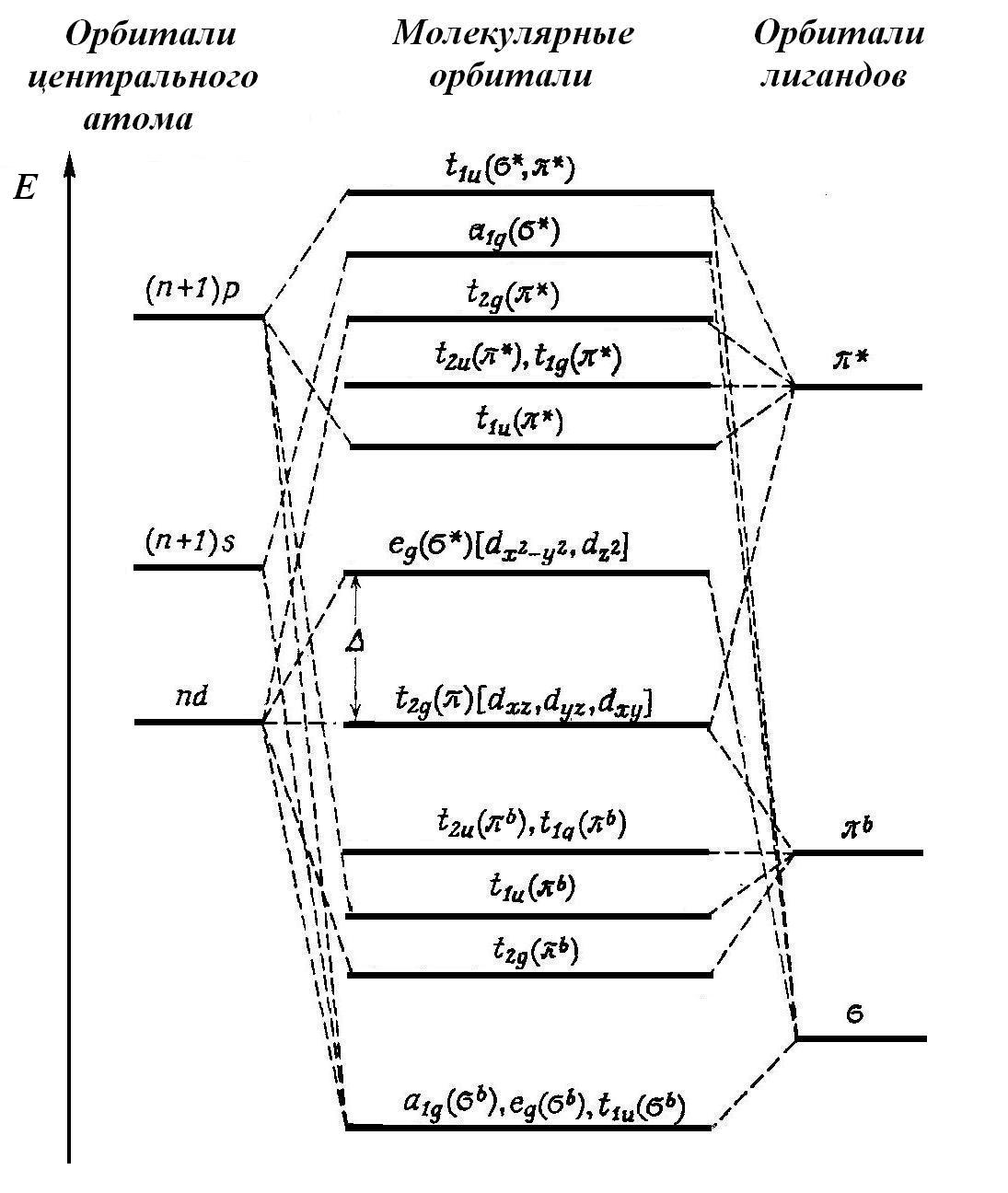
Диаграмма уровней МО октаэдрического комплекса [ML6]n+ с учетом возможных π-взаимодействий металл – лиганд
