- •Начала квантовой химии и строение молекул
- •Решаемые задачи:
- •Модель Томсона (1904 г.)
- •Взаимное расположение электронов в атоме
- •Х. Гейгер и е. Марсден (1906-1909 г.)
- •Планетарная модель атома:
- •Серия Бальмера в спектре атома водорода (снизу указаны длины волн соответствующих линий в нм).
- •II. Способность атома поглощать и испускать излучение подчиняется закону, по которому излучение, связанное с переходом, должно быть монохроматическим и иметь частоту ν, определяемую соотношением
- •Зависимость силы анодного тока в цепи от ускоряющей разности потенциалов eVа.
- •Некоторые допустимые решения волнового уравнения для одномерных колебаний натянутой струны.
- •УравнениеШредингера
- •Решение уравнения Шредингера для простейших модельных систем
- •Квантовое число m может принимать значения
- •Спиновые квантовые числа некоторых элементарных частиц и атомных ядер.
- •Физический смысл квантовых чисел электрона
- •1. Размеры орбитали.
- •2. Энергию электронов, находящихся на орбитали.
- •Радиальное распределение для орбиталей атома водорода.
- •Теория и методы описания химической связи и строения молекул Метод валентных связей
- •В молекуле н2.
- •Зависимость полной энергии молекулы водорода от межъядерного расстояния
- •Результаты теоретических и экспериментальных определений энергии и длины связи в молекуле н2
- •Основные принципы метода
- •1. Перекрывающиеся ао должны иметь близкие энергии.
- •2. Взаимодействующие ао должны перекрываться в значительной области пространства.
- •3. Ао должны обладать одинаковыми свойствами симметрии относительно оси связи в молекуле.
- •Изменение значений scc в зависимости от межатомного расстояния с─с
- •Водородоподобные.
- •Слетеровские функции (sto).
- •Гауссовские функции (gto). Наименьшие базисные наборы, обеспечивающие описание
- •Число кулоновскихинтеграллов для молекуле пропана, возникающих в различных методах расчета.
- •Сравнительная характеристика полуэмпирических методов.
- •Indo – Intermediate Neglect of Differential Overlap – частичное пренебрежение дифференциальным перекрыванием.
- •Симметрия молекулярных систем Элементы и операции симметрии
- •Оси и плоскости симметрии куба
- •Плоскости симметрии на примере комплексного иона [CuF4]─.
- •1. Правило соответствия
- •2. Правило ассоциативности группового умножения
- •Квантово-химическое описание реакций Квантовая теория химических реакций Понятие о поверхностях потенциальной энергии.
- •Симметрия и относительная энергия мо бутадиена (а) и этилена (б).
- •Схемы строения переходных комплексов для реакции димеризации этилена и взаимодействия этилена с бутадиеном.
- •Симметрия переходного состояния реакции взаимодействия этилена с бутадиеном
Х. Гейгер и е. Марсден (1906-1909 г.)
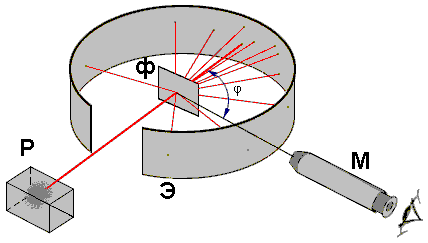
Схема установки для изучения рассеивания
α-частиц.
Подавляющее число α-частиц рассеивалось на небольшие углы порядка 1–3°, наблюдались также α-частицы, отклоняющиеся на бóльшие углы, доходившие до 150°.
Планетарная модель атома:
- в атоме есть положительно заряженное ядро, являющееся «препятствием» для α-частиц;
- ядро имеет очень малые размеры по сравнению с самим атомом (по Резерфорду радиусы ядра и атома составляют порядка 10 –12 и 10 –8 см).
Электроны быстро вращаются вокруг ядра, причем центростремительная сила электрона равна кулоновской силе притяжения его к ядру:
|
(1.1) |
Квантовые и волновые свойства электромагнитного
излучения
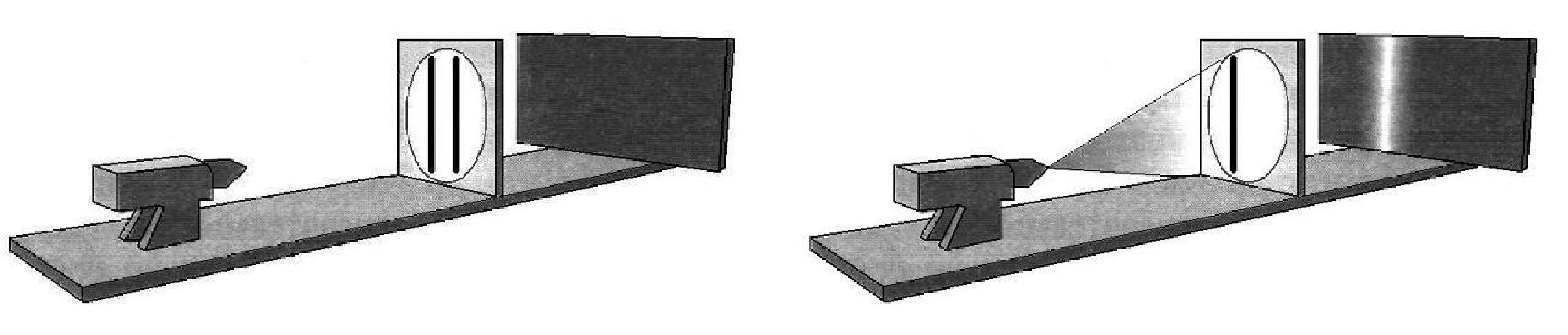
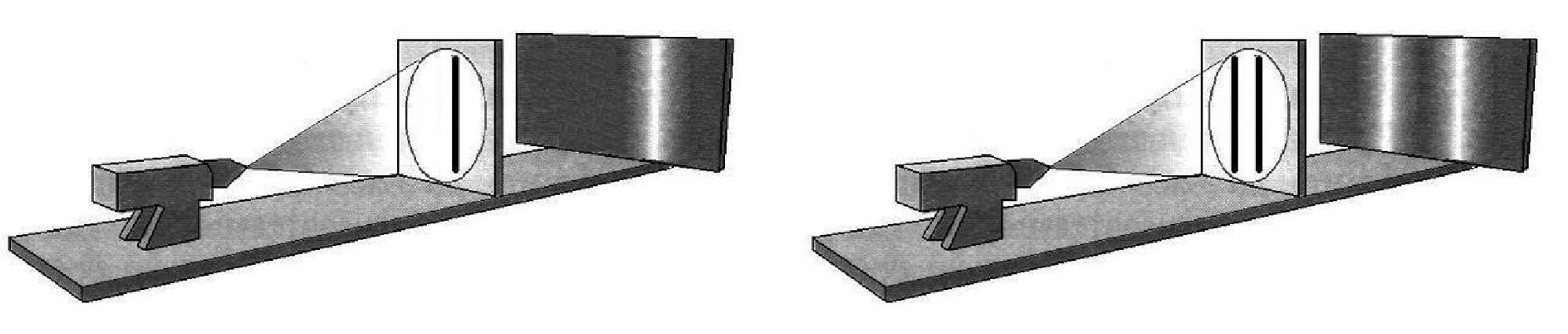
Опыт Юнга (1800 г.)
а б
в г
Корпускулярная модель
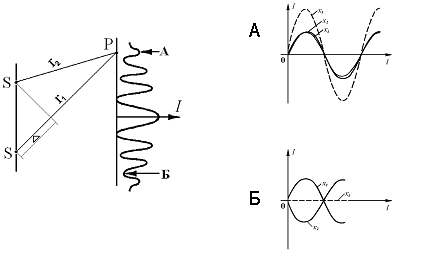
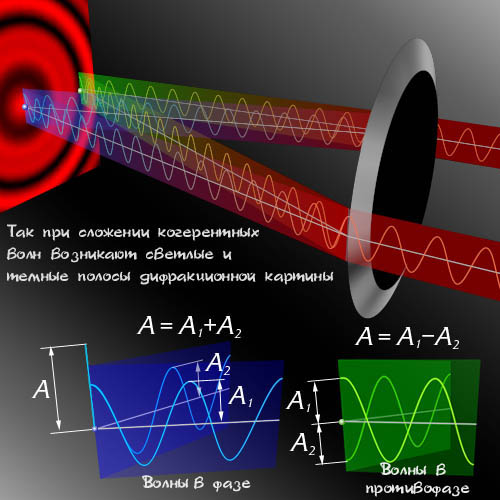
Схема возникновение интерференции между волнами х1 и х2, х 3 - результирующая волна.
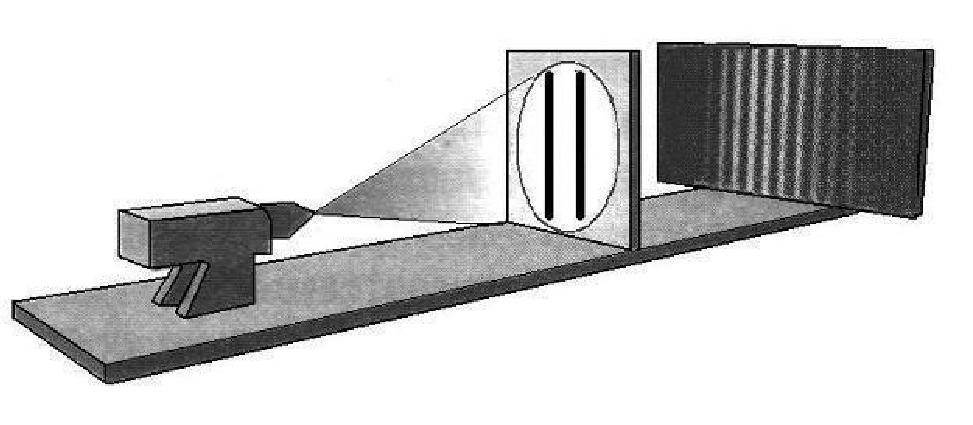
Результаты опыта Юнга с точки зрения волновой
модели света
Дифракция света на краях круглого диска
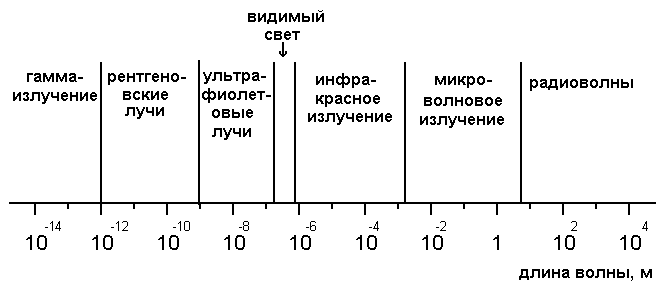
Шкала электромагнитных излучений.
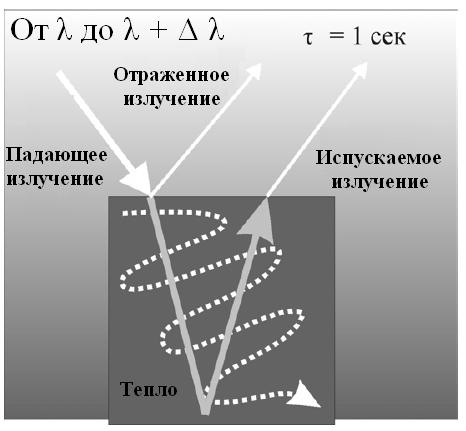
Схема соотношениямежду падающим, отраженным и испускаемым излучением
Закон Кирхгофа (1859 г.)
|
(2.2.) |
||
|
(2.3.) |
||
|
|
||
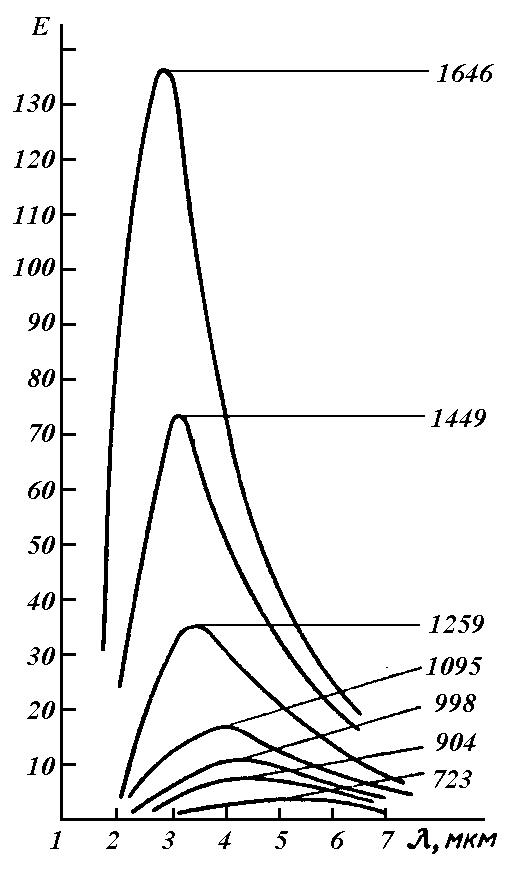
Энергетический спектр излучения абсолютно черного тела при различных температурах (числа на кривых, оС) |
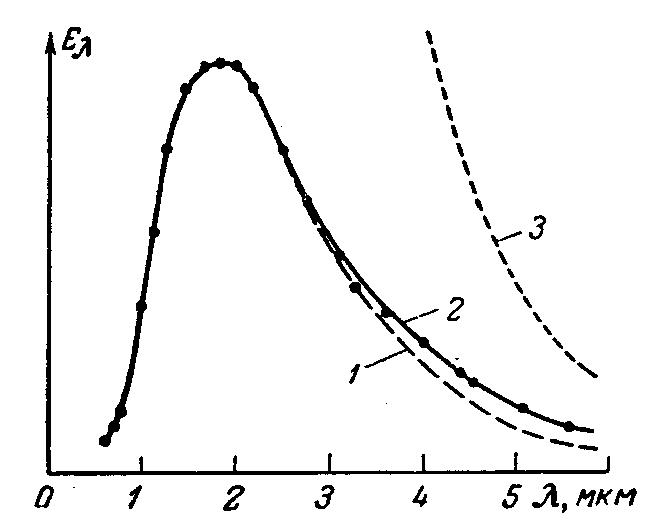
Сопоставление экспериментальных данных (точки) с расчетными (кривые): 1 – по В. Вину; 2– по М. Планку; 3 – по У. Рэлею – Дж. Джинсу. |
||
Формула Планка
ε0 = hv |
(2.8.) |
h = 6,626·1034 Дж⋅сек.
|
(2.9.) |
Теория фотоэффекта
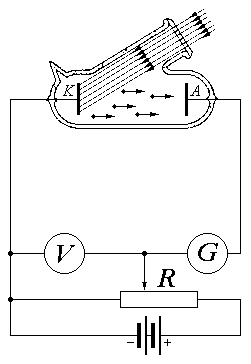
Схема установки для исследования фотоэффекта
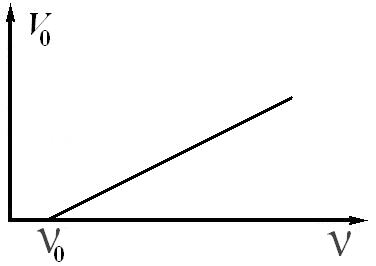
eV0 = Ek |
(2.10.) |
|
|
|
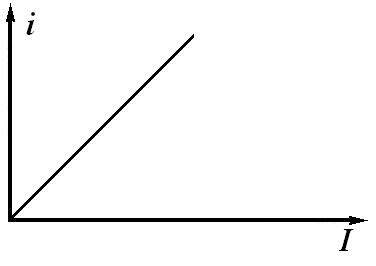
Зависимость силы тока i в цепи от интенсивности света I |
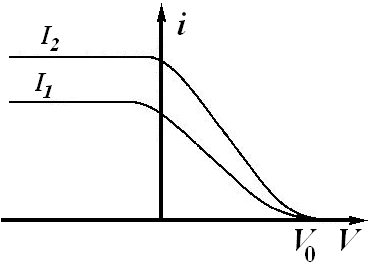
Зависимость силы тока i в цепи от интенсивности света I и потенциала анода |
Зависимость запирающего потенциала V от частоты света ν |
|
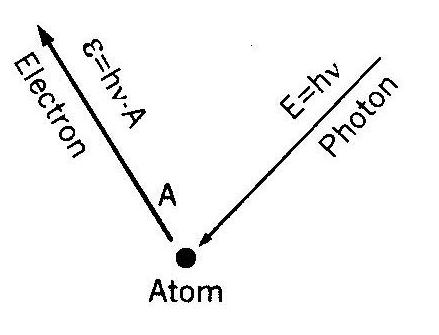
Фотоэффект. Электрон тратит часть энергии А (работа выхода), так что после вылета его энергия равна Eк = hν – A. |
Eк = hν – A |
(2.11.) |
eV0 = hν – A |
(2.12.) |
hν0 = А, ν0 = A / h |
(2.13.) |
р =(h/λ)п,
Истинный смысл постоянной h заключается в том, чтобы служить соединительной черточкой между корпускулярной и волновой сторонами элементарных единиц вещества и излучения
Строение атома по Бору
Рассмотрваемые вопросы: интерпретация атомных спектров, положение о спектральных термах, комбинационный принцип, постулаты Бора, модель атома Бора, модель атома Зоммерфельда, эффект Зеемана, существование эллиптических орбит, квантовые числа электрона: главное, побочное, магнитное.
Атомные спектры и спектральные
закономерности.
«Спектры делают видимым многое не только на громадных мирах, таких как звезды, но и в безгранично мелких мирах, таких как частицы, и разработка в этой области обещает многое выяснить в области атомов и частиц».
Д.И. Менделеев, 1903г.
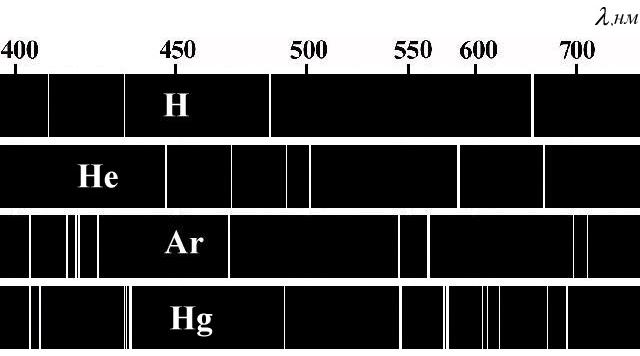
Оптические спектры некоторых атомов.
Каждому элементу соответствует свой атомный спектр (Р. Бунзен и Г. Кирхгоф, 1859 г.).
И. Бальмер - четыре спектральные линии видимой части спектра водорода расположены не беспорядочно, а образуют серию, которую можно описать эмпирической формулой:
|
|
Первые четыре линии серии Бальмера лежат в видимой области спектра и обозначаются Нα, Нβ, Нγ, Нδ, остальные линии, обнаруженные позднее, находятся в УФ области спектра