
- •Розділ 1 методи очищення і знешкодження відхідних газів
- •1.1 Процеси захисту атмосфери
- •Розділ 2 очищення відхідних газів від аерозолів
- •2.1 Основні властивості пилу і ефективність його вловлювання
- •2.2. Очищення газів в сухих механічних пиловловлювачах
- •2.3. Очищення газів у фільтрах
- •2.4 Очищення газів в мокрих пиловловлювачах
- •2.5 Очищення газів в електрофільтрах
- •2.6 Вловлювання туманів
- •2.7 Рекуперація пилу
- •Розділ 3 абсорбційні методи очищення
- •3.1 Очищення газів від оксиду сірки (IV)
- •3.2 Очищення газів від сірководню, сірковуглецю і меркаптанів
- •3.3 Очищення газів від оксидів азоту
- •3.4 Очищення газів від галогенів і їх сполук
- •3.5 Очищення газів від оксиду вуглецю (II)
- •Розділ 4 адсорбційне і хемосорбційне очищення газів
- •4.1 Адсорбція парів летких розчинників
- •4.2 Очищення газів від оксидів азоту
- •4.3 Очищення газів від оксиду сірки (IV)
- •4.4 Очищення газів від галогенів і їх сполук
- •4.5 Очищення газів від сірководню і сіркоорганічних сполук
- •4.6 Очищення газів від парів ртуті
- •Розділ 5 каталітичне і термічне очищення
- •5.1 Каталітичне очищення газів. Суть методу
- •5.2 Конструкція каталітичних реакторів
- •5.3 Твердофазне каталітичне очищення газів від оксидів азоту
- •5.4 Каталітичне очищення газів від оксиду сірки (IV)
- •5.5 Каталітичне очищення газів від органічних речовин
- •5.6 Каталітичне очищення газів від оксиду вуглецю (іі)
- •5.7 Високотемпературне знешкодження газів
- •Розділ 6 розрахунок обладнання по очищенню газів
- •6.1 Розрахунок пилоосаджувальних камер
- •6.2 Розрахунок циклонів
- •6.3 Вихрові пиловловлювачі
- •6.4 Розрахунок і вибір газових фільтрів
- •6.5 Мокрі скрубери
- •6.6 Швидкісні пиловловлювачі (скрубери Вентурі)
- •6.7 Підбір і розрахунок електрофільтрів
- •6.8 Багатоступінчате очищення від пилу
- •6.9 Розрахунок насадкових абсорберів
- •6.10 Розрахунок тарілчатих абсорберів
- •6.11 Розрахунок адсорберів періодичної дії
- •6.12 Розрахунок каталітичного реактора
- •6.13 Формули для перерахунку основних характеристик газів при різних умовах
- •Література
- •Вязовик в.М., Коржик л.В., Столяренко г.С. Технології очищення газів
- •Вертикаль
- •18002, М. Черкаси, вул. Б. Вишневецького, 2, оф. 6
Розділ 3 абсорбційні методи очищення
Для очищення газів від токсичних домішок і вловлювання цінних компонентів з цих газів використовуються абсорбційні, адсорбційні і каталітичні методи. Найбільше розповсюдження отримали абсорбційні методи очищення.
При проведенні абсорбції в якості абсорбентів використовують воду, різноманітні органічні розчинники, водні розчини цих речовин. При поведені абсорбції, яка передбачає протікання хімічної реакції використовують розчини солей, кислот, лугів, органічні речовини і водні суспензії різноманітних сполук.
До абсорбентів висувається ряд вимог. Вони повинні мати велику сорбційну ємність, високу селективність, невисокий тиск насеної пари, невисоку в’язкість, бути термохімічностійкими, не мати корозійної активності, легко регенеруватися , бути доступними і мати невисоку вартість.
3.1 Очищення газів від оксиду сірки (IV)
Для очищення відхідних газів від оксиду сірки (IV) запропонована велика кількість хемосорбційних методів, проте на практиці знайшли застосування лише деякі з них. Це пов'язано з тим, що об'єми відхідних газів великі, а концентрація в них SО2 мала, до того ж гази характеризуються високою температурою і значним вмістом пилу. Для абсорбції можуть бути використані вода, водні розчини NH3, і суспензії солей лужних і лужноземельних металів.
Абсорбція водою. Абсорбція водою оксиду сірки (IV) супроводжується реакцією:
SO2
+ H2O→
H+
+ HSO![]() . (3.1)
. (3.1)
При абсорбції SО2 водою процес лімітується дифузійним опором з боку газу і рідини. Він може бути проведений в абсорберах різної конструкції.
У зв'язку з низькою розчинністю оксиду сірки (IV) у воді для очищення потрібні велика її витрата і абсорбери з великими об'ємами. Видалення SО2 з розчину ведуть при нагріванні його до 100°С. Таким чином, проведення процесу пов'язане з великими енерговитратами.
У Норвегії розроблений процес "Flakt-Hydro", в якому як поглинач SО2 використовують морську воду, яка має слаболужну реакцію. За рахунок цього розчинність в ній SО2 зростає. Схема такої установки представлена на рис.3.1, а.
Гази спочатку очищають від попелу в електрофільтрах або мультициклонах, а потім охолоджують в скрубері Вентурі водою. Абсорбцію SО2 проводять в порожнистому скрубері, після якого гази нагрівають теплом гарячих топкових газів, частково відібраних після економайзера. Стічні води після скрубера і абсорбера обробляють повітрям для окиснення сульфітних сполук до сульфатних і скидають в море.
Досліджений також процес абсорбції SО2 водою р. Темзи. Вода має лужну реакцію. Для збільшення лужності води до неї додають крейдяний шлам.
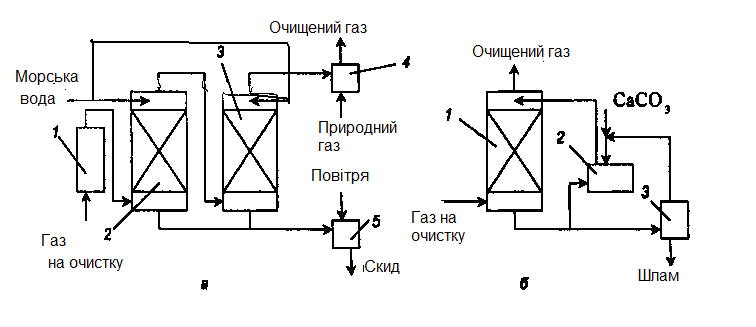
Рисунок 3.1 – Схема установки абсорбції оксиду сірки (IV)
а – морською водою: 1 – електрофільтр; 2, 3 – абсорбери; 4 – підігрівач; 5 – реактор; б – суспензією вапняку: 1- абсорбер; 2 – збірник; 3 – вакуум-фільтр.
Вапнякові і вапняні методи. Перевагою цих методів є проста технологічна схема, низькі експлуатаційні витрати, доступність і дешевизна сорбенту, можливість очищення газу без попереднього охолоджування і знепилювання.
На практиці застосовуються вапняки, крейда, доломіт, мергелі. Середній склад вапняку, в %: SiО2 – 5,19; ТіО2 – 0,06; A12О3 – 0,81; Fe2О3+ FеO – 0,54; MnO – 0,05; СаО – 42,61; MgO – 7,90; K2О – 0,33; Na2О – 0,05; Н2О – 0,76; CО2 – 41,58; P2О5 – 0,04;. S – 0,09; SО3 – 0,05; Cl2 – 0,02. Доломіт CaCО3∙MgCО3 містить, в %: СаО – 30,4; MgO – 21,7; CО2 – 47,9. Мегрель - осадкова гірська порода глинисто-карбонатного складу містить, в %: SiО2 – 8,02-53,32; А12О3 – 1,52-9,92; Fe2О3 – 0,44–3,30; MgO – 0,26-1,95; СаО – 18,18-50,44; SО3 – 0,05–0,75.
Вапно отримують обпаленням карбонатних порід при температурі 1100–1300°С.
Процес абсорбції оксиду сірки (IV) для вапняного і вапнякового методів представляється у вигляді наступних стадій:
SO2 + H2O →H2SO3, (3.2)
CO2 + H2O → H2CO3, (3.3)
CaCO3 + H2SO3 → CaSO3 + H2CO3, (3.4)
CaCO3 + H2CO3 → Ca(HCO3)2, (3.5)
CaSO3 + H2SO3 → Ca(HSO3)2, (3.6)
Ca(HSO3)2 + 2 CaCO3 → Ca(HCO3)2 + 2 CaSO3, (3.7)
Ca(HCO3)2 + 2 H2SO3 → Ca(HSO3)2 + 2 H2CO3, (3.8)
Ca(HSO3)2 + O2 → Ca(HSO4)2, (3.9)
2 CaSO3 + O2 → 2 CaSO4, (3.10)
Ca(HSO4)2 + 2 CaSO3 → Ca(HSO3)2 + 2 CaSO4, (3.11)
Ca(HSO4)2 + 2 CaCO3 → Ca(HCO3)2 + 2 CaSO4, (3.12)
Ca(HSO4)2 + 2 Ca(HSO3)2 → 2CaSO4 + 2 H2SO3, (3.13)
Ca(HSO4)2 + CaCO3 → CaSO3 + 2 H2SO3, (3.14)
CaSO3 + 0,5 H2O → CaSO3·0,5 H2O, (3.15)
CaSO4 + 2 H2O → CaSO4·2 H2O. (3.16)
Протікання тих або інших реакцій залежить від складу і рН суспензії. У присутності в розчині різних домішок процес абсорбції значно ускладнюється. Наприклад, дія невеликих кількостей MgSО4 підвищує ступінь очищення і ступінь використання вапняку. При цьому протікають наступні реакції:
Ca(HSO3)2 + MgSO4 → Mg(HSO3)2 + CaSO4, (3.17)
CaCO3 + Mg(HSO3)2 →MgSO3 + CaSO3 + H2CO3, (3.18)
MgSO3 + SO2 + H2O → Mg(HSO3)2. (3.19)
Нерекупераційні методи. Для приготування суспензії застосовується подрібнений вапняк з розміром частинок 0,1 мм. Склад суспензії Т:Р= 1:10. Запропоновано декілька схем очищення газів. Найбільш проста з утворенням шламу показана на рис. 3.1,б.
Абсорбер зрошується суспензією з рН = 6-6,2. Шлам з абсорбера частково надходить в циркуляційну ємність, куди подається свіжий вапняк, а частково прямує на відділення води в центрифугу або на фільтр. Ступінь очищення досягає 85%. Коефіцієнт використання вапна 50%.
На електростанціях потужністю 1000 МВт щорічно утворюється шламу 780 т/год на 1 МВт. Шлам містить сульфіт кальцію і до 65% води. Сульфіт кальцію дрібнокристалічний, гігроскопічний і здатний поглинати кисень. У нерекупераційних установках шлам захоронюють. Для цього суспензію згущують до вмісту твердої фази 250-300 г/дм3, перекачують насосом по трубах з полімерних матеріалів в накопичувач шламу, потім піддають захороненню.
Одноступінчата схема очищення газу з окисненням сульфіту кальцію показана на рис.3.2, а. Для окиснення в збірник подають повітря. Для завершення процесів кристалізації циркулюючу рідину витримують в збірниках. В результаті шлам представляє суміш CaSО4∙2H2О і CaSO3 ·0,5H2O. Глибше очищення досягається на двоступінчатих установках (рис 3.2, б).
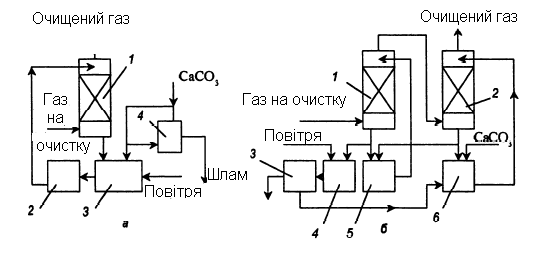
Рисунок 3.2 – Схеми очищення газів від оксидів сірки суспензією вапняку
а – одноступінчата: 1- абсорбер; 2, 3 – збірники; 4 – центрифуга; б – двохступінчата: 1,2 – абсорбери; 3 – центрифуга, 4-6 – збірники.
Перший ступінь зрошується суспензією з рН = 4,5-5, другий – рН = 6. Гіпс відокремлюють на центрифугах або фільтрах. Він може містити CaSO3·0,5H2O. Для переведення сульфіту в сульфат додають сірчану кислоту.
Недоліки вапняних і вапнякових методів наступні: заростання систем відкладеннями гіпсу, корозія і ерозія устаткування, значне бризковинесення з абсорберів, утворення осадів.
Для усунення відкладень CaSО4 передбачають: підвищення відношення рідина/газ з метою зменшення пересичення розчину сульфітом кальцію; рециркуляцію твердого сульфату кальцію з поглинальною рідиною для утворення центрів кристалізації; збільшення тривалості витримки циркулюючої рідини поза абсорбером для завершення процесів кристалізації; підтримка необхідного рН розчину з метою зменшення ступеню окиснення сульфіту кальцію в сульфати пропусканням розчину, який містить кристали CaSО4, через осад сульфіту кальцію для зменшення ступеню насичення розчину гіпсом; додавання іонів С1- до рідини, що підвищує розчинність кальцієвих солей і тим самим зменшує заростання апаратів.
Усунення корозії і ерозії матеріалів устаткування вирішується шляхом вибору відповідних матеріалів і покриттів, наприклад, використання різних сплавів, гумування і так далі. Винесення бризок знижується шляхом використання відповідних бризковловлювачів.
Для підвищення інтенсивності масообміну газ – рідина і зменшення відходів в поглинач додають іони магнію, хлору і карбонових кислот. У присутності цих іонів зростає ступінь використання поглинача, і тим самим скорочується кількість тиксотропних шламів.
Введення іону Mg2+ до складу вапна значно міняє розчинність сульфіту кальцію, що приводить до зростання коефіцієнту масопередачі і дозволяє зменшити відношення рідина/газ в абсорбері та забезпечити ступінь використання вапна 90%. Концентрація магнію в циркулюючій суспензії повинна бути строго визначеною, оскільки надлишок його приводить до утворення важко-фільтрованої рідини гідроксиду магнію Mg(OH)2.
Механізм дії карбонових кислот такий же, як і іонів магнію. Вони є буфером, який знижує рН розчину до 4-5, що приводить до збільшення концентрації SО2 на поверхні розділу фаз.
Вимоги, що висуваються до кислот, які додаються до суспензії вапна: константи їх дисоціації повинні бути в межах 10-4– 10-5; вони повинні бути доступними (випускатися промисловістю) і мати низьку вартість, добре розчинятися у воді, володіти низьким тиском пари (щоб уникнути втрат).
Можуть бути використані бензойна, адіпінова і лимонна кислоти. В результаті хімічних реакцій при додаванні кислот утворюються кальцієві солі, які реагують з сірчистою кислотою. Наприклад, при додавані бензойної кислоти протікають наступні реакції:
CaCO3 + C6H5COOH →Ca(C6H5COO)2 + H2O + CO2, (3.20)
Ca(C6H5COO)2 + H2SO3 → Ca(HCO3)2 + 2 C6H5COOH. (3.21)
Кислота, що звільняється, знову взаємодіє з СаСО3. При цьому збільшується коефіцієнт використання вапняку. Найбільше розповсюджена адіпінова кислота – НООС(СН2)4СООН. Карбонові кислоти додають в кількості 0,1-0,3% від маси вапняку.
Запропонована схема очищення газу від SO2 суспензією вапняку з додаванням карбонової кислоти і сульфату марганцю. Представляє інтерес також процес, в якому в циркулюючий розчин Са(ОН)2 вводять суміш хлориду кальцію і мурашиної кислоти (рис.3.3,б). Діючи як буфер, ці добавки сприяють утворенню бісульфіту кальцію. Вони також підвищують ступінь використання поглинача, зменшують утворення відкладень в абсорбері і покращують якість гіпсу при подальшому окисненні сульфіту. Гіпс виходить у вигляді крупних кристалів, які легко зневоднюються. Додатковою перевагою методу є стійкість поглинального розчину до забруднення хлоридами, що містяться в газі. Технологічна схема очищення (рис. 3.3, б) складається з наступних стадій: абсорбція, окиснення, нейтралізація і фільтрація.
Абсорбцію проводять в прямоточних апаратах-сепараторах. Циркулюючий розчин володіє найбільшою поглинальною здатністю по відношенню до SO2 при рН=4,5-5,0. Витрату повітря приймають в 5 разів більше стехіометричної. У змішувачі суспензію, що містить гіпс, змішують з Са(ОН)2 до необхідного значення рН і направляють у відстійник. Шлам, що містить 10-30% гіпсу, з відстійника поступає на вакуум-фільтр, потім в сушарку. Після сушки гіпс містить 0,5% сульфіту кальцію. Фільтрат з вакуум-фільтра повертають у відстійник, а освітлену рідину з відстійника направляють в абсорбер.
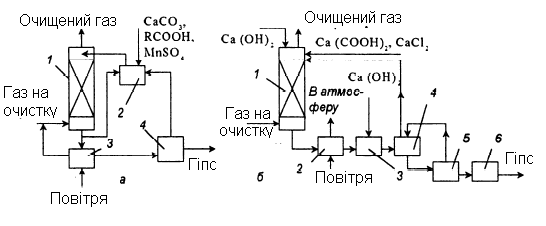
Рисунок 3.3 – Схеми очищення газів від оксиду сірки суспензією вапняка з додаванням добавок
а – карбонової кислоти: 1 – абсорбер; 2 – ємність; 3 – збірник; 4 – центрифуга; б – хлориду кальцію і мурашиної кислоти: 1 – абсорбер; 2 – ємність; 3 – змішувач; 4 – відстійник; 5 – фільтр; 6 – сушарка.
Одним з перспективних і дешевих нерекуперативних методів очищення димових газів від оксиду сірки (IV) є метод, заснований на використанні лужних стічних вод підприємств. При цьому досягається високий ступінь очищення газів і одночасна нейтралізація цих стоків.
Запропонований процес очищення відхідних газів ТЕС від оксиду сірки (IV) лужними стічними водами гідропопеловловлення в абсорбері, обладнаному провальними тарілками, з організованим зливом рідини. Найефективніше процес йде у разі застосування тарілок з подвійною перфорацією і хвилястих тарілок з трикутним профілем хвилі.
Стічна вода гідропопеловидалення мала вільну і карбонат-бікарбонатную лужність (рН= 10,3-11,4) та містила різні домішки. Вільна лужність 21 мг-екв/дм3, а карбонат-бікарбонатна – 147 моль екв/дм3. Початковий вміст SО2 в димових газах змінювався від 0,08 до 0,15% (об.), а СО2 – 5,6-9,7% (об.). Абсорбцію проводили при 46-54°С. У абсорбері з трьома тарілками при співвідношенні між рідиною і газом 3,2 кг/кг ступінь очищення досягав 99%, а рН стічної води змінювався від 11,4 до 7,0.
Методи рекупераційного очищення з регенерацією хемосорбентів. У цих процесах поглинач регенерують і повторно використовують для очищення, а вловлений компонент переробляють в товарні сірковмісні продукти: сірчану кислоту, елементну сірку, зріджений оксид сірки (IV) і сульфати. Методи класифікують за типом хемосорбентів. Розглянемо деякі з них.
Магнезитовий метод. Оксид сірки (IV) в цьому випадку поглинають оксид-гідрооксидом магнію. В процесі хемосорбції утворюються кристалогідрати сульфіту магнію, які сушать, а потім термічно розкладають на газ, що містить SО2 і оксид магнію. Газ переробляють в сірчану кислоту, а оксид магнію повертають на абсорбцію.
В абсорбері протікають наступні реакції:
MgO + H2O →Мg(OH)2, (3.22)
MgSO3 + H2O + SO2 → Mg(HSO3)2, (3.23)
Mg(HSO3)2 + Mg(OH)2 →2 MgSO3 + 2 H2O. (3.24)
Розчинність сульфіту магнію у воді обмежена, надлишок його у вигляді MgSO3·6H20 і MgSО3·3H2О випадає в осад. Технологічна схема процесу представлена на рис. 3.4.
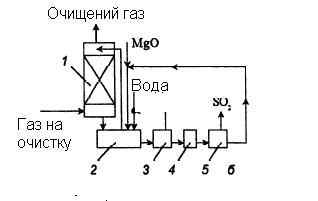
Рисунок 3.4 – Схема очищення газів від оксидів сірки суспензією оксиду магнію
1 – абсорбер; 2 – нейтралізатор; 3 – центрифуга; 4 – сушарка; 5 – піч.
Димові гази поступають в абсорбер Вентурі, який зрошується циркулюючою суспензією. Відношення Т:Р в суспензії 1:10, рН суспензії на вході 6,8-7,5, а на виході з абсорбера 5,5–6. Склад циркулюючої суспензії (у %): MgO – 1,4; MgSО3 – 6,7; MgSО4 – 12,4; вода і домішки – 79,65.
У абсорбері окрім сульфіту утворюється деяка кількість сульфату:
2 MgSO3 + O2 →2 MgSO4. (3.25)
Утворення сульфату небажане, оскільки для його розкладання необхідна вища температура (1200–1300 °С). За таких умов виходить перепалений MgO, який має малу активність по відношенню до SО2. Для усунення утворення сульфату необхідно використовувати інгібітори окиснення або проводити процес в абсорберах при малому часі контакту газ – рідина. Інший шлях-проводити обпалення сульфату у присутності відновників (коксу, метану, оксиду вуглецю і ін.). В цьому випадку сульфат відновлюється в сульфіт.
З нейтралізатора частину суспензії виводять на центрифугу для відділення кристалогідратів солей магнію. Зневоднення солей проводять в сушарках барабанного типу з мазутною топкою. Продукт після сушки містить (у %): MgO – 2,6; MgSО3 – 65,0; MgSО4 – 11,8; Н2О – 20,6. Безводні кристали обпалюють в печах, що обертаються, або печах киплячого шару при 900°С, в піч додають кокс. При цьому йде реакція:
MgSO3 → MgO + SO2. (3.26)
Концентрація SО2 в газі, що виходить з печі, 7–15%. Газ охолоджують, очищають від пилу і сірчанокислотного туману і направляють на переробку в сірчану кислоту.
З печі вивантажується продукт, який містить 86,1% MgO і 3,4% MgSО4. Його охолоджують до 120°С повітрям, що йде на згорання мазуту в топках, після чого відправляють на абсорбцію.
Перевага магнезитового методу: 1) можливість очищати гарячі гази без попереднього охолоджування; 2) отримання в якості продукту рекуперації сірчаної кислоти; 3) доступність і дешевизна хемосорбенту|; висока ефективність очищення.
Недоліки: 1) складність технологічної схеми; 2) неповне розкладання сульфату магнію при обпаленні; 3) значні втрати оксиду магнію при регенерації.
Цинковий метод. Абсорбентом служить суспензія оксиду цинку, при цьому йдуть реакції:
SO2 + ZnO + 2,5 H2O → Zn SO3·2,5 H2O, (3.27)
2 SO2 + ZnO + H2O → Zn(HSO3)2. (3.28)
Сульфіт цинку нерозчинний у воді, його відокремлюють в гідроциклонах, а потім сушать і обпалюють при 350°С. Оксид сірки (IV) , що утворюється, переробляють, а оксид цинку повертають на абсорбцію.
Перевагою методу є можливість проводити процес очищення при високій температурі (200-250 °С). Недолік - утворення сульфату цинку, який економічно не доцільно піддавати регенерації, а необхідно безперервно виводити з системи і додавати в неї еквівалентну кількість оксиду цинку.
Абсорбція хемосорбентами на основі натрію. Перевагою цього методу є використання нелетких хемосорбентів, що володіють великою поглинальною здатністю. Метод може застосовуватися для уловлювання SО2 з газів будь-якої концентрації.
Можливі різні варіанти процесу. При абсорбції розчином соди отримують сульфіт і бісульфіт натрію:
Na2CO3 + SO2 →Na2SO3 + CO2, (3.29)
Na2SO3 + SO2 + H2O →2 NaHSO3. (3.30)
При абсорбції гідроксидом натрію також утворюються сульфіт-бісульфітні розчини. Гази вступають в реакцію з сульфітом і бісульфітом, що веде до збільшення вмісту бісульфіту:
SO2 + NaHSO3 + Na2SO3 + H2O →3 NaHSO3. (3.31)
Розчин, що утворюється, взаємодіє з оксидом цинку:
NaHSO3 + ZnO → ZnSO3 + NaOH. (3.32)
Сульфіт цинку обпалюють:
ZnSO3 → ZnO + SO2. (3.33)
Оксид сірки (IV) переробляють в сірчану кислоту або сірку, а оксид цинку повертають в процес.
Сульфіт-бісульфітний метод. Запропоновані також содово-кислотний і содово-окиснювальний процеси. У обох цих процесах як кінцевий продукт отримують сульфат натрію. Проте основним методом є сульфіт-бісульфітний, або метод "Wollman-Lord", що включає абсорбційне і регенераційне відділення, видалення сульфату і переробку кінцевих продуктів. Вихід сірки в процесі переробки перевищує 90%. Технологічна схема процесу показана на рис. 3.5.
Топковий газ заздалегідь очищають і охолоджують циркулюючою водою в зрошувальній башті. При цьому з газу видаляється попіл, хлориди, частково оксид сірки (IV) і ін. Абсорбцію проводять в колоні, що зрошується циркулюючим розчином сульфіту натрію, який при поглинанні SО2 переходить в бісульфіт. Одночасно протікає реакція утворення сульфату натрію. З огляду на те, що розчинність бісульфіту вища, ніж сульфіту натрію, утворення осаду і забивання абсорбера не відбувається. Розчин, що поступає з абсорбера, регенерують в регенераторі-кристалізаторі з виділенням газоподібного SО2 і кристалів сульфіту натрію. Пари води і SО2 через конденсатор направляють на хімічну переробку, а суспензію сульфіту змішують з водою, виділеною в конденсаторі, і через напірну ємкість подають на зрошування абсорбера. Частину розчину після абсорбції направляють на виділення сульфату натрію. Осадження сульфату натрію проводять при охолоджуванні розчину, потім його відокремлюють в центрифугах і сушать. Рідину повертають в цикл. Втрати іону Na+, пов'язані з виведенням сульфату, компенсують додаванням каустичної соди. Оксид сірки (IV) , що виділився при регенерації, переробляють в сірчану кислоту чи сірку.
Для отримання сірки в камерах спалювання проводять процес взаємодії SО2 із стехіометричною кількістю відновника (Н2, С, СН4 й т.п.). В ході реакції утворюється суміш, що містить пари сірки, H2S, SО2. Ця суміш поступає в казан-утилізатор, де тепло реакції використовують для вироблення пари; далі проводять процес Клауса – двоступінчата каталітична конверсія при 300°С з проміжним охолоджуванням і конденсацією парів сірки. Залишкову кількість H2S каталітично спалюють в печі з утворенням SО2. Ці гази змішують з газами, що поступають на очищення.
Подвійний лужний метод. Суть його полягає у використанні при абсорбції SО2 розчинів солей натрію, калію або амонію з подальшою регенерацією відпрацьованих абсорбентів оксидом або карбонатом кальцію. Як продукти рекуперації отримують гіпс, сульфіт кальцію або їх суміш. Регенерований абсорбент повертається в цикл абсорбції, а солі кальцію видаляють з системи.
Регенерація абсорбенту відбувається за наступними реакціями:
CaO+ H2O →Ca(OH)2, (3.34)
Na2SO3 + Ca(OH)2 →2NaOH + CaSO3, (3.35)
Na2SO3 + Ca(OH)2 →2 NaOH + CaSO4. (3.36)
Остання реакція протікає повільно. При збільшенні концентрації SО2 і СО2 в газі процес зрушується у бік утворення CaSО4. Використання карбонових кислот збільшує розчинність солей кальцію. Перевагою методу є висока ефективність процесу і відсутність твердої фази компонентів в абсорбері, що полегшує безперервне функціонування установки. Ще важливіша відсутність солей кальцію на стадії поглинання оксиду сірки (IV), що повністю виключає забивання апаратури. Якщо регенерацію адсорбенту вести оксидом кальцію при рН=8, забивання апаратури не відбувається. Крім того, капітальні і експлуатаційні витрати на очищення подвійним лужним методом на 15-55% менше, ніж вапняним або вапняковим методами.
Аміачні методи. У цих методах поглинання оксиду сірки (IV) проводиться аміачною водою або водними розчинами сульфіт-бісульфіту амонію з подальшим його виділенням. Перевагою методу є висока ефективність процесу, доступність сорбенту і отримання необхідних продуктів (сульфіт і бісульфіт амонію). Хімічні реакції процесу:
NH4OH + H2SO3 →(NH4)2SO3 + 2 H2O, (3.37)
(NH4)2SO3 + H2SO3→2 NH4HSO3, (3.38)
(NH4)2SO3 + O2→ 2(NH4)2SO4. (3.39)
Є циклічні і нециклічні методи. У аміачно-нециклічному методі бісульфіт амонію випускають як товарний продукт. У циклічному методі отримують концентрований оксид сірки (IV). Схема аміачно-циклічного методу показана на рис. 3.5,б.
Заздалегідь очищений газ охолоджують водою в колоні, а потім подають на двоступінчату абсорбцію. Другий ступінь необхідний для тоншого очищення. На 1 ступені циркулюючий розчин має концентрацію NH3 8–10 моль на 100 моль води, а на 2 ступені - 1–2 моль/100 моль. При абсорбції отримують розчин, в якому відношення концентрації SО2 в сульфіті і бісульфіті до концентрації аміаку 0,78–0,82.
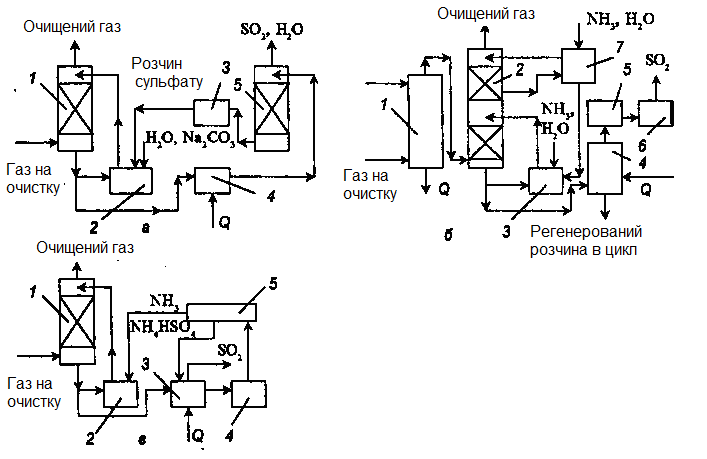
Рисунок 3.5 – Схеми установок очищення від оксиду сірки
а – сульфіт-бісульфітний метод: 1- абсорбер; 2, 3 – ємності; 4 – регенератор; 5 – відпарна колона.
б – аміачно-циклічний метод: 1 – колона; 2 – абсорбер; 3,7 – ємності; 4 – відпарна колона; 5 – конденсатор; 6 – осушувач;
в – аміачно-бісульфітний метод: 1 – абсорбер; 2 – ємність; 3 – відпарна колона; 4 – вузол випарювання; 5 – сушарка.
Абсорбент регенерують у відпарній колоні парою при 90°С, залишковий тиск складає 665-735 кПа. В результаті розкладання бісульфату амонію і (частково) інших солей оксид сірки (IV), що виділяється з розчину, осушується і його використовують як товарний продукт (після конденсації парів води і абсорбції аміаку) або переробляють в сірку чи сірчану кислоту. Регенерований у відпарній колоні розчин охолоджують і повертають в цикл зрошування.
Для виділення з розчину сульфату амонію частину регенерованого розчину випаровують, а потім кристалізують і зневоднюють на центрифузі (ця стадія на схемі не вказана). Готовий продукт має склад (у %): (NH4)2SО4 – 90-93, (NH4)2SО3 – 2-3: NH4HSО3 – 0,5-1 і H2О – 4-5. При підвищених температурах йде реакція:
NH4HSO3 + (NH4)2SO3→(NH4)2SO4 + S + H2O. (3.40)
При цьому утворюється колоїдна сірка, яку важко видалити з розчину.
Недоліки методу: великі витрати на відгонку SО2, великі капітальні і експлуатаційні витрати, можливість очищення газів, що містять більше 0,3-0,35% (об.) SО2.
Є схеми без попереднього охолоджування газу, за якими для перетворення сульфіту амонію на сульфат в реактор додають сірчану кислоту:
(NH4)2SO3 + H2SO4→(NH4)2SO4 + Н2SO3. (3.41)
У Франції розроблений аміачно-бісульфітний процес (рис. 3.5, в), який дозволяє очищати гази будь-якого складу. У даному процесі сульфат амонію розкладають при 300°С. NH3 і бісульфат амонію, що виділяються, повертаються в процес:
(NH4)2SO4 →NH4HSO4 + NH3. (3.42)
Недолік методу – велика енергоємність. Запропонований процес, за яким у відхідний газ, що містить SО2, додають газоподібний аміак. Безпосередньо у трубі утворюється аерозоль сульфіту і сульфату, який уловлюють в електрофільтрах.
Розроблений аміачно-азотнокислотний метод очищення відхідних газів від оксиду сірки (IV) сульфіт-бісульфітним розчином з подальшим розкладанням отриманих розчинів азотною кислотою:
(NH4)2SO3 + 2 HNO3→2 NH4NO3 + SO2 + H2O, (3.43)
NH4HSO3 + HNO3→NH4NO3 + SO2 + H2O. (3.44)
В результаті виходить газ, що містить 15–30% SО2. Його переробляють в сірчану кислоту, і нітрат амонію, який використовується як добриво. На 1 т утилізованого оксиду сірки (IV) можна отримати 1,3 т сірчаної кислоти, 3 т рідких азотних добрив і близько 0,2 т сульфату амонію з домішкою нітрату амонію.
Можливий аміачно-фосфорнокислотний спосіб очищення, при якому утворюються фосфорні добрива і оксид сірки (IV) :
3 (NH4)2SO3 + 2H3PO4→2 (NH4)3PO4 + 3 SO2 + H2O, (3.45)
NH4HSO3 + H3PO4→(NH4)3PO4 + 3 SO2 + 3 H2O. (3.46)
Абсорбція розплавленими солями. Для очищення газів при високій температурі використовується евтектична суміш карбонатів лужних металів складу (у %): Li2CO3 – 32; Na2CО3 – 33; K2CО3 – 35. Точка плавлення суміші 397°С. При 425°С суміш має в'язкість 0,012 Па·с і густину 2000 кг/м3. При вмісті SО2 в газі від 0,3 до 3% суміш абсорбує 99% SО2.
Процес складається із стадій абсорбції, відновлення і регенерації абсорбенту. Абсорбція SО2 проводиться карбонатами з утворенням сульфітів і сульфатів металів. Швидкості реакцій дуже великі, тому процес лімітується швидкістю перенесення оксиду сірки (IV). Абсорбцію проводять в зрошувальному скрубері при швидкості газу 7,5 м/с. Реакції, що проходять в скрубері, екзотермічні, це дозволяє частково компенсувати втрату тепла.
На стадії відновлення використовують генераторний газ. Процес проводять при 600°С. Відбувається відновлення сульфатів до сульфідів металів:
4Me2SO3 →3 Me2SO4 + Me2S, (3.47)
Me2SO4 + 4 H2 → Me2S + 4 H2O, (3.48)
Me2SO4 + 4 CO → Me2S + 4 CO2. (3.49)
Реакції відновлення протікають повільно. На стадії регенерації сульфіди реагують із сумішшю СО2 і води при 425°С:
Me2S + CO2 + H2O → Me2CO3 + Н2S. (3.50)
Реакція протікає швидко. Отриманий розплав солей знову повертають в процес. Газ, що виходить з реактора регенерації, містить 30% H2S, оксид вуглецю і воду. Його направляють на установку, що працює за методом Клауса, для отримання сірки.
Форміат калію можна застосовувати як абсорбент у вигляді розплаву при 177°С або у вигляді водного розчину при 93°С. Послідовність реакцій, що протікають в процесі очищення: абсорбція (у водному розчині)
2 HCOOK + 2 SO2 →K2S2O3 + 2 CO2 + H2O, (3.51)
регенерація:
4 HCOOK + K2S2O3 → 2 K2CO3 + 2 KHS + 2 CO2 + H2O, (3.52)
2 KHS + CO2 →K2CO3 + 2 Н2S, (3.53)
K2CO3 + 2 CO → 2 HCOOK + CO2+ H2O. (3.54)
Сірководень рекуперується у вигляді сірки.
Абсорбція ароматичними амінами. Для абсорбції SО2 з відхідних газів кольорової металургії (концентрація SО2 в газі 1-2% (об.)) застосовують розчини ксилідину або диметиланіліну. У одному з розроблених процесів абсорбентом є суміш (1:1) ксилідину і води. Ксилідин і вода зазвичай не змішуються, але при взаємодії SО2 з ксилідином утворюється деяка кількість ксилідинсульфату розчинного у воді:
2 С6H3(CH3)2NH2 + SO2 →2C6H3(CH3)2NH2· SO2. (3.55)
При концентрації SО2 100 кг/м3 суміш стає гомогенною. Схема очищення газу від SО2 сумішшю ксилідин – вода наведена на рис. 3.6. Після видалення пилу газ із вмістом 0,5–8% SO2 абсорбується в двох абсорберах. Концентрація SO2 після абсорбції знижується до 0,05–0,1%. Пари ксилідину, що виносяться з абсорберів, рекуперують розбавленою сірчаною кислотою (5–10%) в промивній колоні. Після цього газ викидають в атмосферу. Насичений абсорбент із вмістом 130–180 г/дм3 SО2 і доданим розчином соди насосами подають у відпарну колону, де нагрівають глухим паром до 100°С. Десорбований SО2 промивають водою і направляють на подальшу переробку.
Для концентрації SО2 у відхідних газах вище 3,5% (об.) диметиланілін є ефективнішим абсорбентом, ніж суміш ксилідин – вода. Технологічна схема процесу аналогічна описаній (рис. 3.6).
Спочатку газ очищають від твердих домішок в електрофільтрах. Після абсорбції промивають розчином карбонату натрію для видалення слідів SО2, а потім розбавленою сірчаною кислотою, яка абсорбує сліди диметиланіліну. Видалення SО2 проводять у відпарній колоні. Після осушення SО2 переробляють в сірчану кислоту. Абсорбери і відпарна колона забезпечені ковпачковими тарілками.
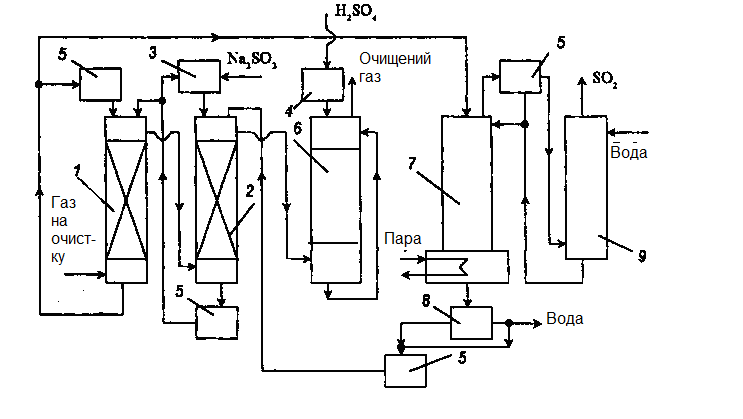
Рисунок 3.6 – Схема установки очищення газів від SO2 сумішшю ксилідин – вода
1, 2 – абсорбери; 3,4 – ємності; 5 – холодильник; 6 – промивна колона; 7 – відпарна колона; 8 – сепаратор; 9 – колона для промивки SO2.
На 1 кг виділеного в цьому процесі оксиду сірки (IV) витрачається 0,5 кг диметиланіліну, 16 г соди, 18 г сірчаної кислоти, а також 1,1 кг пари, 0,52 МДж енергії і 8,2 кг/год води для охолодження.
Для проведення процесів абсорбції оксиду сірки (IV) використовують різні за конструкцією абсорбери. Вони повинні задовольняти наступним вимогам: мати високу ефективність і пропускну спроможність за газом, низький гідравлічний опір (до 3 кПа), бути простими за конструкцією і зручними в експлуатації, відрізнятися низькою металоємністю, не забиватися осадами, що утворюються в процесі абсорбції. На практиці більше всього використовуються порожнисті абсорбери з форсунками і скрубери Вентурі, одноступінчаті і двоступінчаті. Вдосконалення їх конструкцій йде шляхом створення апаратів зіз мінімальною внутрішньою поверхнею.
