
- •060108 «Фармация», 2 курс, III семестр
- •Организация занятия 15 мин
- •1.1.Гидролиз.
- •1.2. Разновидности гидролиза
- •1.3. Константа гидролиза
- •1.4. Степень гидролиза. РН гидролиза
- •1.5. Буферные растворы.
- •РН буферных растворов вычисляют по формулам:
- •1.6. Аналитические реакции катионов II группы.
- •1.6.1. Общая характеристика группы.
- •Все растворимые в воде соединения свинца , ртути и серебра ядовиты!
- •1.6.2. Значение катионов второй группы и их соединений в медицине.
- •2.1. Химическое равновесие в гетерогенной системе.
- •2.2. Аналитические реакции катионов III группы.
- •2.2.1. Общая характеристика катионов III группы.
- •2.2.2. Значение катионов третьей группы и их соединений в медицине.
- •2.3. Анализ смеси катионов III аналитической группы.
- •3.1. Анализ смеси катионов I, II и III аналитических групп.
- •Анализ раствора без осадка.
- •Систематический анализ раствора без осадка
- •Анализ раствора с осадком
- •Систематический анализ осадка
- •Вопросы для самоподготовки
- •Вопросы для самоконтроля
- •Основная литература
1.2. Разновидности гидролиза
Гидролиз по катиону протекает для солей, образованных катионом слабого основания и анионом сильной кислоты (NН4NО3, NH4Сl, СuСl2 и т.д.)
NH4+ +НОН NH4ОН +Н+ , pH<7
Гидролиз по аниону протекает для солей, образованных катионом сильного основания и анионом слабой кислоты (КСN, СНзСОONа, НСООNа и т.д.)
СN- + НОН НСN + ОН- , pH>7
Гидролиз по катиону и аниону (совместный) протекает для солей, образованных катионом слабого основания и анионом слабой кислоты (СН3СООNH4, NН4СN и т.д.). рН таких растворов зависит от Кдис. кислоты и основания, образующих гидролизующуюся соль.
NH4+
+ СN- + НОН
NH4ОН + НСN,
среда щелочная, так как
![]()
NH4+
+ СН3СОО- + НОН
NН4ОН + СН3СООН
, среда почти нейтральная, так как
![]()
Гидролиз по катиону ступенчатый характерен для солей, образованных катионами слабых многокислотных оснований и анионами сильных кислот (СuСl2. FеСl3 и т.д.).
Сu2+ + НОН СuОН+ + Н+; (I ступень), pH<7
СuОН++ НОН Сu(ОН)2 + Н+; (II ступень), pH<7
Гидролиз по аниону ступенчатый характерен для солей, образованных катионами сильных оснований и анионами слабых многоосновных кислот (Nа2S, К2СО3, Nа3РО4 и т.д.).
РО43-+ НОН НРО42- + ОН-; (I ступень), pH>7
НРО42- + НОН Н2РО4- + ОН-; (II ступень), pH>7
Н2РО4- + НОН Н3РО4 + ОН-; (III ступень), pH>7
Существенно иной характер гидролиза ковалентных соединений. Большинство из них в воде на ионы практически не распадается (не ионизирует), а непосредственно претерпевают необратимое гидролитическое разложение:
SiСl4 + ЗНОН Н2SiO3 + 4НСl;
Р2S5 +8НОН 2Н3РО4 + 5Н2S
Приведенная схема уравнений является условной. В действительности гидролиз в таких случаях протекает через сложные процессы комплексообразования, катионной и анионной полимеризации и его механизм во многих случаях не изучен или изучен недостаточно. Гидролиз может сопровождаться также окислительно-восстановительными процессами; для многозарядных ионов он к тому же протекает ступенчато.
1.3. Константа гидролиза
Количественно процесс гидролиза характеризуется двумя величинами - константой гидролиза (Кгидр.) и степенью гидролиза (h).
Кгидролиза - это константа равновесия гидролитической реакции при условии, что [Н2О] является величиной постоянной.
По существу, это константа диссоциации гидратированного иона. Многие реакции гидролиза обратимы. Равновесие при обратимом гидролизе подчиняется закону действия масс.
Ионные уравнения гидролиза в упрощенном виде (с учетом гидратации протона и гидроксид-иона):
NH4+ +2H2O NH4OH + H3O+
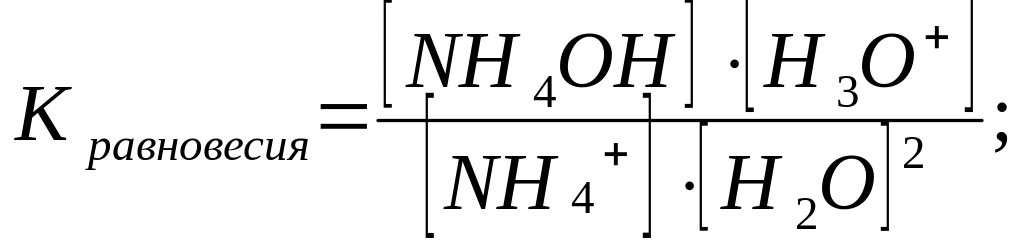

Для расчета константы гидролиза умножим числитель и знаменатель на [ОН-], тогда получим
 так как
так как
![]()
![]()
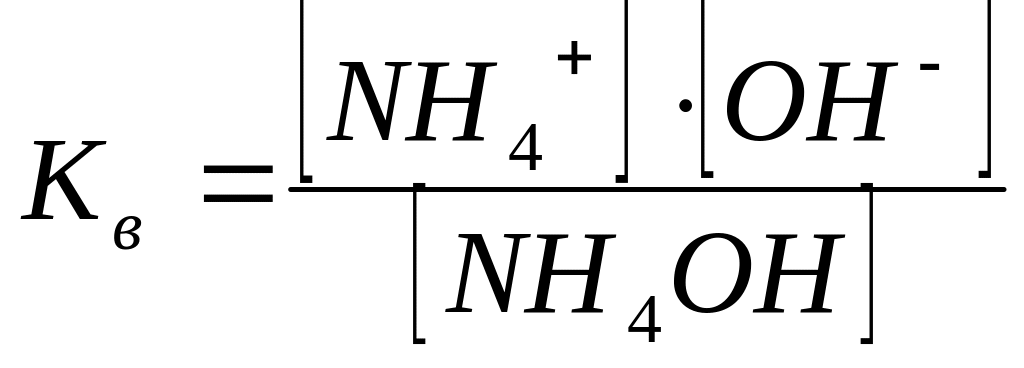
В общем случае для любой соли, образованной слабым основанием и сильной кислотой, константа гидролиза равна
![]() ,
,
где: Кв - константа основности слабого основания. Для соли, образованной слабой кислотой и сильным основанием:
![]() ,
,
где Ка – константа кислотности слабой кислоты. Для соли, образованной слабой кислотой и слабым основанием:
![]() .
.
