
Комплект учебно-методических материалов
к
Учебно-методическому комплексу
(фармацевтическая химия)
Тема: Методы
количественного определения лекарственных
средств
.
Утверждены
на методическом
совещании кафедры
от
17 ноября 2008г.
Протокол №18
Составитель:
ассистент кафедры, к.б.н Л.Н. Сонина.
Рецензент: к.ф.н.,
доцент В.И. Лебедев-Косов
Рецензент: зав.
каф. фарм. технологии и токсикологической
химии с курсом ФПК и ППС к.ф.н., доцент
С.В. Степанов
Владивосток 2009
Тема:
Методы количественного определения
лекарственных средств.
Время:
4 часа
Учебная цель:
знать сущность титриметрических
методов анализа, его основные понятия.;
мерную посуду, правила работы с ней;
способы выражения концентраций и
взаимосвязь между ними;
титрованные растворы титрантов (
стандартные и стандартизированные),
стандартные (исходные) вещества.
изучить особенности экспресс-анализа
при внутриаптечном контроле качества
лекарственных веществ
План занятия:
Вводная часть. Пояснение преподавателя
по теме. (10 минут)
Входной контроль (15 минут)
Выполнение практической работы с
помощью преподавателя (120 минут)
Решение индивидуальных ситуационных
задач (20 минут)
Оформление протокола. Подведение
итогов занятия (15 минут)
Требования к
исходному уровню знаний
Применение основных положений теории
растворов, учения о химическом
равновесии, химической кинетике,
катализе, адсорбции в аналитической
химии.
Использование современных физических
и физико-химических методов анализа
в качественном анализе.
Основы гравиметрии, титриметрии,
инструментальных (физических и
физико- химических)
методов количественного анализа.
Задание для самоподготовки:
Ответ по отдельным методам количественного
определения строить по схеме:
Название
Физические, физико-химические и
химические основы проведения.
Оборудование для проведения испытания
Методика проведения испытания
Результаты проведения испытания
Самоподготовка
Задание №1 Изучите
рекомендуемую литературу и ответьте
на вопросы:
Титриметрический анализ. Основные
понятия (аликвота, титрант, титрование,
точка эквивалентности (ТЭ), конечная
точка титрования (КТТ), индикатор,
кривые итрования, степень
оттитрованности).
Требования к реакциям, используемым
в титриметрии.
Классификация методов титриметрического
анализа.
Посуда, применяемая в титриметрическом
анализе для измерения точных объемов:
мерные колбы, пипетки, бюретки,
правила работы с ними; посуда для
измерения вспомогательных растворов:
мензурка, цилиндры, мерные стаканы.
Способы выражения концентраций в
титриметрическом анализе. Типовые
расчеты в титриметрическом анализе.
Виды (приемы) титрования. Способы
определения: метод отдельных навесок
и метод пипетирования.
Способы определения КТТ: визуальный
(индикаторный, безиндикаторный),
инструментальный.
Форма отчетности по СДС—оформление
протокола Практическая работа.
Объекты исследования:
Кальция хлорид Раствор натрия хлорида
Титриметрический или объемный анализ
- метод количественного анализа,
основанный на измерении объема (или
массы) реагента Т, затраченного на
реакцию с определяемым веществом X.
В зависимости от типа химической
реакции, лежащей в основе титрования
различают следующие методы титриметрического
анализа:
Кислотно-основной метод, в основе
которого лежит реакция передачи
протонов.
Окислительно-восстановительные методы
(редоксиметрия) -основаны на реакциях
окисления-восстановления.
Осадителъное титрование — основано
на реакциях осаждения.
Комтексиметрия - основана на реакциях
комплексообразования.
В титриметрическом анализе могут быть
использованы только те реакции, которые
удовлетворяют определенным требованиям:
-реакция должна протекать необратимо;
-реакция должна протекать с достаточно
большой скоростью;
-возможность фиксирования точки
эквивалентности.
В титриметрическом анализе количественное
определение вещества производится,
исходя из объема раствора реактива
известной концентрации, затраченного
на реакцию с исследуемым веществом.
Прибавление раствора определенной
концентрации к анализируемому, называется
титрованием.
Момент, когда титрант будет прибавлен
в количестве, эквивалентном количеству
исследуемого вещества, называют моментом
эквивалентности, или точкой эквивалентности.
В этот момент титрование, как правило,
заканчивается. Момент окончания реакции
определяется различными способами.
Раствор, с помощью которого производится
титриметрическое определение, называтся
титрантом (иногда, при ,так называемом,
реверсивном титровании в качестве
титранта берут раствор неизвестной
концентрации и титруют им раствор с
точно известной концентрацией).
Способы выражения концентрации
растворов.
Молярная концентрация определяется
количеством молей вещества в 1 л (или 1
дм ) раствора (измеряется в моль/л,
моль/дм3). Молярной концентрацией
раствора См называют отношение количества
растворенного вещества N в молях к
объему раствора:
Молярная концентрация эквивалента
(нормальная концентрация) определяется
количеством эквивалентов вещества,
растворенного в 1дм раствора (измеряется
в моль/л, моль/дм3).
Эквивалент - это реальная или
условная частица, которая эквивалентна
одному иону водорода в кислотно-основной
реакции, одному электрону в реакции
окисления-восстановления или одному
однозарядному иону в реакциях осаждения
и комплексообра-зования.
Молярная масса эквивалента Мэ; -
это масса одного моля эквивалента этого
вещества, равная произведению молярной
массы Мг вещества на фактор эквивалентности/
M3=Mr-f
Фактор эквивалентности - это число,
обозначающее, какая доля реальной
частицы вещества эквивалентна одному
иону водорода в кислотно-основной
реакции, одному электрону в реакции
окисления-восстановления или одному
однозарядному иону в реакциях
осаждения и комплексообразования.
Термины "эквивалент" и "фактор
эквивалентности" всегда связаны с
конкретной реакцией и могут быть разными
для одного и того же вещества в разных
реакциях. Так, например, фактор
эквивалентности Na2 SO4 в
реакции:
Na2SO4 +HCI=NaHSO4+NaCI
равен 1=Т, тогда как фактор эквивалентности
того же самого вещества Na2SO4
в реакции
Na2SO4 +HCI=H2SO4+NaCI
равен=1/2.
Титр раствора (Т)- это масса
растворенного вещества в граммах,
содержащегося в 1 мл (или 1 см3)
раствора, измеряется в г/мл или в г/см3.
Титр раствора(А) по определяемому
веществу (В) - - показывает какая масса
вещества В взаимодействует (или
эквивалентна) с 1см3 (мл) титранта.
Этот способ выражения концентрации
удобен при массовых анализах.
Способы титрования.
Различают следующие способы титрования:
Способ пипетирования. Каждую порцию
для титрования отбирают пипеткой (Vj) ,
переносят в колбу для титрования и
титруют рабочим раствором из бюретки
( Vi) .
Ni-Vi=N2-V2
Способ отдельных навесок.
Навеску вещества (В), взвешенную на
аналитических весах, количественно
переносят в колбу для титрования,
растворяют в произвольном объёме воды
и титруют рабочим раствором (Т) из
бюретки.
Методы титрования
Прямое титрование. Определяемое вещество
X непосредственно титруют рабочим
раствором (Т).
Обратное титрование. Этот метод применяют
в том случае, когда реакция протекаетмедленно
или не удается подобрать индикатор.
Для проведения этого титрования
необходимо иметь два титрованных
рабочих раствора А и В. Схема определения
анализируемого вещества X такова: к
раствору X приливают точно измеренный
избыточный объём титрованного раствора
А, вещество X реагирует с веществом А,
затем остаток вещества А оттитровывают
другим рабочим раствором В.
Зная общий объём раствора А и количество
не прореагировавшего вещества А, находят
объём титрованного раствора А,
израсходованного на взаимодействие с
определяемым веществом X.
Косвенное или титрование заместителя.
Этот способ применяют в тех случаях,
когда определяемое вещество непосредственно
не реагирует с рабочим раствором
титранта А,либо реакция между ними
нестехиометрична. При этом раствор
определяемого вещества X обрабатывают
раствором В и один из продуктов
взаимодействия (С) оттитровывают рабочим
раствором титранта А.
Безусловно, прямое титрование является
самым удобным способом. Однако часто
по тем или иным причинам (отсутствие
подходящего индикатора, медленная
скорость реакции и др.) приходится
применять другие способы титрования
или их комбинацию.
Задание №1. Провести
фармакопейный анализ лекарственных
средств.
Кальция хлорид
Раствор натрия хлорида 0,9%
Контрольные вопросы.
Какие признаки положены в основу
классификации титриметрических
методов?
Что такое титрование, скачок титрования,
точка эквивалентности и конечная точка
титрования?
В чем сущность прямого, обратного
титрования и титрования заместителя?
В чем сущность метода пипетирования
и метода отдельных навесок?
Что такое титр и титр по определяемому
веществу?
Укажите способы выражения концентраций
растворов и взаимосвязь между ними.
Дайте определения химического
эквивалента и фактора эквивалентности
вещества?
Дайте определение молярной массы
вещества и молярной массы эквивалента
вещества.
Наровите основные особенности
экспресс-анализа
Список литературы.
Фармацевтическая химия: Учебник для
ВУЗов/Под ред. Беликова В.Г.–
Пятигорск,2003.-720с.
Фармацевтическая химия: Учебное пособие
/ Под ред. А.П.Арзамасцева. – М.: ГЭОТАР-МЕД,
2004. – 250 с.
Государственная фармакопея СССР. –
Х изд.
Государственная фармакопея СССР. –
ХI изд.
Государственная фармакопея СССР. –
ХII изд.
Руководство к лабораторным занятиям
по фармацевтической химии: Учебное
пособие / Под ред. А.П.Арзамасцева. М.:
Медицина, 1995.
12Методические указания к практическому занятию №4 для студентов 3 курс, 5 семестр
060108 «Фармация»
1. Титриметрические методы анализа.
![]()
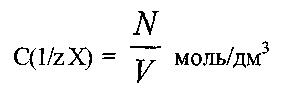
2
11
3
10
4
9
5
8
6
7
Государственное образовательное учреждение
высшего профессионального образования
«Владивостокский государственный медицинский университет
Министерства здравоохранения и социального развития»
Кафедра фармацевтической химии и фармакогнозии с курсом ФПК и ППС
Комплект учебно-методических материалов к учебно-методическому комплексу: «Аналитическая химия»
Для специальности: 060108 «Фармация»,
Курс 2
Cеместр III
