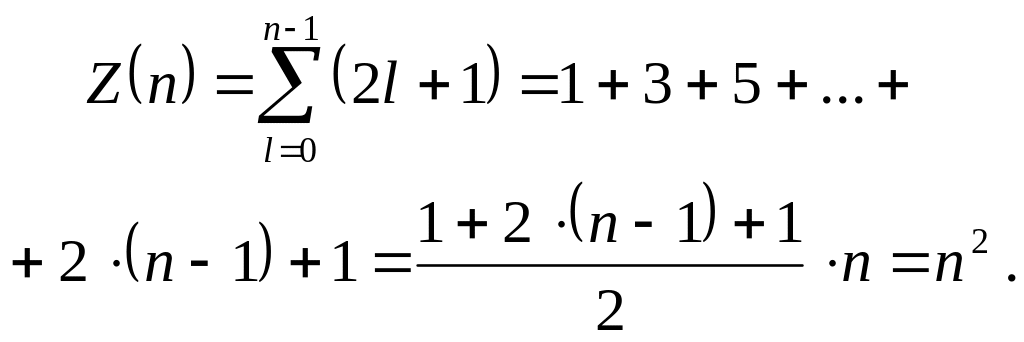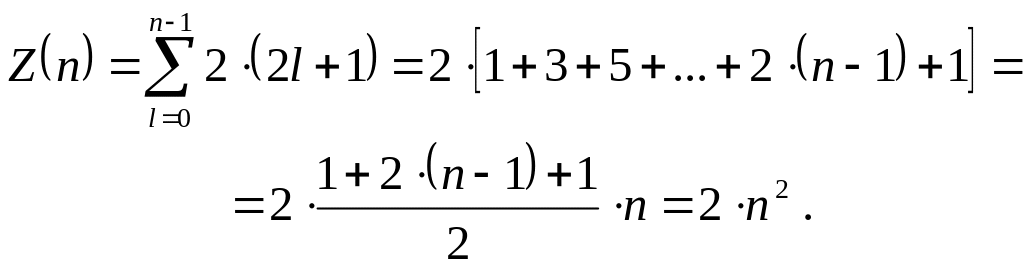- •Передмова
- •Мета і завдання дисципліни, її місце у навчальному процесі
- •Загальні вказівки до вивчення дисципліни
- •Вказівки до самостійної роботи
- •Вказівки щодо розв'язування задач
- •Вимоги до оформлення контрольних робіт
- •Спектральні закономірності водню
- •Модель воднеподібного атома по Бору
- •Потенціали збудження та іонізації
- •Хвильові властивості речовини
- •Рівняння Шредінгера
- •Атом водню у квантовій механіці
- •Хвилі де Бройля
- •Співвідношення невизначеностей
- •Квантування орбітального моменту імпульсу електрона
- •Квантування орбітального магнітного моменту електрона
- •Спін електрона. Заповнення електронних оболонок і шарів.
- •Частинка у потенціальній ямі
- •Закономірності радіоактивних процесів
- •Поняття про ядерні реакції
- •Тинок,вони перетворювались на ядра ізотопу фосфору із викидом нейтронів:
- •Будова ядра
- •Дефект маси і енергія звязку ядра
- •Явище радіоактивного розпаду
- •Ядерні реакції
- •Енергетичний вихід ядерних реакцій
- •Рекомендована література
- •Тестові завдання з розділу “ядерна фізика”.........................................49 Будова ядра............................................………………………………………...49
- •Енергетичний вихід ядерних реакцій................................................................66
Атом водню у квантовій механіці
У квантовій механіці задача про атом водню (крім його простої структури) є однією із основних ще і тому, що задача про рух електрона у полі центральних сил може бути поширена і на воднеподібні системи, які складаються з ядра із зарядом Ze і одного електрону (наприклад, іони Не+, Li2+ та інші). Потенціальна енергія взаємодії електрона із ядром воднеподібного атома має вигляд:
|
де r – відстань від електрона до ядра атома, Z – порядковий номер елемента в таблиці Менделєєва. Відповідно, стаціонарне рівняння Шредінгера для тривимірного руху електрона на- |
вколо ядра воднеподібного атома має вигляд:
|
Оскільки електричне поле воднеподібного атома має сферичну симетрією, вирішувати таке рівняння поцільно у сферичних координатах (r,,) методом роз- |
ділення змінних. Це досить складна задача, але якісні її результати такі.
Таке рівняння має кінцеві, однозначні і безперервні рішення не завжди, а лише при певних значеннях параметрів, які входять у нього. Одним із цих параметрів є повна енергія електрона Е. Рух електрона у атомі, що задовольняє цьому рівнянню, може відбуватись тільки при певних (дискретних) негативних значен-
|
нях енергії: Це - власні значення енергії електрона в атомі, які відповідають власним хвильовим функціям n, одержаним із рі- |
шення рівняння. Тут n=1,2,3,…- головне квантове число. Рівень енергії Е1, відповідний мінімальному значенню енергії (n=1), називають основним, а всі інші Еn (n=2,3,4,…) – збудженими. Якщо енергія електрона Е0, його рух називається зв'язаним, оскільки він знаходиться усередині гіперболічної потенціальної ями. При зростанні n, збуджені енергетичні рівні розташовуються щільніше. Коли повна енергія електрона Е стає позитивною (тобто, його кінетична енергія перевищує потенціальну енергію тяжіння до ядра), то електрон стає вільним, а його енергетичний спектр стає суцільним – енергія електрона може набувати довільних значень.
2) Із рівняння Шредінгера виходить, що кожен стаціонарний стан електрона в атомі характеризується трьома квантовими числами: n – головним, l – орбітальним, m – магнітним. Ці квантові числа визначаються властивостями хвильових функцій – їх неперервністю, однозначністю і скінченністю у всьому об'ємі. Орбітальне квантове число l визначає модуль орбітального моменту імпульсу елект-
|
рона, який може набувати лише дискретних значень, тобто квантується згідно із формулою: При певному значенні n орбітальне квантове число l може на- |
бувати значень 0, 1, 2,…, (n-1) (тобто, всього n-значень). Магнітне квантове число m визначає проекції орбітального моменту імпульсу на деякий довільно вибраний напрямок зовнішнього магнітного поля, які також можуть набувати лише дискретних значень, тобто квантуються згідно формулі: Lz=ħm. При певному значенні l, магнітне квантове число може набувати значення m=0, 1, 2,…, l, (всього (2l+1) - значення). Орбітальним гіромагнітним відношенням електрона називають відношення магнітного моменту електрона pm до його механічного моменту імпульсу L. Підставивши відповідні значення, для орбітального руху елект-
|
рона одержимо: де е – заряд електрона, m0 – його маса. Підставивши значення L, отримаємо ви- |
раз длявизначення дозволених значень орбітального магнітного моменту:
|
де величину eћ/2m0 називають магнетоном Бора і позначають μВ. Отже, магнітні моменти електрона при його орбітальному |
русі навколо ядра також набувають дискретних значень. Для проекції орбітального магнітного моменту електрона на напрямок зовнішнього магнітного поля має-
|
мо: де m – магнітне квантове число, яке може набувати позитивних і негативних значень. |
Таким чином, рух електрона в атомі є «строго регламентованим». Енергія електрона залежить від головного квантового числа, що визначає розміри орбіти, орбітального квантового числа, що визначає форму орбіти, і магнітного квантового числа, що визначає її орієнтацію у просторі. Кожному власному значенню енергії Еn (окрім Е1) відповідає декілька власних хвильових функцій nlm, відмінних значеннями l і m. Тому атом може мати одне і те ж значення енергії, знаходячись при цьому у різних станах, званих виродженими. Кількість станів із однаковою енергією, або кратність виродження енергетичних рівнів може бути
|
визначена формулою: Вірогідність виявлення електрона в різних частинах атома різна. Електрон при своєму русі неначе «розмазаний» по всьому об'єму атома, утво-рюючи електронну хмару, густина якої характе- |
ризує вірогідність знаходження електрона в різних точках об'єму. Квантові числа n і l характеризують розмір і форму електронної хмари, а квантове число m характеризує її орієнтацію у просторі.
Голландські фізики Уленбек і Гаудсміт у 1925 році висунули гіпотезу, згідно якої електрон володіє не тільки орбітальним, але і власним механічним моментом імпульсу, названому спіном. Для наочності, наявність у електрона спіну можна уявити його обертанням навколо своєї осі (по-англійськи «to spin» – обертатись, вертітись). Поняття спіну електрона (і інших мікрочастинок) введене для пояснення результатів дослідів Штерна і Герлаха, які спостерігали розщеплювання вузького пучка атомів водню у неоднорідному магнітному полі на дві частини. Спін – чисто квантова величина, у неї немає класичного аналогу: це внутрішня, невід'ємна властивість електрона, як його заряд або маса. Згідно висновкам квантової механіки, спін електрона, і його проекція на напрям зовнішнього магнітного поля квантуються. По аналогії із орбітальним рухом, спін і його проекція можуть
|
набувати значень: де S – спінове квантове число, ms - спінове магнітне квантове число. Оскільки ms може приймати всього |
(2S+1)-значення, а розщеплення пучка відбувалось на 2 компоненти (можливі дві орієнтації спина у магнітному полі), із умови (2S+1)=2 визначили значення спінового квантового числа S=1/2. Спінове магнітне квантове число ms може набувати два значення ms=1/2. Дослідним шляхом було встановлено, що гіромагнітне від-
|
ношення для спінових моментів у два рази більше, ніж для орбітальних моментів електрона, а саме: Звідки, спіновий магнітний момент електрона складає: |
|
|
де B - магнетон Бора, який є одиницею виміру магнітних моментів. Про- екція спінового магнітного моменту на вісь z може набувати значень: Спінові механічний та магнітний мо-менти електрона виявляються не тіль |
|
ки у магнітних властивостях речовини, але і в інших явищах, тому можна говорити про спінове магнітне квантове число ms, як про четвертий тип квантового числа, що визначає поведінку електронів у атомах.
Якщо при перестановці частинок місцями хвильова функція не змінює знак, вона називається симетричною, а якщо змінює – антисиметричною. Симетрія хвильових функцій визначається спіном частинок. Частинки із нульовими або цілими спінами (-мезони, фотони) описуються симетричними хвильовими функціями, підлягають статистиці Бозе-Ейнштейна і називаються бозонами. А частинки із напівцілими спінами (електрони, протони) описуються антисиметричними хвильовими функціями, підлягають статистиці Фермі-Дірака і називаються ферміонами. Залежність характеру симетрії хвильових функцій системи тотожних частинок від їх спину теоретично обгрунтована швейцарським фізиком Паулі. Узагальнюючи дослідні дані, він сформулював принцип (принцип Паулі). Оскільки стан електрона у атомі однозначно визначається чотирма квантовими числами, то згідно принципу Паулі, два електрони у одному і тому ж атомі повинні розрізнятися значеннями, принаймні, одного квантового числа, тобто Z(n, l, m, ms)=0 або 1. Максимальна кількість електронів, які знаходяться у станах, визначених головним квантовим числом n (кратність виродження енергетичного рівня Еn із урахуванням спіну електрона) визначається формулою:
|
Сукупність електронів у багатоелектрон-ному атомі, які мають однакове головне квантове число n, називають електрон-ним шаром. Сукупність електронів у кожному шарі, відповідних певному значен- |
ню орбітального квантового числа l,називають електронною оболонкою. Кількість електронів у оболонках визначається магнітним m і спіновим ms квантовими числами. Позначення електронних шарів і оболонок взяті із спектроскопії, а наповнення їх електронами приведене у таблиці:
Головне кван- тове число n |
1 |
2 |
3 |
4 |
5 |
||||||||||
Символ элект- ронного шару |
K |
L |
M |
N |
O |
||||||||||
Число электро- нів в шарі |
2 |
8 |
18 |
32 |
50 |
||||||||||
Орбітальне ква-нтове число l |
0 |
0 |
1 |
0 |
1 |
2 |
0 |
1 |
2 |
3 |
0 |
1 |
2 |
3 |
4 |
Символ электронної оболонки |
1S |
2S |
2p |
3S |
3p |
3d |
4S |
4p |
4d |
4f |
5S |
5p |
5d |
5f |
5g |
Число электро-нів у оболонці |
2 |
2 |
6 |
2 |
6 |
10 |
2 |
6 |
10 |
14 |
2 |
6 |
10 |
14 |
18 |
Принцип Паулі, який лежить у основі систематики заповнення електронних станів в атомах, дозволяє пояснити Періодичну систему елементів Д.І.Менделєєва – фундаментального закону природи, що є основою сучасної хімії, атомної і ядерної фізики. Оскільки хімічні і деякі фізичні властивості пояснюються зовнішніми (валентними) електронами у атомах, то періодичність властивостей елементів мусить бути зв'язана із певною періодичністю у розташуванні електронів в атомах, яка відповідає принципу Паулі і стає цілком зрозумілою.
ТЕСТОВІ ЗАВДАННЯ З РОЗДІЛУ “ЕЛЕМЕНТИ КВАНТОВОЇ МЕХАНІКИ”