
- •Графік залежності х(t) для рівномірного
- •Одиниця прискорення руху тіла в сі
- •Як рухається тіло, якщо напрямок його
- •Формула для розрахунку проекції переміщення в разі вільного падіння тіла.
- •Динаміка №1
- •Динаміка №2
- •Вага тіла, що перебуває в стані спокою або рівномірного прямолінійного руху (в стані рівноваги)
- •Вага тіла, що рухається з прискоренням , напрямленим вертикально вгору
- •Вага тіла, що рухається з прискоренням , напрямленим вертикально вниз
- •Закони збереження в механіці
- •Розрахунок швидкості ракети за умови миттєвого згоряння палива
- •Робота сили тяжіння
- •Потенціальна енергія тіла піднятого над поверхнею Землі .
- •Потенціальна енергія пружно деформованого тіла
- •Робота сили пружності
- •Механічні коливання і хвилі.
- •Основні характеристики коливальної системи здатної здійснювати вільні коливання:
- •Г еометрична модель коливального руху.
- •Рівняння гармонічних коливань (залежність зміщення тіла від часу)
- •Чому під час коливань тіло не зупиняється в положенні рівноваги?
- •Рівняння коливань пружинного маятника
- •Опишіть коливання математичного маятника
- •Рівняння коливань математичного маятника
- •Перетворення енергії під час коливань пружинного маятника
- •Перетворення енергії під час коливань математичного маятника
- •Чим визначається частота вимушених коливань?
- •Від чого залежить амплітуда вимушених коливань?
- •Від чого залежить амплітуда коливань під час резонансу
- •Основні елементи автоколивальної системи
- •Чим відрізняються і чим подібні вільні коливання і автоколивання?
- •Чим відрізняються і чим подібні вимушені коливання і автоколивання?
- •У творення пружних хвиль
- •Основні особливості хвильового руху
- •В яких середовищах поширюються поздовжні хвилі?
- •В яких середовищах поширюються поперечні хвилі?
- •Що означає вираз: «Хвиля є періодичною у просторі і часі»
- •Основи молекулярно – кінетичної теорії
- •Експериментальні факти, що підтверджують взаємодію між молекулами:
- •Твердий стан речовини
- •Рідкий стан речовини
- •Газоподібний стан речовини
- •Зв’язок між середньою кінетичною енергії руху атомів і молекул речовини та її температурою :
- •Зв’язок між тиском і температурою ідеального газу
- •Співвідношення, що визначають зв’язок між температурним шкалами Цельсія і Кельвіна
- •Універсальна газова стала
- •Графіки ізотермічного процесу – ізотерми.
- •Графіки ізобарного процесу – ізобари
- •Графіки ізохорного процесу – ізохори
- •Властивості пари, рідини і твердих тіл
- •Чинники, що впливають на швидкість випаровування:
- •Прилади для вимірювання відносної вологості:
- •Способи збільшення відносної вологості повітря:
- •Чинники, що впливають на значення поверхневого натягу рідини:
- •Методи визначення поверхневого натягу
- •Висота підняття рідини по капіляру :
- •Властивості полімерів:
- •Основи термодинаміки
- •Розрахунок кількості теплоти , яку необхідно передати тілу при його нагріванні або яка виділяється при його охолодженні
- •Максимальний ккд теплової машини:
Зв’язок між середньою кінетичною енергії руху атомів і молекул речовини та її температурою :
![]()
Стала Больцмана - фізична величина, що показує на скільки зміниться середня кінетична енергія молекули речовини при зміні її температури на 1К
![]()
Зв’язок між тиском і температурою ідеального газу
![]()
Шкала Кельвіна (абсолютна температурна шкала) введена з міркувань того, що температура є мірою середньої кінетичної енергії руху атомів і молекул речовини і, оскільки мінімальна можлива швидкість поступального руху молекул (а відповідно і кінетична енергія) рівна нуль, то й і мінімальна можлива температура теж має дорівнювати нулю. Ця температура називається абсолютним нулем температури. Зміна температури за шкалою Цельсія така сама як і за шкалою Кельвіна, тобто
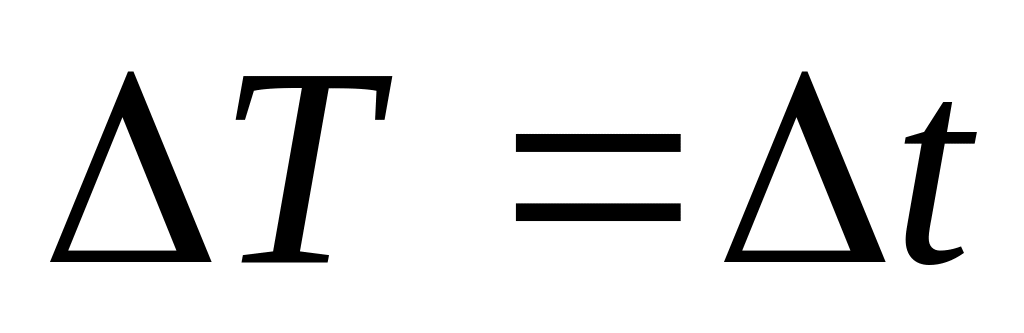 .
.Шкала Цельсія – вводиться з міркувань, що за
 приймається температура при якій
відбувається танення льоду, а за
приймається температура при якій
відбувається танення льоду, а за
 - температура кипіння води.
- температура кипіння води.
![]()
Співвідношення, що визначають зв’язок між температурним шкалами Цельсія і Кельвіна
![]()
Рівняння стану ідеального газу (рівняння Менделєєва – Клапейрона) встановлює взаємозв’язок між макроскопічними параметрами системи тиском , об’ємом і температурою

-
маса газу,
-
молярна маса речовини,
-
кількість речовини,
![]() -
універсальна газова стала
-
універсальна газова стала
Універсальна газова стала
|
|
|
|
Рівняння стану ідеального газу (рівняння Клапейрона) встановлює взаємозв’язок між макроскопічними параметрами системи тиском , об’ємом і температурою за умови, що маса газу є величиною сталою


Ізопроцес – процес зміни стану газу за незмінному одному з параметрів системи.
Ізотермічний процес - процес зміни стану газу при незмінній температурі.
Закон Бойля – Маріотта: для газу сталої маси при незмінній температурі добуток тиску на об’єм є величиною сталою.
![]()
![]()
![]()
Графіки ізотермічного процесу – ізотерми.
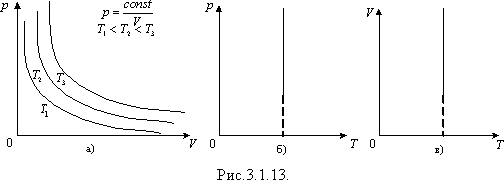
Графічно залежність тиску газу від об'єму при умові T = const можна зобразити у вигляді кривої - ізотерми в координатах p, V і прямих ліній в координатах p, T та V, T
Ізобарний процес – процес зміни стану газу за незмінного тиску.
Закон Гей – Люссака: для газу сталої маси при незмінному тиску відношення об’єму газу до його температури є величиною сталою.
![]()
![]()
![]()
Закон Гей – Люссака: за сталого тиску відносна зміна об’єму газу сталої маси прямо пропорційна зміні температури :

![]() -
температурний коефіцієнт об’ємного
розширення газу
-
температурний коефіцієнт об’ємного
розширення газу
Графіки ізобарного процесу – ізобари
На рис.а зображено дві ізобари в координатах V, T за різних значень тиску p1 і p2, причому p1<p2. і на рис. б, в наведено графіки ізобарного процесу в координатах p, T, p, V.

Ізохорний процес – процес зміни стану газу за незмінного об’єму.
Закон Шарля: для газу сталої маси при незмінному об’єму відношення тиску газу до його температури є величиною сталою.
![]()
![]()
![]()
Закон Шарля: для газу даної маси при ізохоричному процесі між тиском і температурою існує лінійна залежність – з підвищенням температури даної маси газу його тиск зростає
![]()
![]() -
температурний
коефіцієнт тиску
-
температурний
коефіцієнт тиску
