
- •Графік залежності х(t) для рівномірного
- •Одиниця прискорення руху тіла в сі
- •Як рухається тіло, якщо напрямок його
- •Формула для розрахунку проекції переміщення в разі вільного падіння тіла.
- •Динаміка №1
- •Динаміка №2
- •Вага тіла, що перебуває в стані спокою або рівномірного прямолінійного руху (в стані рівноваги)
- •Вага тіла, що рухається з прискоренням , напрямленим вертикально вгору
- •Вага тіла, що рухається з прискоренням , напрямленим вертикально вниз
- •Закони збереження в механіці
- •Розрахунок швидкості ракети за умови миттєвого згоряння палива
- •Робота сили тяжіння
- •Потенціальна енергія тіла піднятого над поверхнею Землі .
- •Потенціальна енергія пружно деформованого тіла
- •Робота сили пружності
- •Механічні коливання і хвилі.
- •Основні характеристики коливальної системи здатної здійснювати вільні коливання:
- •Г еометрична модель коливального руху.
- •Рівняння гармонічних коливань (залежність зміщення тіла від часу)
- •Чому під час коливань тіло не зупиняється в положенні рівноваги?
- •Рівняння коливань пружинного маятника
- •Опишіть коливання математичного маятника
- •Рівняння коливань математичного маятника
- •Перетворення енергії під час коливань пружинного маятника
- •Перетворення енергії під час коливань математичного маятника
- •Чим визначається частота вимушених коливань?
- •Від чого залежить амплітуда вимушених коливань?
- •Від чого залежить амплітуда коливань під час резонансу
- •Основні елементи автоколивальної системи
- •Чим відрізняються і чим подібні вільні коливання і автоколивання?
- •Чим відрізняються і чим подібні вимушені коливання і автоколивання?
- •У творення пружних хвиль
- •Основні особливості хвильового руху
- •В яких середовищах поширюються поздовжні хвилі?
- •В яких середовищах поширюються поперечні хвилі?
- •Що означає вираз: «Хвиля є періодичною у просторі і часі»
- •Основи молекулярно – кінетичної теорії
- •Експериментальні факти, що підтверджують взаємодію між молекулами:
- •Твердий стан речовини
- •Рідкий стан речовини
- •Газоподібний стан речовини
- •Зв’язок між середньою кінетичною енергії руху атомів і молекул речовини та її температурою :
- •Зв’язок між тиском і температурою ідеального газу
- •Співвідношення, що визначають зв’язок між температурним шкалами Цельсія і Кельвіна
- •Універсальна газова стала
- •Графіки ізотермічного процесу – ізотерми.
- •Графіки ізобарного процесу – ізобари
- •Графіки ізохорного процесу – ізохори
- •Властивості пари, рідини і твердих тіл
- •Чинники, що впливають на швидкість випаровування:
- •Прилади для вимірювання відносної вологості:
- •Способи збільшення відносної вологості повітря:
- •Чинники, що впливають на значення поверхневого натягу рідини:
- •Методи визначення поверхневого натягу
- •Висота підняття рідини по капіляру :
- •Властивості полімерів:
- •Основи термодинаміки
- •Розрахунок кількості теплоти , яку необхідно передати тілу при його нагріванні або яка виділяється при його охолодженні
- •Максимальний ккд теплової машини:
Поздовжні хвилі – хвиля у якій частинки коливаються вздовж напрямку поширення хвилі.
В яких середовищах поширюються поздовжні хвилі?
Поздовжні хвилі можуть поширюватись у всіх середовищах: рідких твердих і газоподібних (оскільки їх виникнення викликане деформаціями розтягк або стиску середовища)
Поперечні хвилі – це хвиля, у якій частинки середовища коливаються перпендикулярно до напрямку поширення хвилі .
В яких середовищах поширюються поперечні хвилі?
Поперечні хвилі можуть поширюватись тільки у твердих тілах, оскільки їх виникнення обумовлене деформаціями зсуву, які можливі тільки в твердих тілах
Довжина хвилі – це відстань між двома найближчими
 точками,
які коливаються в однаковій фазі.
точками,
які коливаються в однаковій фазі.
Довжина
хвилі – це
відстань, на яку поширюється
![]()
хвиля за час, що дорівнює періоду коливань
- довжина хвилі
![]()
![]()
Формула хвилі встановлює зв’язок між -
довжиною хвилі , швидкістю її поширення та
частотою (або періодом )
![]()
Що означає вираз: «Хвиля є періодичною у просторі і часі»
Періодичність хвилі в часі означає, що через певний проміжок часу Т коливання частинки повністю повторюються. Періодичність хвилі в просторі говорить про те, що якщо зафіксувати даний момент часу, то через відстань, яка дорівнює хвилі, форма хвилі повториться.
Основи молекулярно – кінетичної теорії
Молекулярно – кінетична теорія (МКТ ) будови речовини – це теорія, яка пов’язує перебіг теплових явищ з особливостями внутрішньої будови речовини і вивчає причини, що зумовлюють тепловий рух. Вона пояснює теплові властивості твердих тіл, рідин і газів на основі теплового руху мікрочастинок, з яких вони складаються.
Основні положення МКТ будови речовини:
Речовина складається з мікрочастинок – атомів, молекул, іонів тощо.
Ці мікрочастинки перебувають у безперервному хаотичному русі й взаємодіють між собою.
Приклади фізичних явищ, які є непрямим доказом існування атомів і молекул:
Закон постійних відношень мас в хімічних реакціях
Броунівський рух – тепловий рух завислих в рідині або газі маленьких частинок речовини
Явище дифузії – взаємне проникнення речовин одна в одну. Дифузія широко застосовується в практичному житті людиною: фарбування тканин, соління овочів і т. д.
Які вимірювання треба провести, щоб оцінити розміри молекули маслинового масла?
Якщо пустити краплину олії (її об’єм відомий) на поверхню чистої води, то вона розпливеться, утворюючи тонку плівку, яка складається з одного шару молекул. Вимірявши площу утвореної плівки, можна визначити її товщину, тобто діаметр молекул.
Яким є порядок діаметра атома? Наведіть порівняння, які дозволяють уявити, наскільки молекули (атоми) є малими.
Сучасні
методи вимірювання дають змогу визначити
розміри молекул і атомів, які приблизно
однакові для молекул кожної речовини
і мають той самий порядок
![]() .
.
Молекули і атоми настільки малі, що уявити їх розміри модна тільки порівнянням. Так, атом заліза у стільки разів менший за волоський горіх, у скільки горіх менший за Місяць. Якщо збільшити молекулу води до розмірів головки шпильки, то сама головка за такого самого збільшення була б більша за найвищу гору Землі – Джомолунгму.
Відносна атомна маса речовини
 -
відношення маси атома
-
відношення маси атома
 даної речовини до
даної речовини до
 маси атома вуглецю
маси атома вуглецю
 :
:
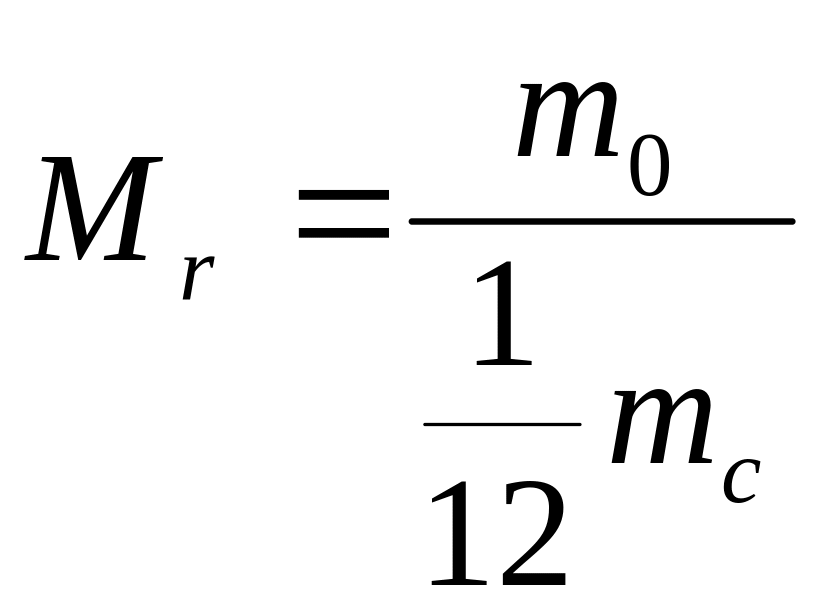
Відносна атомна маса вимірюється в атомних одиницях маси
Атомна одиниця маси – дорівнює маси атома вуглецю . Експериментально встановлено,що
![]()
Наведіть порівняння, які дозволяють уявити, наскільки молекули є численними.
В
1 г води міститься
![]() молекул. Це число величезне. Воно незмірно
більше за кількість склянок води, яка
міститься у всіх морях, океанах, річках.
молекул. Це число величезне. Воно незмірно
більше за кількість склянок води, яка
міститься у всіх морях, океанах, річках.
Кількість речовини – це відношення кількості молекул у даному тілі до кількості атомів
 в 0,012 кг вуглецю С-12.
в 0,012 кг вуглецю С-12.

Кількість речовини можна також визначити відношенням маси тіла до молярної
маси
речовини з якої воно виготовлене![]()
1 моль – це така кількість речовини , яка містить стільки само атомів, молекул чи інших структурних елементів, скільки атомів міститься в 0,012кг вуглецю С-12.
Очевидно, що в 1 молі будь-якої речовини міститься однакова кількість атомів і молекул.
Стала Авогадро - кількість атомів і молекул, що міститься в 1 молі будь-якої речовини.
![]()
Молярна маса – це маса 1моля речовини.
Щоб визначити молярну масу достатньо масу молекули речовини помножити на сталу Авогадро

Як пов’язані відносна молекулярна і молярна маса
![]()
Густина
 –
фізична
величина, що дорівнює масі речовини в
одиниці об’єму і визначається відношенням
маси тіла
до його об’єму
–
фізична
величина, що дорівнює масі речовини в
одиниці об’єму і визначається відношенням
маси тіла
до його об’єму
 .
.

Густину речовини можна визначити якщо масу її молекули помножити на
Концентрацію
![]() речовини
речовини
![]()
Концентрація - фізична величина, що показує яка кількість молекул міститься в одиниці об’єму речовини, і визначається відношенням кількості молекул в тілі до його об’єму

