
- •Особливості відбору проб на аналіз
- •Консервування та підготовка проб води до аналізу
- •Методи аналізу води
- •1.1. Визначення кольоровості води
- •1.2. Визначення запаху
- •Лабораторна робота № 2 визначення зависей та розчинених речовин
- •2.1. Визначення прозорості води
- •2.2. Визначення каламутності води
- •2.3. Визначення вмісту розчинених речовин (сухого залишку)
- •Лабораторна робота № 3 визначення перманганатної й дихроматної окиснюваності
- •3.1. Визначення перманганатної окиснюваності води
- •3.2. Визначення хімічного споживання кисню
- •3.3. Визначення дихроматної окиснюваності води прискореним методом
- •Лабораторна робота № 4 визначення біохімічного споживання кисню
- •Лабораторна робота № 5 визначення твердості води
- •5.1. Визначення твердості води спиртово-мильним методом
- •5.2. Визначення загальної твердості комплексометричним методом
- •5.3. Визначення загальної карбонатної твердості
- •5.4. Визначення залишкової карбонатної твердості
- •Лабораторна робота № 6 визначення розчиненого кисню методом вінклера
- •Лабораторна робота № 7 визначення кислотності й лужності води
- •7.1. Визначення рН води
- •7.2. Визначення кислотності води
- •7.3. Визначення лужності
- •Лабораторна робота № 8 визначення сполук нітрогену — аміаку, нітритів і нітратів
- •8.1. Визначення аміаку
- •Напівкількісний метод
- •Кількісний фотоколориметричний метод
- •8.2. Визначення нітритів
- •Якісний метод з наближеною кількісною оцінкою
- •Кількісний фотометричний метод
- •8.3. Визначення нітратів
- •Лабораторна робота № 9 визначення активного хлору
- •Лабораторна робота № 10 дослідження антропогенної евтрофікації водойм
- •11.3. Функціональна схема аналізатора
- •11.4. Підготовка аналізатора до роботи
- •11.4.1. Техніка безпеки
- •11.4.2. Градуювання аналізатора
- •11.5. Вимірювання масової концентрації ртуті
- •12.3. Функціональна схема й принцип роботи аналізатора
- •12.4. Принцип дії аналізатора
- •12.4.1. Принцип дії каналу вимірювань масової концентрації розчиненого у воді кисню о2
- •12.4.2. Принцип дії каналу вимірювання рН
- •12.4.3. Принцип дії каналу вимірювання температури
- •12.5. Приготування аналізатора до вимірювань
- •12.5.1. Приготування чутливого елемента о2
- •12.5.2. Приготування електродної системи рН
- •12.6. Порядок проведення вимірювань
- •12.6.1. Техніка безпеки
- •12.6.2. Порядок проведення вимірювань
- •12.6.3. Відлік показників вимірювань
- •12.6.4. Графічний аналіз результатів вимірювань
- •Додаток
- •Бібліографічний список
Лабораторна робота № 3 визначення перманганатної й дихроматної окиснюваності
3.1. Визначення перманганатної окиснюваності води
Окиснюваність води характеризується кількістю міліграмів кисню, потрібного для окиснення органічних речовин, що містяться в 1 л води. Окиснення здійснюють у м'яких умовах перманганатом калію у кислому середовищі (окиснюються лише легкоокиснювані органічні та деякі неорганічні сполуки) або дихроматом калію в концентрованій сульфатній кислоті під час кип'ятіння (окиснюються практично всі органічні сполуки, навіть важкоокиснювані).
Обладнання і реактиви: конічна колба місткістю 300 мл, електрична плитка, піпетки Мора, штатив, бюретка; сульфатна кислота, розбавлена до співвідношення 1:3; розчин перманганату калію KMnO4 з C(1/z)=0,01 моль/л; розчин оксалатної (щавлевої) кислоти H2C2O4∙2Н2O з C(1/z)=0,01 моль/л [з С(1/z) — молярна концентрація еквівалентів, раніше — нормальність розчину, Н].
Хід роботи
У конічну колбу місткістю 300 мл наливають 100 мл досліджуваної води, 5 мл сульфатної кислоти і 10 мл розчину перманганату калію. Суміш доводять до кипіння і кип'ятять протягом 10 хв. Знебарвлення розчину свідчить про недостатню кількість введеного окисника: у цьому випадку відбирають ще пробу води і визначення проводять з більшою кількістю КМnО4. Після кип'ятіння до розчину додають 10 мл розчину щавлевої кислоти з C(1/z)=0,01 моль/л і надлишок її відтитровують розчином КМnО4 з С(1/z)=0,01 моль/л.
Результати обчислюють за формулою
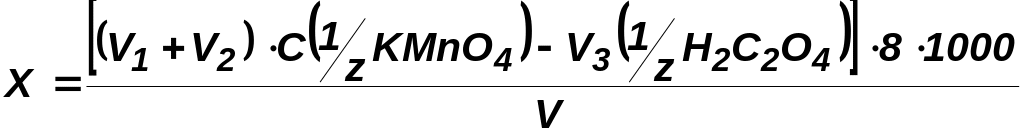 ,
,
де X — окиснюваність води, мг О2/л; V1 — об'єм КМnО4, доданий до води перед кип'ятінням, мл; V2 — об'єм КМnО4, витрачений на титрування надлишку оксалатної кислоти, мл; C(1/z КМnО4) — молярна концентрація еквівалентів розчину КМnО4; V3 — об'єм доданої щавлевої кислоти, мл; C(1/z Н2С2О4) — молярна концентрація еквівалентів розчину оксалатної кислоти; 8 — еквівалент кисню; V — об'єм аналізованої води, мл.
3.2. Визначення хімічного споживання кисню
Дихроматна окиснюваність (або ХСК) — це величина, що характеризує загальний вміст у воді відновників (неорганічних і органічних), які реагують із дихроматом калію у сульфатній кислоті (1:1) у перерахунку на кисень (мг О2/л).
Окиснення органічних сполук відбувається майже цілком до СО2, Н2О, г-1, при використанні каталізатора — сульфату аргентуму Аg2SO4, хоча бензол, піридин, толуол та інші ароматичні вуглеводні повністю не окиснюються навіть за цих умов.
Перед визначенням ХСК аналізовану воду фільтрують. Щоб фільтр не поглинав органічних речовин або з нього органічні речовини не потрапляли у воду, фільтр промивають гарячою водою і під час фільтрування викидають перші 200…250 мл фільтрату.
Якщо стічна вода містить органічні речовини, які легко окиснюються на повітрі або леткі, замість фільтрування воду відстоюють і для аналізу відбирають верхній прозорий шар.
За відсутності у воді хлоридів як каталізатор використовують Аg2SО4. Якщо аналізована стічна вода містить хлориди і лише легкоокиснювані органічні речовини, то визначення можна провести без Аg2,SO4; хлорид-іони окиснюються до вільного хлору і в отримані результати вносять поправку: на 1 мг Сl– витрачається 0,23 мг О2.
Якщо стічна вода містить органічні речовини, які окиснюються лише за наявності Аg2SO4, то для зв'язування хлоридів додають сульфат меркурію (II) НgSO4 у такій кількості, щоб на кожен міліграм СІ– припадало 15 мг Нg (22,5 мг НgSО4); при цьому утворюється розчинний, але малодисоційований НgСІ2, який при надлишку Нg2+ стійкий навіть за наявності концентрованої сульфатної кислоти й дихромату калію.
Хлорид-іони при концентрації менше 1 г/л усуваються додаванням 0,4 г НgSО4. Якщо концентрація СІ– вища за 1 г/л, то НgSO4 додають у 15-кратній до СІ– кількості. Одночасно потрібно додати 5 мл концентрованої сульфатної кислоти для кращого розчинення НgSО4.
Негативний вплив сульфід-іонів усувають додаванням до проби дихромату калію і невеликої кількості концентрованої сульфатної кислоти та відстоюванням суміші впродовж кількох хвилин за кімнатної температури.
Обладнання і реактиви: круглодонна колба на шліфах; обертальний холодильник на шліфах; колба конічна для титрування; електроплитка або піщана баня; піпетки Мора; бюретка і штатив, мірні колби на 1 і 2 л; паперовий фільтр, скляна лійка; розчин К2Сr2О7, С(1/z К2Сr2О7)=0,25 моль/л (розчиняють 12,258 г К2Сr3O7, ч.д.а., висушеного протягом двох годин за температури 105°С у дистильованій воді й доводять об'єм до 1 л (або п’ять ампул із фіксапалом розчиняють у мірній колбі місткістю 2 л); сульфатна кислота, концентрована, ч.д.а.; сульфат меркурію (II) НgSО4, ч.д.а.; сульфат аргентуму Аg2SО4, ч.д.а.; розчин солі Мора, Fе(NH4)2(SO4)2∙6Н2О, С(1/z)=0,25 моль/л (розчиняють 98 г солі в дистильованій воді, додають 20 мл концентрованої сульфатної кислоти і після охолодження доводять об'єм до 1 л дистильованою водою; точну концентрацію розчину встановлюють не рідше одного разу на добу таким способом: до 25 мл розчину К2Сr2О7 додають дистильовану воду приблизно до 100 мл, доливають 20 мл концентрованої сульфатної кислоти, перемішують і після охолодження титрують розчином солі Мора, додавши три краплі розчину фероїну або п’ять крапель фенілантранілової кислоти); фероїн (розчиняють 1,485 г моногідрату 1,10-фенантроліну і 0,695 г FеSО4∙7Н2О у дистильованій воді та розбавляють до 100 мл); фенілантранілова кислота (розчиняють 0,25 г реактиву в 12 мл розчину NaОН з С=0,1 моль/л і розбавляють дистильованою водою до 250 мл).
Стічну воду перед аналізом відстоюють протягом двох годин. Якщо вона не прозора, її фільтрують крізь паперовий фільтр. Мінімальний об'єм проби — 5 мл. Якщо перед аналізом пробу потрібно розбавити, на розбавляння слід брати не менше 10 мл початкової води. Правильно підібраний об'єм проби такий, на окиснення якого витрачається 50 мл дихромату калію.
Хід роботи
До 20 мл стічної води (або 5, 10, 15 мл з додаванням відповідно 15, 10, 5 мл дистильованої води) додають 10 мл розчину К2Сr2О7, 0,4 г НgSО4, перемішують і обережно доливають 30 мл концентрованої сульфатної кислоти. У колбу вставляють зворотний холодильник і закріплюють у штативі над електроплиткою або піщаною банею, доводять розчин до кипіння і кип'ятять упродовж двох годин.
Відключають холодильник і охолоджують пробу. Розчин переносять у конічну колбу, попередньо споліскуючи круглодонну колбу 100 мл дистильованою водою, додають 2–3 краплі фероїну й титрують до переходу забарвлення з блакитнувато-зеленого в червоно-коричневе (якщо п’ять крапель фенілантранілової кислоти, — з червоно-фіолетового в зелений) при титруванні розчином солі Мора.
Паралельно виконують контрольний дослід з 20 мл дистильованої води.
Хімічне споживання кисню, мг О2 /л, розраховують за формулою
![]() ,
,
де а і b — об'єм солі Мора, витрачений на титрування контрольної проби та проби води, мл; К — поправковий коефіцієнт для переведення концентрації солі Мора точно до C(1/z)=0,25 моль/л; V — об'єм проби, мл; 8 — еквівалент кисню.
