
- •Особливості відбору проб на аналіз
- •Консервування та підготовка проб води до аналізу
- •Методи аналізу води
- •1.1. Визначення кольоровості води
- •1.2. Визначення запаху
- •Лабораторна робота № 2 визначення зависей та розчинених речовин
- •2.1. Визначення прозорості води
- •2.2. Визначення каламутності води
- •2.3. Визначення вмісту розчинених речовин (сухого залишку)
- •Лабораторна робота № 3 визначення перманганатної й дихроматної окиснюваності
- •3.1. Визначення перманганатної окиснюваності води
- •3.2. Визначення хімічного споживання кисню
- •3.3. Визначення дихроматної окиснюваності води прискореним методом
- •Лабораторна робота № 4 визначення біохімічного споживання кисню
- •Лабораторна робота № 5 визначення твердості води
- •5.1. Визначення твердості води спиртово-мильним методом
- •5.2. Визначення загальної твердості комплексометричним методом
- •5.3. Визначення загальної карбонатної твердості
- •5.4. Визначення залишкової карбонатної твердості
- •Лабораторна робота № 6 визначення розчиненого кисню методом вінклера
- •Лабораторна робота № 7 визначення кислотності й лужності води
- •7.1. Визначення рН води
- •7.2. Визначення кислотності води
- •7.3. Визначення лужності
- •Лабораторна робота № 8 визначення сполук нітрогену — аміаку, нітритів і нітратів
- •8.1. Визначення аміаку
- •Напівкількісний метод
- •Кількісний фотоколориметричний метод
- •8.2. Визначення нітритів
- •Якісний метод з наближеною кількісною оцінкою
- •Кількісний фотометричний метод
- •8.3. Визначення нітратів
- •Лабораторна робота № 9 визначення активного хлору
- •Лабораторна робота № 10 дослідження антропогенної евтрофікації водойм
- •11.3. Функціональна схема аналізатора
- •11.4. Підготовка аналізатора до роботи
- •11.4.1. Техніка безпеки
- •11.4.2. Градуювання аналізатора
- •11.5. Вимірювання масової концентрації ртуті
- •12.3. Функціональна схема й принцип роботи аналізатора
- •12.4. Принцип дії аналізатора
- •12.4.1. Принцип дії каналу вимірювань масової концентрації розчиненого у воді кисню о2
- •12.4.2. Принцип дії каналу вимірювання рН
- •12.4.3. Принцип дії каналу вимірювання температури
- •12.5. Приготування аналізатора до вимірювань
- •12.5.1. Приготування чутливого елемента о2
- •12.5.2. Приготування електродної системи рН
- •12.6. Порядок проведення вимірювань
- •12.6.1. Техніка безпеки
- •12.6.2. Порядок проведення вимірювань
- •12.6.3. Відлік показників вимірювань
- •12.6.4. Графічний аналіз результатів вимірювань
- •Додаток
- •Бібліографічний список
5.1. Визначення твердості води спиртово-мильним методом
Метод ґрунтується на утворенні малорозчинних солей кальцію і магнію з калієвими або натрієвими солями вищих карбонових кислот, які входять до складу мила, наприклад:
2СІ7Н35СООК + СаСІ2 = (С17Н35СОО)2Са + 2КСl.
Обладнання і реактиви: колба конічна місткістю 250 мл з притертою скляною пробкою, мірні колби на 500 і 1000 мл; етанол, 80%‑й розчин; мильний розчин (100 г господарського мила розчиняють у 1 л 80%-го етанолу, дають відстоятися в закритій посудині впродовж однієї–трьох діб, потім чистий розчин зливають в іншу посудину); стандартний розчин хлориду кальцію (0,5 г безводного СаСІ2 розчиняють у кількох мілілітрах розбавленої хлоридної кислоти, додають 200 мл дистильованої води й нейтралізують аміаком (за універсальним індикаторним папером), кількісно переносять одержаний розчин у мірну колбу на 500 мл і доводять об'єм дистильованою водою до риски; 1 мл розчину еквівалентний за твердістю 1 мг СаСО3 і 1 мл мильного розчину).
Стандартизація мильного розчину. Розбавляють невелику порцію мильного розчину 80%-м етанолом, поки твердість 1 мл його не зрівняється з твердістю 1 мл стандартного розчину СаСІ2. Для цього 1 мл мильного розчину кожного разу змішують з 1 мл стандартного розчину СаСl2 і збовтують. Твердість мильного розчину стає стандартною, коли під час збовтування на поверхні суміші утвориться шар піни, що довго не зникає.
Хід роботи
Наливають у колбу 50 мл аналізованої води й порціями по 0,2 мл додають стандартний мильний розчин, щоразу збовтуючи вміст колби.
Після появи піни залишають колбу на п’ять хвилин. Якщо піна не зникне, аналіз закінчено. Кількість витраченого мильного розчину, в мл, помножена на 20, означає твердість води, в мг/л, у перерахунку на СаСО3.
5.2. Визначення загальної твердості комплексометричним методом
Метод ґрунтується на взаємодії катіонів кальцію і магнію з трилоном Б в аміачному буферному розчині (рН=9,5) з утворенням внутрішньокомплексних сполук (за наявності металохромних індикаторів). Чутливість методу — 0,001 ммоль екв/л.
Катіони важких металів перешкоджають визначенню, тому їх попередньо осаджують у вигляді малорозчинних сполук або зв'язують у стійкі комплекси (маскують).
Аналізована вода має бути прозорою (каламутну воду заздалегідь фільтрують). Мастило, яке знебарвлює індикатор, також видаляють фільтруванням. Титрування виконують за кімнатної температури. Початкове значення рН аналізованої проби води має становити 4,3, оскільки лише при цьому аміачний буферний розчин забезпечує необхідний рН = 9,5.
Обладнання і реактиви: піпетки Мора, конічні колби місткістю 250 мл, мірна колба на 1 л, штатив, бюретка, скляна лійка, беззольні фільтри; титрований розчин трилону Б (для води з твердістю 0,5…20,0 ммоль екв/л готують розчин з С(1/z) = 0,05 моль/л (за фіксаналом); якщо немає фіксаналу, то зважують 9,3 г трилону Б і розчиняють його у мірній колбі місткістю 1 л, доводять об'єм до риски дистильованою водою; концентрацію розчину трилону Б встановлюють за стандартним розчином МgSO4, приготовленим із фіксаналу; метод встановлення титру той самий, що й при визначенні твердості води; розчин трилону Б стійкий упродовж трьох-чотирьох місяців); аміачний буферний розчин (готують змішуванням однакових об'ємів 20%-го розчину аміаку NH4OH і 20%-го розчину хлориду амонію NH4Cl, pH = 9,5), розчин індикаторів (0,125 г індикатора розчиняють у 2,5 мл аміачного буферного розчину і доводять об'єм розчину етанолом до 25 мл; розчин кислотного хрому темно-синього зберігається довго, хромогену чорного — упродовж десяти днів.
Хід роботи
Беруть 10…100 мл аналізованої води (у відібраній пробі твердість не має перевищувати 0,5 ммоль екв/л) і доводять об'єм дистильованою водою до 100 мл, додають 5 мл аміачного буферного розчину і п’ять–сім крапель індикатора. В іншій колбі готують розчин «свідка»: до 100 мл дистильованої води додають 5 мл буферного розчину і п’ять–сім крапель індикатора. Потім пробу повільно титрують трилоном Б, інтенсивно струшуючи, до переходу забарвлення розчину з винно-червоного в яскраво-синій.
Твердість води, ммоль екв/л, розраховують за формулою
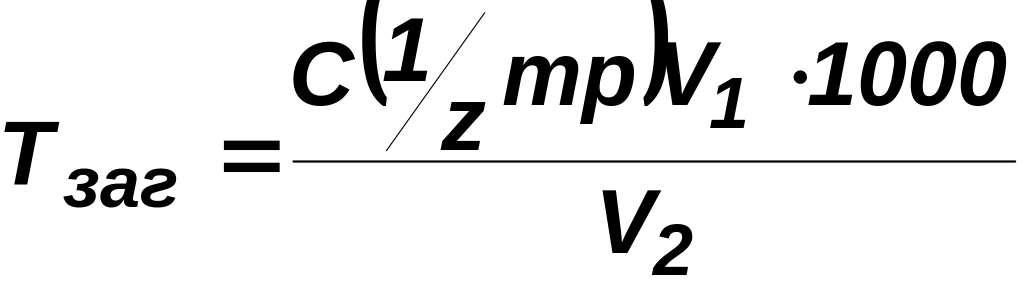 ,
,
де V1 — об'єм розчину трилону Б, мл; V2 — об'єм аналізованої води, мл; С(mp/z) — молярна концентрація еквівалентів розчину трилону, моль/л.
За цією методикою визначають твердість води від 0,5 до 20,0 ммоль екв/л за відсутності інших домішок.
Оскільки карбонатна твердість води зумовлена йонами НСО3–, її визначають титруванням проби води розчином хлоридної кислоти. Усувну твердість визначають за різницею між вмістом НСО3 до і після кип'ятіння проби води.
