
- •Практикум
- •1 Мета і задачі практичних занять
- •2 Вміст практичних занять
- •1.1 Розрахунок витратних коефіцієнтів
- •1.2 Приклади розв’язку задач
- •1.3 Задачі для самостійного розв’язку
- •2.1 Основи технологічних розрахунків – закони збереження і стехіометричних співвідношень
- •2.2 Приклади розв’язку задач
- •2.3 Задачі для самостійного розв’язку
- •Тема 3 Матеріальні розрахунки хіміко-технологічних процесів. Складання матеріальних балансів
- •3.2 Приклади розв’язку задач
- •3.3 Задачі для самостійного розв'язання
- •4.1 Теплові розрахунки хіміко-технологічних процесів. Складання теплових балансів
- •4.2 Приклади розв’язку задач
- •4.3 Задачі для самостійного розв'язання
- •Тема 5 Хімічна рівновага. Розрахунки рівноважних виходів
- •5.1. Розрахунок рівноважного складу суміші для хімічних процесів, які супроводжуються одною оборотною реакцією
- •5.1.1 Приклади розв’язку задач
- •5.1.2 Задача для самостійного розв'язання
- •5.2 Розрахунок рівноважного складу суміші для хімічних процесів, що супроводжуються декількома паралельними або послідовними оборотними процесами
- •5.3 Задачі для самостійного розв’язання
- •Тема 6 Кінетика хіміко-технологічних процесів. Розрахунок кінетичних параметрів
- •6.1 Розрахункові формули швидкості процесів.
- •6.2.Розрахунок кінетичних параметрів.
- •6.2.1.Методи визначення порядку реакцій.
- •6.2.1.1. Визначення порядку реакції по періоду напіврозпаду (тобто часу, протягом якого концентрація реагуючої речовини зменшиться удвічі).
- •6.2.1.2. Метод Оствальда-Нойеса.
- •6.2.1.3. Універсальний метод визначення порядків реакцій.
- •6.2.2. Константи швидкості, передекспоненціальний множник, енергія активації.
- •6.3 Задачі для самостійного вирішення
- •7.1 Розрахунок гетерогенно-каталітичних процесів
- •7.1 Основні формули для розрахунку гетерогенно-каталітичних реакцій
- •7.2 Розрахунки каталітичних процесів і реакторів.
- •7.3 Задачі для самостійного рішення
- •Тема 8 Електрохімічні процеси
- •8.2 Приклади розв’язку задач
1.1 Розрахунок витратних коефіцієнтів
Витратний коефіцієнт β – фактор, який визначає досконалість і економічну ефективність хіміко-технологічного процесу, характеризує витрати різних видів сировини, води, електроенергії на одиницю продукції, що виробляється по основній реакції з ступенем перетворення χ.
Визначення витратного коефіцієнта по сировині:
![]() , (1.1)
, (1.1)
де В – витрати сировини , т , м3 ;
χ – ступінь перетворення сировини у цільовий продукт
Теоретичний витратний коефіцієнт βТ. розраховують за рівнянням хімічної реакції, яке є в основі одержання цільового продукту. Практичний витратний βпр коефіцієнт розраховується з урахуванням витрат на побічні реакції і відходи виробництва, на механічні втрати
![]() , (1.2)
, (1.2)
де Ввт. – виробничі втрати
Ступінь перетворення розраховують через зміну кількості молів або маси компонента, як відношення кількості речовини, що прореагувала до її початкової кількості. Для реакції:
аА + bB + ... → rR + sS
 ; (1.3)
; (1.3)
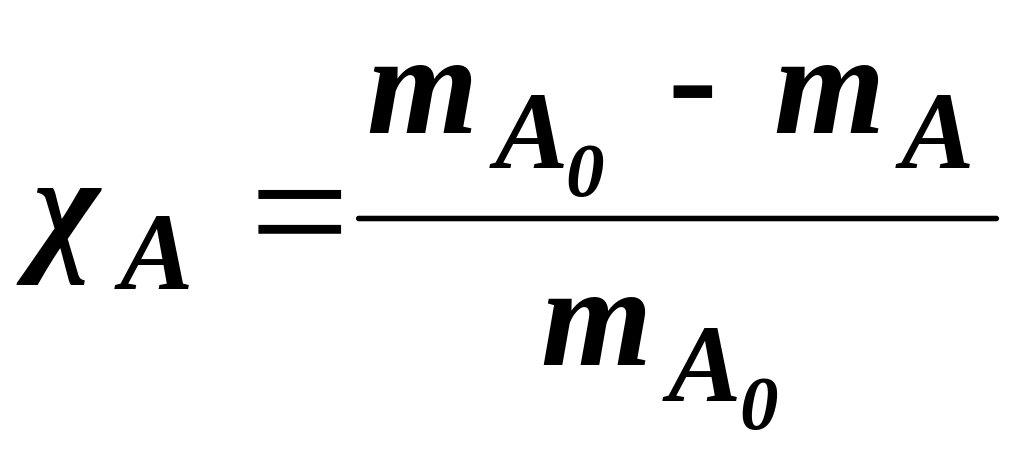 ;
(1.4)
;
(1.4)
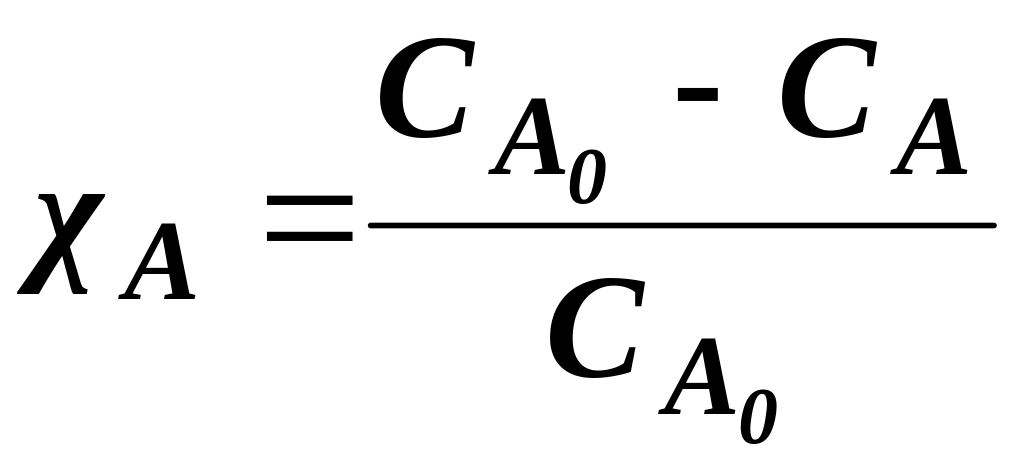 ;
(1.5)
;
(1.5)
де
![]() ,
nА
– кількість молів речовини А
(початкова і поточна) ;
,
nА
– кількість молів речовини А
(початкова і поточна) ;
![]() ,
mА
– маса речовини А (початкова і
поточна) ;
,
mА
– маса речовини А (початкова і
поточна) ;
![]() ,
СА
– концентрація речовини А (початкова
і поточна) ;
,
СА
– концентрація речовини А (початкова
і поточна) ;
a , b , r , s – стехіометричні коефіцієнти
Якщо змінюється об’єм в процесі реакції, то враховують коефіцієнт зміни об’єму ε :
![]() ,
(1.6)
,
(1.6)
де V1 – початковий об’єм реагуючої суміші ;
V2 – об’єм суміші в кінці реакції
Якщо процес перебігає не до кінця, враховують ступінь перетворення χ:
![]() ,
(1.7)
,
(1.7)
де
![]() –
поточне значення коефіцієнта зміни
об’єму.
–
поточне значення коефіцієнта зміни
об’єму.
Ступінь перетворення з урахуванням коефіцієнта зміни об’єму:
 .
(1.8)
.
(1.8)
Витратний коефіцієнт для стехіометричної суміші вихідних реагентів βст:
![]() ;
(1.9)
;
(1.9)
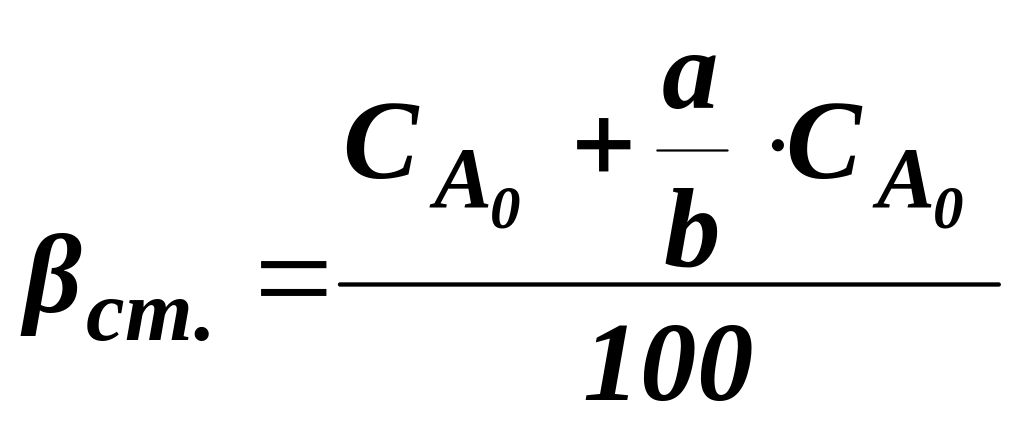 ,
(1.10)
,
(1.10)
де
![]() – кількість
молей вихідної речовини;
– кількість
молей вихідної речовини;
b , a – стехіометричні коефіцієнти.
![]() ;
(1.11)
;
(1.11)
![]() ;
(1.12)
;
(1.12)
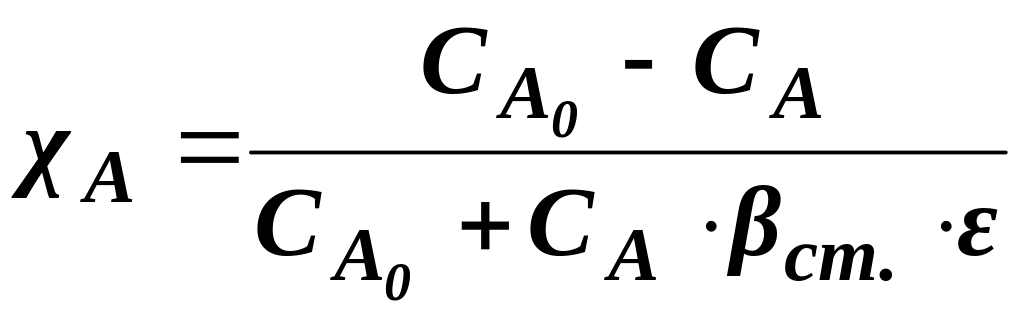 .
(1.13)
.
(1.13)
1.2 Приклади розв’язку задач
Задача № 1
Визначити витратний коефіцієнт по кисню при одержанні 1000м3 триоксиду сірки, якщо склад вихідної суміші, в %: SO2 – 7.6; О2 – 20.0; N2 –72.4; в кінцевій суміші вміст кисню О2 – 3%.
Розв’язок :
2 SO2 + О2 = 2 SO3
Маємо за умовою нестехіометричну суміш. Ступінь перетворення знаходимо за формулою (1.13):
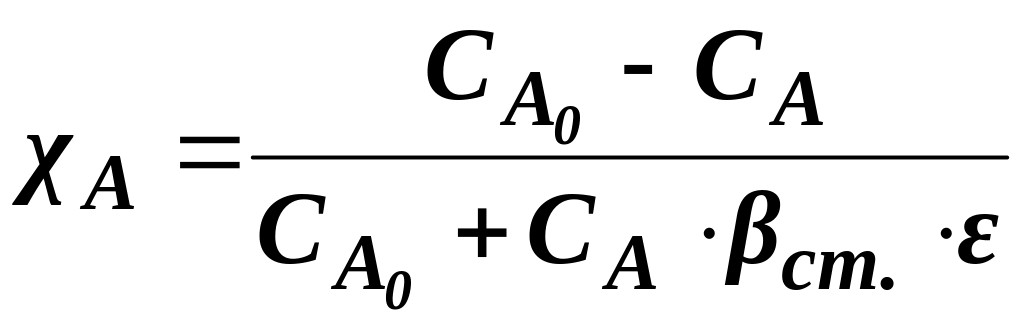 .
.
Розраховуємо βст за рівнянням (1.10):
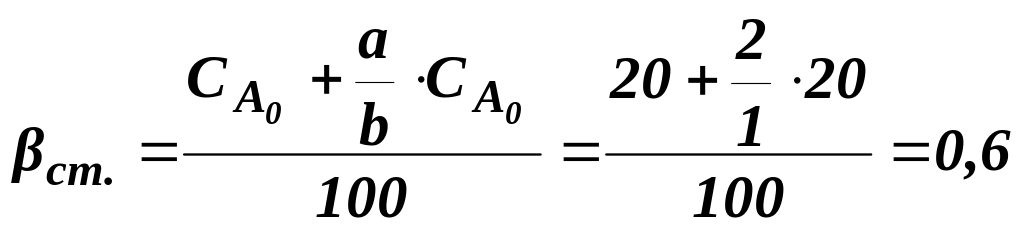 ;
;
Із залежності (1.6) знаходимо :
![]()
Таким чином:
![]()
Визначаємо витрати кисню, необхідного для одержання 1000 м3 SO3 :
х 1000
2 SO2 + О2 = 2 SO3
22,4 2∙22,4
![]()
З урахуванням ступеня перетворення:
![]()
Відповідь:
Витратний коефіцієнт по кисню
![]() =
570,8 м3
.
=
570,8 м3
.
Задача № 2
Визначити витрати 20%-ного олеума для підвищення концентрації 75%-ної сульфатної кислоти до концентрації 90% .
Розв’язок :
Витрати олеуму розраховують за формулою:
![]() ,
,
де С1 , С2 – концентрація моногідрату відповідно в олеумі, і в кислоті ,% ;
С3 – кількість вільного SO3 в олеумі, %;
G – маса кислоти , кг
![]()
Відповідь: Витрати олеума за даних умов G = 0,5085 кг/кг .
Задача № 3
Розрахувати витратні коефіцієнти у виробництві карбіду кальцію, склад якого ( в % мас.): СаС2 – 78; СаО – 15; С – 3; домішки – 4. Вапно має склад: СаО – 96,5%; кокс: зола – 4 %; леткі домішки – 4; волога – 3%.
Розрахунок вести на 1 т продукту.
Розв’язок :
Хімічна схема процесу:
СаО + 3С = СаС2 + СО
У 1 т продукту вміщується 0,78 т СаС2 .
Витрати вапна :
– за
стехіометричним співвідношенням :
![]() т ;
т ;
непрореагувало :
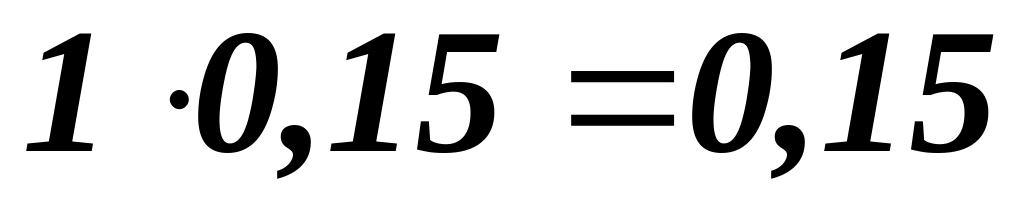 т ;
т ;сумарні втрати :
 т .
т .
Витрати вуглецю :
– на
утворення СаС2
:
![]() т ;
т ;
непрореагував :
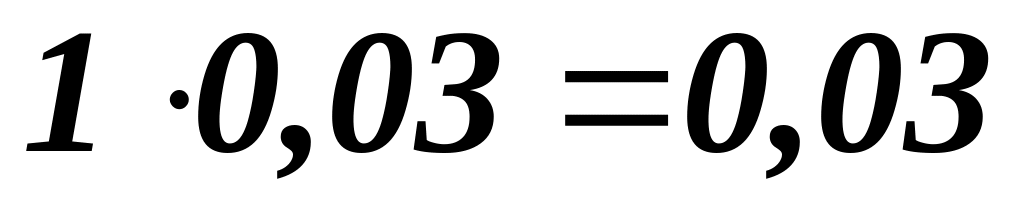 т ;
т ;
сумарні витрати :
 т .
т .
Вміст
вуглецю в коксі складає :
![]() .
.
Витрати
коксу :
![]() т .
т .
Відповідь : Витрати вапна : 0,833 т/т ;
Витрати коксу : 0,527 т/т .
