
- •Практикум
- •1 Мета і задачі практичних занять
- •2 Вміст практичних занять
- •1.1 Розрахунок витратних коефіцієнтів
- •1.2 Приклади розв’язку задач
- •1.3 Задачі для самостійного розв’язку
- •2.1 Основи технологічних розрахунків – закони збереження і стехіометричних співвідношень
- •2.2 Приклади розв’язку задач
- •2.3 Задачі для самостійного розв’язку
- •Тема 3 Матеріальні розрахунки хіміко-технологічних процесів. Складання матеріальних балансів
- •3.2 Приклади розв’язку задач
- •3.3 Задачі для самостійного розв'язання
- •4.1 Теплові розрахунки хіміко-технологічних процесів. Складання теплових балансів
- •4.2 Приклади розв’язку задач
- •4.3 Задачі для самостійного розв'язання
- •Тема 5 Хімічна рівновага. Розрахунки рівноважних виходів
- •5.1. Розрахунок рівноважного складу суміші для хімічних процесів, які супроводжуються одною оборотною реакцією
- •5.1.1 Приклади розв’язку задач
- •5.1.2 Задача для самостійного розв'язання
- •5.2 Розрахунок рівноважного складу суміші для хімічних процесів, що супроводжуються декількома паралельними або послідовними оборотними процесами
- •5.3 Задачі для самостійного розв’язання
- •Тема 6 Кінетика хіміко-технологічних процесів. Розрахунок кінетичних параметрів
- •6.1 Розрахункові формули швидкості процесів.
- •6.2.Розрахунок кінетичних параметрів.
- •6.2.1.Методи визначення порядку реакцій.
- •6.2.1.1. Визначення порядку реакції по періоду напіврозпаду (тобто часу, протягом якого концентрація реагуючої речовини зменшиться удвічі).
- •6.2.1.2. Метод Оствальда-Нойеса.
- •6.2.1.3. Універсальний метод визначення порядків реакцій.
- •6.2.2. Константи швидкості, передекспоненціальний множник, енергія активації.
- •6.3 Задачі для самостійного вирішення
- •7.1 Розрахунок гетерогенно-каталітичних процесів
- •7.1 Основні формули для розрахунку гетерогенно-каталітичних реакцій
- •7.2 Розрахунки каталітичних процесів і реакторів.
- •7.3 Задачі для самостійного рішення
- •Тема 8 Електрохімічні процеси
- •8.2 Приклади розв’язку задач
Тема 6 Кінетика хіміко-технологічних процесів. Розрахунок кінетичних параметрів
6.1 Розрахункові формули швидкості процесів.
Будь-який хіміко-технологічний процес включає три основні стадії: 1) транспорт реагуючих речовин в зону реакції (наприклад, дифузійне перенесення реагенту з розчину до поверхні твердої фази через шар рідини, примикаючий до поверхні, і шар твердого продукту реакції); 2) хімічна реакція; 3) транспорт продуктів із зони реакції (наприклад, дифузійне перенесення розчиненого продукту реакції від поверхні реакції через шар твердого продукту реакції і рідини, що примикає до поверхні твердої фази, в об'єм розчину).
Загальна швидкість процесу залежить від швидкостей його окремих стадій і дорівнює швидкості найповільнішої (лімітуючої) стадії. Якщо лімітуючою є перша або третя стадія, то вважається, що процес протікає в дифузійній області. Якщо загальну швидкість процесу лімітують швидкості хімічних реакцій, то процес протікає в кінетичній області. Якщо ж швидкості всіх стадій близькі, то процес протікає в перехідній області.
Залежно від того, в якій області протікає процес, застосовуються різні вирази і прийоми для математичного опису і збільшення загальної швидкості процесу. Для процесів, що протікають в дифузійних областях, сумарну швидкість визначають з використанням рівняння для швидкості масопередачі, рівнянь дифузії і хімічної реакції. Типові прийоми розрахунків дифузійної кінетики розглянуті в розділі 5. в даному розділі розглянемо особливості протікання процесів в кінетичній області.
Швидкість процесу, що протікає в кінетичній області, тобто швидкість хімічної реакції WZ(у кмоль/м3•с або кмоль/м2•с), виражається рівняннями:
для
гомогенної реакції
![]() ; (6.1)
; (6.1)
для
гетерогенної реакції
![]() ;
(6.2)
;
(6.2)
де V – об'єм реагуючих речовин, м3;
N – кількість речовини, що прореагувала або утворилася, кмоль;
F – поверхня контакту фаз, м2; τ – час, c.
Замість об'єму реагуючих речовин можна підставити об'єм реактора Vр, тоді
![]() .
(6.3)
.
(6.3)
При
V = Vp = const,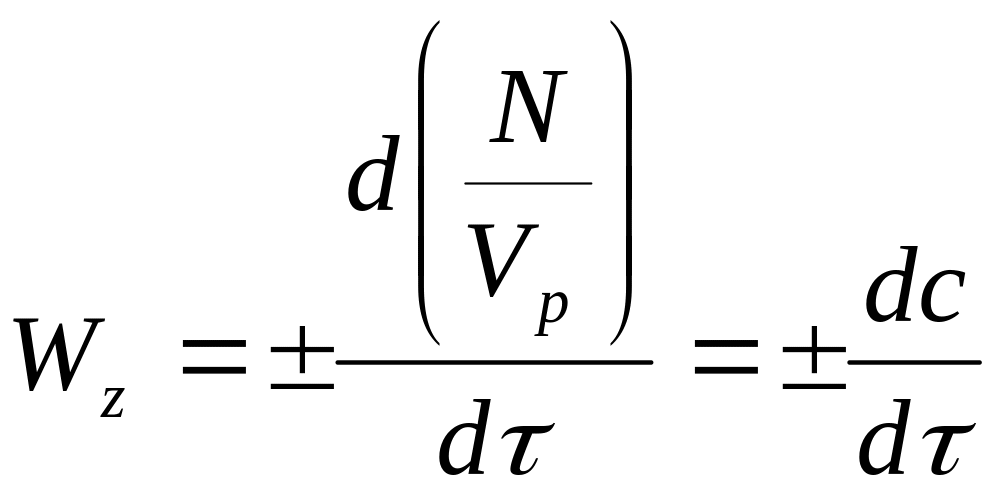 ,
(6.4)
,
(6.4)
де c – концентрація речовини, що є реагентом або продуктом в даній реакції, кмоль/м3.
Швидкість реакції пропорційна концентрацій реагуючих речовин в певній степені. Так, для модельної необоротної реакції аА+bB>dD, кінетичне рівняння матиме вигляд:
![]() ,
(6.5)
,
(6.5)
де К – константа швидкості реакції (залежна від температури);
nA, nB – порядки реакції по відповідних реагуючих речовинах;
CA, CB – поточні концентрації речовин, що беруть участь в реакції.
Загальний порядок реакції (n=nA+nB) визначають експериментально і теоретично обґрунтовують, чому дана реакція має саме такий порядок (з'ясувавши механізм реакції). Найчастіше порядки реакції по реагуючих речовинах nA і nB не співпадають із стехіометричними коефіцієнтами реакції (а і b). Але, якщо стехіометричне рівняння правильно відображає механізм реакції (тобто має місце проста реакція, що протікає в одну елементарну стадію), то порядок реакції співпадає з її молекулярністю.
Швидкості перетворення різних компонентів, що беруть участь в реакції, пов'язані один з одним стехіометричними коефіцієнтами. Наприклад, якщо стехіометричне рівняння реакції має вигляд A+B>3D, то співвідношення між швидкостями перетворення компонентів запишеться:
![]() .
(6.6)
.
(6.6)
Тому необхідно вказувати, по якому компоненту визначена швидкість реакції (від цього залежатиме обчислюване значення константи швидкості реакцій).
Нехтуючи
зміною об'єму в процесі реакції і беручи
до уваги, що ступінь перетворення по
речовині А в модельній реакції аА+bB>dD
дорівнює, зміна концентрації речовини А в
рівнянні (4.5) може бути виражена у вигляді:
зміна концентрації речовини А в
рівнянні (4.5) може бути виражена у вигляді:
![]() при
при
![]() ,
,
де СА0, ХА – початкова концентрація і ступінь перетворення речовини А.
Тоді із законів стехиометрії зміна концентрації речовини В виражається рівнянням
 ,
,
де
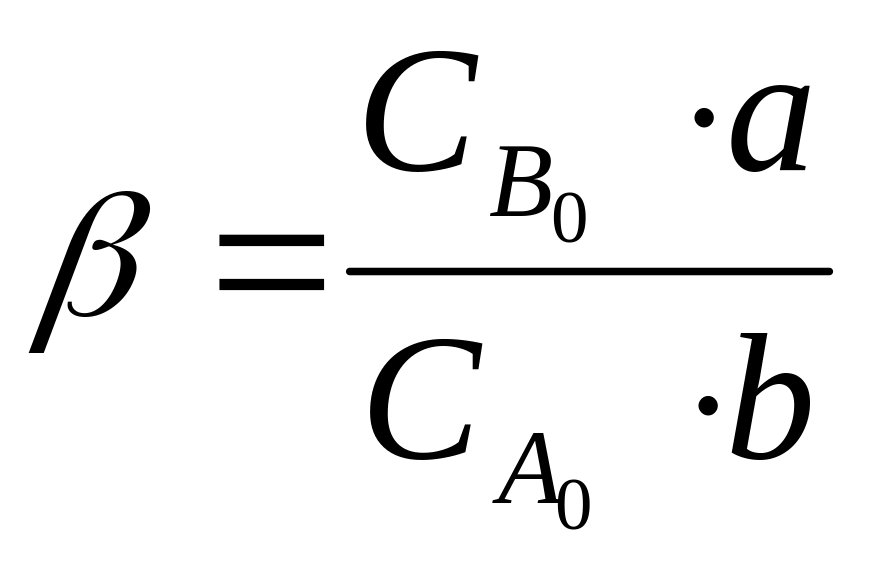 .
.
Кінетичне рівняння (6.5) можна записати так:
![]() .
.
Остаточно одержимо:
![]() ,
(6.7)
,
(6.7)
де
![]() ;
n – сумарний порядок реакції (n=nA+nB).
;
n – сумарний порядок реакції (n=nA+nB).
Якщо в системі протікає проста пряма і проста зворотна реакції aA+bB>dD і dD>aA+bB, то їх швидкості виражаються таким чином:
![]() і
і
![]() .
.
В стані рівноваги хімічної системи швидкості прямої і зворотної реакції рівні.
![]() .
(6.8)
.
(6.8)
 .
(6.9)
.
(6.9)
Отже, рівняння (6.9) виявляє кінетичну роль КС, яка визначає відношення констант швидкостей прямої і зворотної реакцій.
Проте в разі хімічної реакції, хоч і представляється одним стехіометричним рівнянням
![]() ,
(6.10)
,
(6.10)
але протікаючої через декілька елементарних стадій, інтерпретація її кінетичного рівняння утруднена, а залежності між значеннями констант К1 і К2 при відомій величині КС носять складніший характер.
Швидкість такої реакції можна визначити наступним рівнянням:
![]() ,
(6.11)
,
(6.11)
що відображає залежність швидкостей як прямої, так і зворотної реакцій від концентрацій всіх компонентів, що беруть участь у взаємодії.
У рівнянні (6.11) показники степеня при концентраціях реагентів можуть бути цілими, дробовими, позитивними і негативними числами або дорівнювати нулю.
Для стану хімічної рівноваги, коли швидкість реакції по реагенту D рівна нулю (WD=0), рівняння (6.11) матиме вид:
 (6.12)
(6.12)
Константа хімічної рівноваги реакції (6.10) знаходиться таким чином:
 (6.13)
(6.13)
Крім того, справедлива залежність
 (6.14)
(6.14)
Рівняння (6.12) можна привести до виду:
 (6.15)
(6.15)
Для ідеальних систем як Кс, так і К1/К2 залежать тільки від темпера-тури. Таким чином, з урахуванням виразів (6.14) і (6.15) справедлива залежність:
 або
або
 (6.16)
(6.16)
Крім цього, повинні виконуватися умови:
![]() ;
або
;
або
![]()
або
![]() ,
тобто
,
тобто
![]() (6.17)
(6.17)
показники
степеня
![]() визначаються експериментально і не
пов'язані із стехіометричними коефіцієнтами
відповідних реагентів в рівнянні
реакції. Проте вони повинні задовольняти
умовам (6.17).
визначаються експериментально і не
пов'язані із стехіометричними коефіцієнтами
відповідних реагентів в рівнянні
реакції. Проте вони повинні задовольняти
умовам (6.17).
Приклад 6.1.
Для процесу отримання фосгену CO+Cl2-COCl2, експериментально встановлено, що швидкість утворення продукту описується кінетичним рівнянням
![]() Визначити
М.
Визначити
М.
Розв`язок.
Згідно стехіометричному рівнянню, константу хімічної рівноваги цієї реакції можна представити рівнянням

або,
що рівноційно, співвідношенням
 .
.
Показники степеня у встановленому експериментально кінетичному рівнянні мають наступні значення:

тобто М=1. Відношення К1/К2 зводиться до виду вираження КС, наступ-ному із стехіометричного рівняння реакції.
Приклад 6.2.
При утворенні азотної кислоти стехіометричні відношення можуть бути представлені рівнянням 3N2O4 + H2O = 4HNO3 + 2NO
Швидкість
цієї реакції при постійній концентрації
азотної кислоти має вид:
![]()
В
цьому випадку
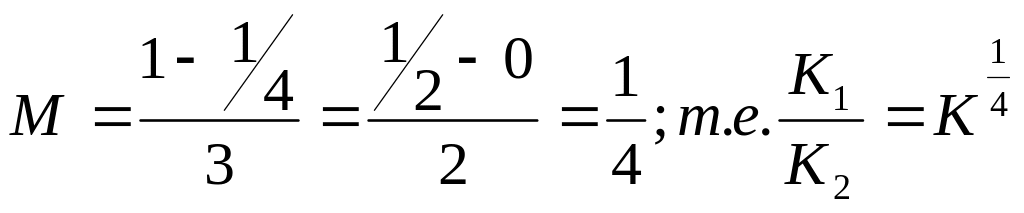
Загальне трактування кінетики послідовних реакцій пов'язане з складними залежностями. У простому випадку реакція відбувається відповідно до рівняння
![]() (6.18)
(6.18)
Якщо обидві проміжні реакції необоротні, мають n=1, а реакційна система має постійний об'єм, то
![]() (6.19)
(6.19)
![]() ;
(6.20)
;
(6.20)
![]() (6.21)
(6.21)
З рівняння (6.18) виходить, що якщо
![]() (6.22)
(6.22)
Інтегруючи рівняння (6.19) в межах 0, τ і СА0,СА, одержуємо:
![]() або
або
![]() (6.23)
(6.23)
Підставивши (6.23) в (6.20), одержимо лінійне диференціальне рівняння першого порядку:
![]() (6.24)
(6.24)
Розв’язок цього рівняння дає хід зміни концентрації реагенту В в часі:
 (6.25)
(6.25)
Враховуючи (6.22)….(6.24), знаходимо вираз, що описує зміну концентрації продукту D під час протікання реакції
![]() ,
(6.26)
,
(6.26)
яке спрощується при К2>>К1 і К1>>К2.
Диференціюючи
рівняння (6.25)
і прирівнюючи нулю
![]() ,
можна визначити момент, в який концентрація
напівпродукту В
досягне
максимальної величини:
,
можна визначити момент, в який концентрація
напівпродукту В
досягне
максимальної величини:
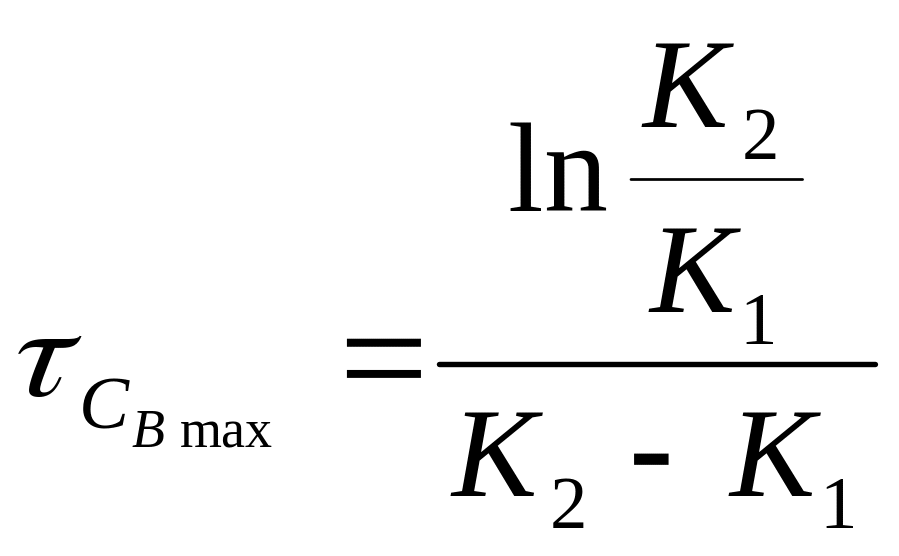 (6.27)
(6.27)
З рівнянь (6.25) і (6.27) знаходиться чисельне значення максимальної концентрації В :
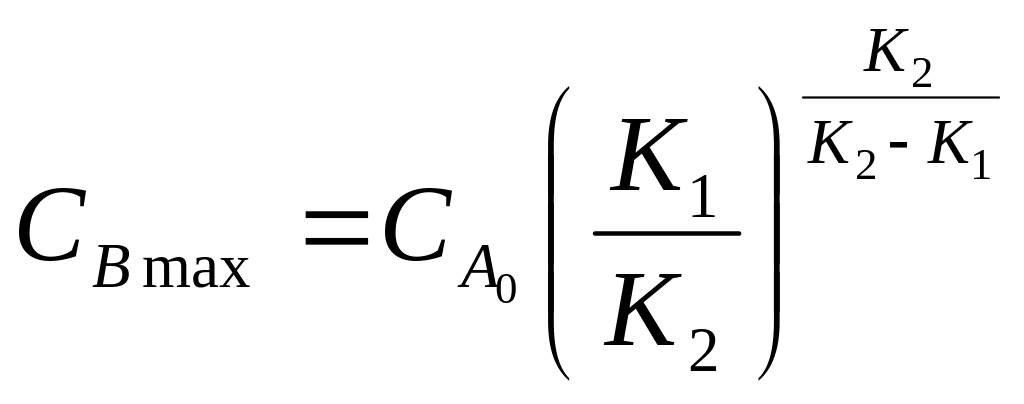 (6.28)
(6.28)
Дуже часто в хімічних процесах одночасно з основним перетворенням має місце одна або декілька побічних реакцій. Найпростіший приклад – дві паралельні необоротні реакції першого порядку, протікаючі при постійному об'ємі:

Звідси, проінтегрувавши останній вираз, одержуємо:
![]()
Розділивши
![]() на
на![]() ,
маємо:
,
маємо:
![]() і після інтеграції:
і після інтеграції:
![]() (при
(при
![]() ).
).
У
складних реакціях такого типу не можна
встановити константи швидкостей по
зміні концентрації тільки одного
реагенту в часі. Визначивши концентрації
двох реагентів, концентрацію третього
знаходимо по балансовому рівнянню
СА+СВ+СD=const.
Потім розраховуємо значення констант
швидкостей, використовуючи кінетичні
рівняння для,
![]() ,
.
,
.
