
- •Механіка
- •Молекулярна фізика
- •10.1. Перше начало термодинамiки. Поняття функції стану I функціоналу. Робота газу при рiзнux процесах.
- •12.1. Рівняння стану реального газу. Ізотерми реального газу.
- •Електрика та магнетизм
- •17.1. Електричне поле. Напруженість електричного поля. Теорема Остроградського-Гаусса. Різниця потенціалів. Зв’язок між напруженістю та різницею потенціалів.
- •10.2. Дифракція на багатомірних гратках. Дифракція рентгенівських променів. Методи рентгеноструктурного аналізу.
- •12.2. Закони теплового випромінювання. Індуковане випромінювання. Лазери.
- •Фізика атома і атомних явищ
- •Фізика ядра та елементарних частинок
- •10.3.Бета-розпад. Види Бетарозпаду. Енергетичнi спектри електронiв. Експерuментальний доказ iснування нейтрино.
- •11.3. Космічні промені. Первинне космічне випромінювання. Проходження космічного випромінювання крізь атмосферу.
- •Теоретична фізика
10.1. Перше начало термодинамiки. Поняття функції стану I функціоналу. Робота газу при рiзнux процесах.
К-ть теплоти, що отримує газ, iде на змiну внутрiшньої енергії та на виконання роботи стороннix сил. δQ = dU +δА
Iнодi l-ий закон термодинамiки формулюють, ще так: змiна внутрiшньої eнepriї визначається сумою наданої кiлькостi теплоти та виконаною роботою над стороннiми силами. dU = δQ + dAcтoр
Функцiя f–наз. функцiєю стану системи, якщо в розгл. cтані має строго визначене значення незалежно вiд способу переходу в цей стан (наприклад, внутрiшня Е, бо визначаеться лише Т). Мала змiна функцiї не залежить вiд способу переходу, а визначається параметрами початкового і кінцевого стану.
Якщо при малiй змiнi стану системи величини якогось iз параметрiв, залежить вiд способу переходу iз початкового в кiнцевий стан, то цей параметр називається функцiоналом. Його мале значення позначаеться δА, δQ i означає малiсть розгляданої величини.
1. Iзохорний процес (V = coпst ). З-н Шарля Р = coпst .
Згiдно l-го з-ну т/д δQ = dU + pdV, dV = О, δА = 0, то δQ = dU:
вся кiлькiсть теплоти, що надається при V = coпst , йде на змiну внутрiшньої енергiї.
2. Iзобарний процес (р = coпst ). З-н Гей-Люссака V = coпst .
δQ = dU + pdV, при р = coпst к-ть теплоти, яка надається системi йде на змiну внутрiшньої eнергії i на виконання роботи.
V2
А1,2 =∫ pdV = p(V2 - V1) = m*R(T2 - Т1),
V1 µ
ΔU = U2 – U1 = і/2*R(T2 – T1),
ΔU = δQ-AI2 =1- 2 = _і_
δQ δQ i+2 i+2
ΔU= і δQ
i+2
3. Iзотермiчний процес (Т = coпst) З-н Бойля-Марiотта рV = coпst .
dT =0 Ậ→dU =і/2*mdТ=0 δQ=δА
Вся кiлькiсть теплоти, яка надається системi при Т = coпst, йде на виконання роботи проти сторонніх сил.
V2 V2
А12 = ∫pdV = ∫ m*RТ dV =m *RТ lnV2
V1 V1 µ V µ V1
4. Адiабатичний процес.
Адiабатичний процес – наз. такий процес змiни стану системи, який проходить без теплообмiну з оточуючим середовищем
δQ = 0, то dU + δА = 0, dU = -δА.
При адiабатичному процесi система виконує додатну роботу проти сторонніх сил тiльки за рахунок зменшення своєї внутрiшньої eнергії.
6.Рівняння стану реального газу. Ізотерми реального газу.
Рівняння стану реального газу. Ізотерми реального газу.
Для
отримання р-ня стану реального газу
необхідно в рівняння стану ід. газу
ввести поправки. які враховують дію сил
притягання і відштовхування між
молекулами. Розглянемо для простоти
1моль газу
 ,
який знаходиться в посудині кубічної
форми.
,
який знаходиться в посудині кубічної
форми.
 -ефективний
діаметр. Молекула може наблизитися до
стінки на
-ефективний
діаметр. Молекула може наблизитися до
стінки на
 .
.
 отже
допустимо, що буде об’єм V,
а
отже
допустимо, що буде об’єм V,
а
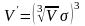 ,
наявність молекул робить також
недоступнім для перебування центру
молекул.
,
наявність молекул робить також
недоступнім для перебування центру
молекул.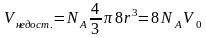 (2). Сфери їх недоступних об’ємів
перекривання, а тому (2) необхідно зменшити
в двічі.
(2). Сфери їх недоступних об’ємів
перекривання, а тому (2) необхідно зменшити
в двічі.
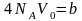 (3) - поправка Ван-дер-Ваальса на власний
об’єм,
то
(3) - поправка Ван-дер-Ваальса на власний
об’єм,
то
 (4).
(4).
В
Ізотерми Ендрюса
 рахуємо
тепер дію сил притягання між молекулами
газу. Будемо вважати, що сили притягання
між молекулами суттєві лише на відстані
R-
радіусом між молекулярної взаємодії.
Виділимо біля стінки посудини, в якій
знаходиться газ прошарок товщиною
рахуємо
тепер дію сил притягання між молекулами
газу. Будемо вважати, що сили притягання
між молекулами суттєві лише на відстані
R-
радіусом між молекулярної взаємодії.
Виділимо біля стінки посудини, в якій
знаходиться газ прошарок товщиною
 .
Всі молекули, які знаходяться біля
стінки на відстанях R
зазнають
не скомпенсованої сили притягання зі
сторони інших молекул газу, яка напрямлена
від стінки посудини.
.
Всі молекули, які знаходяться біля
стінки на відстанях R
зазнають
не скомпенсованої сили притягання зі
сторони інших молекул газу, яка напрямлена
від стінки посудини.
 -
таким би був тиск молекул реального
газу без врахування сил притягання, а
з врахуванням
-
таким би був тиск молекул реального
газу без врахування сил притягання, а
з врахуванням
 (6).
(6).
 ,
яка діє на кожну молекулу
,
яка діє на кожну молекулу
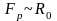 ,
,
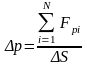 (7)-
визначається сумою сил, що діють на
молекулу біля стінок площею
(7)-
визначається сумою сил, що діють на
молекулу біля стінок площею
 ,
,
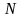 -
число молекул біля стінки посудини
площею
в шарі товщиною
-
число молекул біля стінки посудини
площею
в шарі товщиною
 ,
отже
,
отже
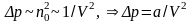 (8)-
постійна Ван-дер-Ваальса, яка враховує
дію сил притягання, між молекулами
реального газу, її значення різне для
різних сортів газу, бо буде різне значення
R
– радіус між молекулярної взаємодії.
(8)-
постійна Ван-дер-Ваальса, яка враховує
дію сил притягання, між молекулами
реального газу, її значення різне для
різних сортів газу, бо буде різне значення
R
– радіус між молекулярної взаємодії.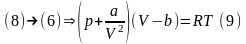 ,
,
 (10)-р-ня
стану реального газу для любої кількості
газу (р-ня Ван-дер-Ваальса). Зробимо
перетворення
(10)-р-ня
стану реального газу для любої кількості
газу (р-ня Ван-дер-Ваальса). Зробимо
перетворення
 -
рівняння 3-го степеня відносно V.
Якщо розглядати
,
то кожне значення p
буде
відповідати 3-ом значенням V.
-
рівняння 3-го степеня відносно V.
Якщо розглядати
,
то кожне значення p
буде
відповідати 3-ом значенням V.
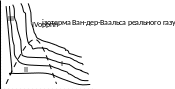
При
різних Т протяжність горизонтальних
ділянок зменшується при підвищені Т і
при деякій
 горизонтальна ділянка на ізотермі
Ендрюса зникає. Цю температуру називають
критичною. На представленій діаграмі
можна виділити 4 області.
горизонтальна ділянка на ізотермі
Ендрюса зникає. Цю температуру називають
критичною. На представленій діаграмі
можна виділити 4 області.
В І обл. рідина в газоподібному стані.
В ІІ обл. відбувається фазове перетворення.
В ІІІ обл. рідина знаходиться в рідкому стані.
В IV обл. знаходиться в критичному стані.
