
- •Механіка
- •Молекулярна фізика
- •10.1. Перше начало термодинамiки. Поняття функції стану I функціоналу. Робота газу при рiзнux процесах.
- •12.1. Рівняння стану реального газу. Ізотерми реального газу.
- •Електрика та магнетизм
- •17.1. Електричне поле. Напруженість електричного поля. Теорема Остроградського-Гаусса. Різниця потенціалів. Зв’язок між напруженістю та різницею потенціалів.
- •10.2. Дифракція на багатомірних гратках. Дифракція рентгенівських променів. Методи рентгеноструктурного аналізу.
- •12.2. Закони теплового випромінювання. Індуковане випромінювання. Лазери.
- •Фізика атома і атомних явищ
- •Фізика ядра та елементарних частинок
- •10.3.Бета-розпад. Види Бетарозпаду. Енергетичнi спектри електронiв. Експерuментальний доказ iснування нейтрино.
- •11.3. Космічні промені. Первинне космічне випромінювання. Проходження космічного випромінювання крізь атмосферу.
- •Теоретична фізика
Молекулярна фізика
1.Розподіл молекул газу за швидкостями, поняття функції розподілу. Розподіл Максвелла та його основні властивості.
2.Основні положення кінетичної теорії газів. Обчислення тиску газів за кінетичною теорією. Закони ідеального газу.
Ідеальний газ – ідеалізована модель газу, у якій нехтується розмірами молекули і взаємодією їх між собою на відстані; Молекули ідеал. газу взаємодіють тільки під час зіткнень за законами пружного удару. Одна з основних власт. ід. газу - його здатність до необмеженого розширення.
О сновним
положенням МКТГ є 1.повна хаотичність
руху мол. газів, тому гази є повністю
ізотропними. 2. середні швидкості
хаотичного тепл. руху мол. газів ~ √Т.
3.Ек мол. різних газів при однаковій Т
рівні між собою.
сновним
положенням МКТГ є 1.повна хаотичність
руху мол. газів, тому гази є повністю
ізотропними. 2. середні швидкості
хаотичного тепл. руху мол. газів ~ √Т.
3.Ек мол. різних газів при однаковій Т
рівні між собою.
Пояснення
природи тиску газу вперше зроблено у
1838 Бернуллі. Тиск газу – результат
великого числа зіткнень мол. із стінками
посудини. Розрах. тиск газу. Для простоти
посудина прямокутної форми. В посудині
односортний газ. Маса мол. mо,
конц.
 .
Розрах. тиск газу на стінку АВСД. Розгл.
зіткнення однієї мол. зі стінкою.
.
Розрах. тиск газу на стінку АВСД. Розгл.
зіткнення однієї мол. зі стінкою.
 ,
t
– час зіткнення. Для такої взаємодії
тангенційні складові імпульсу Py
i
Pz
не змін. Змін. лише нормальна складова
Рх:
,
t
– час зіткнення. Для такої взаємодії
тангенційні складові імпульсу Py
i
Pz
не змін. Змін. лише нормальна складова
Рх:

Сила
зі сторони стінки на мол.:
 За 3 з-ном Ньютона мол. діє на стінку з
силою:
За 3 з-ном Ньютона мол. діє на стінку з
силою:

Число
мол.
 , які за час
, які за час
 провзаємодіяли зі стінкою:
провзаємодіяли зі стінкою:
 (½ врах. хаотичність руху мол. – тільки
половина мол. з об’єму (
(½ врах. хаотичність руху мол. – тільки
половина мол. з об’єму ( )
рухались у напрямку до стінки).
)
рухались у напрямку до стінки).
Тоді:
 .
Аналогічно: Рy
і Рz
отримані в припущенні, що
.
Аналогічно: Рy
і Рz
отримані в припущенні, що
 =
соnst. Насправді ці швидкості різні.
Згідно з-ну Паскаля р газу у всіх напрямках
однаковий, тобто Рх=
Py=
Pz=P.
Тоді Рх+
Py+
Pz=
3P=
=
соnst. Насправді ці швидкості різні.
Згідно з-ну Паскаля р газу у всіх напрямках
однаковий, тобто Рх=
Py=
Pz=P.
Тоді Рх+
Py+
Pz=
3P=
 3P=m0nV2.
3P=m0nV2.
 середнє
значення квадрата швидкості молекул
газу.
середнє
значення квадрата швидкості молекул
газу.
P=
 - основне рівняння МКТГ
- основне рівняння МКТГ
→
 →
→

 -
Т
є мірою середньої Ек
хаотичного тепл. руху мол.
-
Т
є мірою середньої Ек
хаотичного тепл. руху мол.
Закони ідеального газу: 1) рівняння стану ідеального газу
і
 ;
→
;
→ –
рівняння Менделеєва Клапейрона. 2) З-н
Авогадро: в однакових V при однакових р
і Т міститься однакове число молекул
ідеал газу незалежно від його сорту.
V1=V2,
P1=P2,
T1=T2
→
3 (10) : N1=N2
–
рівняння Менделеєва Клапейрона. 2) З-н
Авогадро: в однакових V при однакових р
і Т міститься однакове число молекул
ідеал газу незалежно від його сорту.
V1=V2,
P1=P2,
T1=T2
→
3 (10) : N1=N2
3)
З-н Дальтона: р суміші газів = сумі
парціальних р. (парціальний р – це р,
який ств. би мол. певного сорту, якщо б
мол. інших сортів були вилучені з
посудини). 4) З-н Бойля-Маріотта: для даної
маси газу при постійній Т добуток р газу
на його V є величиною сталою:
 5) З-н Гей-Люссака: для даної маси газу
при
5) З-н Гей-Люссака: для даної маси газу
при
 відношення V газу до Т є постійним
відношення V газу до Т є постійним
 6)
Закон Шарля: для даної маси газу при
6)
Закон Шарля: для даної маси газу при
 :
:


В області абсолютного нуля закони ідеал. газу не виконуються.
3.Газ у полі сили тяжіння. Барометрична формула. Розподіл Больцмана.
При розгляді молекул ідеального газу вважалося, що рух молекул газу є повністю хаотичним і молекули газу рівномірно розприділені по всьому об’єму. Проте із-за дії на мол. газу сили тяжіння, густота мол. змінюється з висотою, відповідно змін. з висотою і тиск газу. Тому, узагальнюючи, можна сказати, що поведінка мол. газу та розподіл їх з висотою визнач. двома основними факторами:
завдяки дії сили тяжіння, всі молекули газу повинні б розташуватися в обл. min Еп, тобто всі мол. повинні впасти на дно посудини «в якій знаходяться»;
але завдяки тепловому рухові, який намагається привести до максимально рівномірного розподілу газу в об’ємі, «мол. газу не падають на дно і не встановлюється відповідний розподіл мол. газу з висотою в полі тяжіння.
Отримаємо цей закон розподілу мол. з висотою. Для простоти міркувань будемо розгл. односортний газ, маси молекул якого mо, який знаходиться при температурі Т- однаковій по всьому об’єму.

Зміни тиску: dР=Р(h + dh) –Р(h) визначається згідно закону Паскаля вагою вертикального стовпа газу висотою над одиничною площею ( S=1), тобто: dР=-ρgdh
«-» виражає, що із збільшенням висоти тиск зменшується.
ρ=n(h)mo– густина газу на висоті h.
Тоді dР=-mogn(h)dh
Використовуючи співвідношення Р= nkT отримаємо:
dР= kTdn (4)
Порівнявши останні два вирази: -mogn(h)dh= kTdn
Розділяючи змінні, отримаємо: dn = -mog dh
n(h) kT
Проінтегруємо ln n(h)= -mogh /kT + с
n(h)=е-mgh /kT + с
Постійну інтегрування знаходимо з початкових умов при h=0,
n= n0, р=р0: n(h)= n0 е-mgh /kT + с - закон зміни концентрації мол. в гравітаційному полі Землі. Отримаємо закон зміни густини та тиску з висотою ρ(h)= mon(h)= ρ0 е-mgh /kT
р(h)= n(h)kT= р0 е-mgh /kT - барометрична формула, що описує зміну тиску з висотою в гравітац. полі Землі.
У виразах mgh представляє собою Еп газу в гравітаційному полі Землі. Тому узагальнимо закон зміни густини з висотою на випадок будь-якого потенціального поля, в якому знаходяться частки термодинамічної системи. Ми отримаємо розподіл Больцмана для часток системи в потенціальному полі: n= n0 е-Еп /kT
4.Перше начало термодинаміки. Поняття функції стану і функціоналу. Робота газу при різних процесах.
Кількість теплоти, що отримує газ іде на зміну внутрішньої енергії та на виконання роботи сторонніх сил.

іноді 1-ий закон термодинаміки формулюють, ще так:
Зміна
внутрішньої енергії визначається сумою
наданої кількості теплоти та виконання
роботи над сторонніми силами. 
Функція f – називається функцією стану системи, якщо в розгляданому стані має строго визначене значення незалежно від способу переходу в цей стан.(наприклад внутрішня енергія, бо визначається лише температурою). Мала зміна функції не залежить від способу переходу, а визначається параметрами початкового і кінцевого стану
Якщо
при малій зміні стану системи величини
якогось із параметрів, залежить від
способу переходу із початкового в
інцевий стан, то цей параметр називається
функціоналом
і
мале його значення позначається (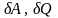 )
і означає малість розгляданої величини.
)
і означає малість розгляданої величини.
Ізохорний процес ( ). З-н Шарля
згідно
1-го з-ну т/д
 ,
,
 то
то

вся кількість теплоти, надається при йде на зміну внутрішньої енергії.
Ізобарний процес (
 ).
З-н Гей-Люссака (
)
).
З-н Гей-Люссака (
)
, при кількість теплоти, яка надається системі йде на зміну внутрішньої енергії і на виконання роботи.
 ,
,
 ,
,
 ,
,
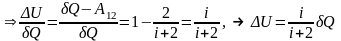
Ізотермічний процес (
 )
З-н Бойля-Маріотта
)
З-н Бойля-Маріотта

 ,
вся кількість теплоти, яка надається
системі при
йде на виконання роботи прити сторонніх
сил.
,
вся кількість теплоти, яка надається
системі при
йде на виконання роботи прити сторонніх
сил.

Адіабатичний процес.
Адіабатичний
процес – називається такий процес зміни
стану системи, який проходить без
теплообміну з оточуючим середовищем
 0,
то
0,
то
 .
.
При адіабатичному процесі система виконує додатну роботу проти сторонніх сил тільки за рахунок зменшення своєї внутрішньої енергії.
5.Цикл Карно. Розрахунок коефіцієнта корисної дії теплової машини, яка працює за циклом Карно. Поняття ентропії системи та розрахунок її зміни при різних процесах. Фізична суть ентропії.
Цикл Карно. Нерівність Клаузіуса. Поняття ентропії та розрахунок її зміни при різних процесах.
Найбільш простим по суті, але більш важливим є циклічний процес, який складається з двох ізотермічних і двох адіабатичних ділянок цей цикл називають цикл Карно.
 газ
ізотермічного розширення весь час
отримує теплоту від нагрівника і всю
її перетворює в роботу
газ
ізотермічного розширення весь час
отримує теплоту від нагрівника і всю
її перетворює в роботу
 .
На ділянці 23 виконує додатню роботу за
рахунок зменшення внутрішньої енергії,
при цьому зменшується температура від
.
На ділянці 23 виконує додатню роботу за
рахунок зменшення внутрішньої енергії,
при цьому зменшується температура від


на
ділянці 34 газ ізотермічно стискається
і віддає при цьому відповідну кількість теплоти. Точка 4 вибирається
таким чином, що адіабатичним стисненням
газ можна повернути у початковий стан.
На ділянці 41 газ із-за адіабатичного
стиснення збільшує свою температуру і
виконує при цьому від’ємну роботу
кількість теплоти. Точка 4 вибирається
таким чином, що адіабатичним стисненням
газ можна повернути у початковий стан.
На ділянці 41 газ із-за адіабатичного
стиснення збільшує свою температуру і
виконує при цьому від’ємну роботу

теор.
Карно:
ККД теплової машини, яка працює при
певних значеннях
 не
може бути більшим ніж ККД теплової
машини, яка працює за циклом Карно при
тих самих
.
не
може бути більшим ніж ККД теплової
машини, яка працює за циклом Карно при
тих самих
.

 -
нерівність
Клаузіуса
„=” до оборотних процесів і „<”,
для необоротних кругових процесів.
Величина
-
нерівність
Клаузіуса
„=” до оборотних процесів і „<”,
для необоротних кругових процесів.
Величина
 є
функцією стану, бо її зміна при переході
з одного стану в інший не залежить від
способу переходу, а визначається
початковим і кінцевим станом.
є
функцією стану, бо її зміна при переході
з одного стану в інший не залежить від
способу переходу, а визначається
початковим і кінцевим станом.
 ,
де S
– ентропія.
,
де S
– ентропія.
Розрахуємо зміну ентропії при різних процесах:
1. Нагрівання тіл.
Щоб
змінити температуру систем на dT
її необхідно надати
 ,
тоді зміна ентропії від
,
тоді зміна ентропії від

 ,
при зростаючій ентропії збільшується
температура, при знижені ентропії –
температура зменшується.
,
при зростаючій ентропії збільшується
температура, при знижені ентропії –
температура зменшується.
2. Фазові переходи І-го роду (зміна агрегатного стану).
Фазові
переходи І-го роду протікають при
фіксованій температурі. ЇЇ називають
температурою фазового переходу і
супроводжується поглинанням (виділенням)
певної кількості теплоти. ,
,
 - питома теплота фазового переходу і
показує, яку кількість теплоти потрібно
надати одиниці маси, щоб речовина зазнала
фазового переходу.
- питома теплота фазового переходу і
показує, яку кількість теплоти потрібно
надати одиниці маси, щоб речовина зазнала
фазового переходу.


3. Ізопроцеси в ід. газі.
 -
загальне співвідношення для зміни
ентропії ід. газу.
-
загальне співвідношення для зміни
ентропії ід. газу.
а)
,
,
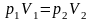

б)


в)

г)
 ,
при адіабатичному процесі ентропія
залишається не змінною із-за цього
адіабатичний процес називається
ізоентропійним.
,
при адіабатичному процесі ентропія
залишається не змінною із-за цього
адіабатичний процес називається
ізоентропійним.
