
- •Ответы к экзамену по физике.
- •Кинематика поступательного движения материальной точки. (путь, перемещение, скорость, ускорение).
- •Ускорение и его составляющие.
- •1,2,3 Законы Ньютона.
- •Импульс тела, сила. Закон сохранения импульса.
- •Центр масс движение центра масс.
- •Уравнение движения тела переменной массы.
- •Кинематика вращательного движения материальной точки.
- •Момент силы.
- •Момент инерции твёрдого тела. Теорема Штейнера.
- •Основное уравнение динамики вращательного движения.
- •Момент импульса. Закон сохранения момента импульса.
- •Работа силы. Мощность.
- •Кинетическая и потенциальная энергия поступательного и вращательного движения.
- •Механическая энергия. Закон сохранения механической энергии.
- •Абсолютно упругий удар.
- •Абсолютно неупругий удар.
- •Поле тяготения, напряжённость, потенциал.
- •Неинерциальная система отсчёта. Силы инерции при ускоренном поступательном движении системы отсчёта.
- •Силы инерции, действующие на тело, покоящееся во вращающейся системе отсчёта.
- •Силы инерции, действующие на тело, движущееся во вращающейся системе отсчёта. Кориолисова сила.
- •Гидростатическое давление, закон Архимеда, закон неразрывности струи.
- •Закон Бернулли.
- •Формула Торричелли.
- •Внутреннее трение (вязкость). Режимы течения.
- •Метод Стокса.
- •Метод Пуазейля.
- •Поверхностное натяжение.
- •Смачивание и не смачивание.
- •Давление под искривлённой поверхностью жидкости. Формула Лапласа.
- •Капиллярные явления.
- •31. Преобразования Галлилея.
- •32. Постулаты сто. Преобразования Лоренца.
- •33. Одновременность событий в разных системах отсчёта.
- •34. Длина тел в разных системах отсчёта.
- •Длительность событий в разных системах отсчёта.
- •36. Основной закон релятивистской динамики материальной точки.
- •Закон взаимосвязи массы и энергии.
- •38. Модель идеального газа. Изозаконы.
- •39. Основное уравнение мкт.
- •40. Распределение молекул идеального газа по скоростям и энергиям теплового движения.
- •41. Барометрическая формула. Распределение Больцмана.
- •Средняя длина свободного пробега молекул.
- •Явление переноса в термодинамически неравновесных системах. Теплопроводность. Диффузия. Внутреннее трение (вязкость).
- •Теплоёмкость.
- •Диффузия.
- •Внутреннее трение (вязкость).
- •44. Число степеней свободы молекулы.
39. Основное уравнение мкт.
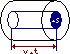
Для вывода основного уравнения МКТ рассмотрим одноатомный идеальный газ. Предположим, что молекулы газа движутся хаотически, число взаимных столкновений между молекулами газа пренебрежимо мало, по сравнению с числом удара о стенки сосуда.
Выделим
на стенке сосуда элементарную площадку
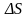 ,
и вычислим давление, оказываемое на
эту площадку. При каждом соударении
молекула, движущаяся перпендикулярно
площадке передаёт ей импульс:
,
и вычислим давление, оказываемое на
эту площадку. При каждом соударении
молекула, движущаяся перпендикулярно
площадке передаёт ей импульс:
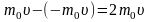 .
За время
площадки достигнут, только те молекулы,
которые находятся в объёме цилиндра с
основанием
и высотой
.
За время
площадки достигнут, только те молекулы,
которые находятся в объёме цилиндра с
основанием
и высотой
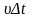 .
Число этих молекул равно
.
Число этих молекул равно
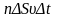 (n-концентрация).
(n-концентрация).
Необходимо
учесть, что реально молекулы движутся
к площадке под разными углами, и имеют
различные скорости, причём скорость
молекул при каждом соударении меняется.
Для упрощения расчётов хаотическое
движение молекул заменяют движением
вдоль 3-х взаимно перпендикулярных
направлений, так что в любой момент
движения вдоль каждого из них движется
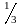 молекул, причём половина молекул (
молекул, причём половина молекул (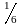 )
движется вдоль данного направления в
одну сторону, половина в другую. Тогда
число ударов молекул, движущихся в
заданном направлении, о площадку
будет
)
движется вдоль данного направления в
одну сторону, половина в другую. Тогда
число ударов молекул, движущихся в
заданном направлении, о площадку
будет
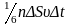 .
При столкновении с площадкой эти
молекулы предадут ей импульс
.
При столкновении с площадкой эти
молекулы предадут ей импульс
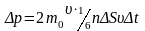
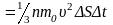 ,
,
тогда давление газа на стенку равно:
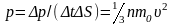
Средняя квадратичная скорость:
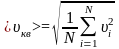
хар-ет всю совокупность молекул газа.
С учётом этой формулы:
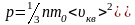
Это и есть основное уравнение МКТ.
Учтя,
что
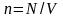 получим:
получим:
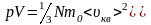 ,или
,или
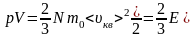 ,
,
где Е – суммарная кинетическая энергия поступательного движения всех молекул.
Т.к.
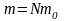 ,
то:
,
то:
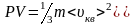
Для одного моля газа m=M ( M – молярная масса):
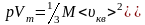 ,
,
где Vm- молярный объём. По уравнению Менделеева – Клапейрона pVm=RT, т.о.:
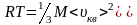 ,
откуда:
,
откуда:
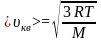
т.к.
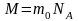 ,
то
,
то
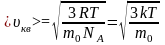 ,
,
где
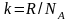 - постоянная Больцмана.
- постоянная Больцмана.
Средняя кинетическая энергия поступательного движения одной молекулы иг:
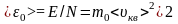
 .
.
40. Распределение молекул идеального газа по скоростям и энергиям теплового движения.
По МКТ, как бы ни изменялись скорости молекул при столкновениях, средняя квадратичная скорость молекул массой m0 в газе, находящимся в состоянии равновесия при Т=const, остаётся равной:
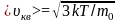
Это объясняется тем, что в газе устанавливается некоторое стационарное распределение молекул по скоростям, которое подчиняется закону Максвелла.
Закон
Максвелла описывается некоторой
функцией
 ,
называемой функцией
распределения молекул по скоростям.
Если разбить диапазон скоростей молекул
на равные малые интервалы
,
называемой функцией
распределения молекул по скоростям.
Если разбить диапазон скоростей молекул
на равные малые интервалы
 ,
то на каждый интервал скорости будет
приходиться некоторое число молекул
,
то на каждый интервал скорости будет
приходиться некоторое число молекул
 ,
имеющих скорость, заключённую в этом
интервале. Функция
определяет относительное число молекул,
,
имеющих скорость, заключённую в этом
интервале. Функция
определяет относительное число молекул,
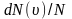 ,
скорости которых лежат в интервале
,
скорости которых лежат в интервале
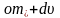 ,
т.е.:
,
т.е.:
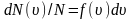
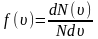 .
.
Применяя методы теории вероятностей Максвелл нашёл функцию - закон для распределения молекул идеального газа по скоростям:
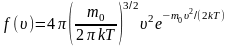 (*)
(*)
Из этого видно, что конкретный вид функции зависит от рода газа (от массы молекулы) и от параметра состоянии (от температуры Т).
Т.к.
при возрастании
множитель
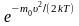 уменьшается быстрее, чем растёт множитель
уменьшается быстрее, чем растёт множитель
 ,
тот функция
,
начиная от нуля достигает максимума
при
,
тот функция
,
начиная от нуля достигает максимума
при
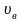 и затем асимптотически стремится к 0.
Кривая не симметрична относительно
.
и затем асимптотически стремится к 0.
Кривая не симметрична относительно
.
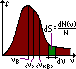
Относительное число молекул находится, как площадь более зелёной плоскости на рисунке. Площадь, ограниченная кривой распределения и осью абсцисс, равна единице. Это означает, что функция удовлетворяет условию нормировки.

Наиболее вероятная скорость – скорость, при которой функция распределения молекул идеального газа по скоростям максимальна.
Значение наиболее вероятной скорости можно найти продифференцировав выражение (*) по аргументу , приравняв результат 0 и используя условие для максимума выражения :
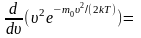
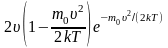
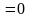
Значения
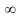 и 0 соответствуют минимумам выражения
(*), а значение
,
при котором значение в скобках становится
равным нулю, и есть искомая наиболее
вероятная скорость
и 0 соответствуют минимумам выражения
(*), а значение
,
при котором значение в скобках становится
равным нулю, и есть искомая наиболее
вероятная скорость
 :
:
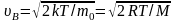
Из этой формулы следует, что при повышении Т максимум функции стремится вправо (значение наиболее вероятной скорости становится больше). Однако площадь, ограниченная кривой остаётся неизменной, поэтому кривая будет растягиваться и понижаться.
Средняя
скорость молекулы
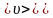 (средняя
арифметическая скорость)
определяется по формуле:
(средняя
арифметическая скорость)
определяется по формуле:
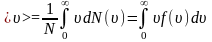 ,
,
подставляя сюда и интегрируя получим:
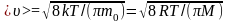
Скорости характеризующие состояние газа:
1)
Наиболее вероятная:
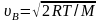
2)
средняя:
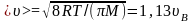
3)
средняя квадратичная:
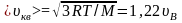
Исходя из распределения молекул по скоростям
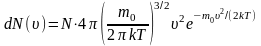
Можно найти распределение молекул газа по значениям кинетической энергии .
Учтя,
что
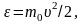
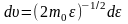 получим:
получим:
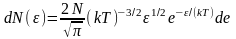
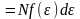 ,
,
где
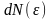 - число молекул, имеющих кинетическую
энергию в интервале от
до
- число молекул, имеющих кинетическую
энергию в интервале от
до
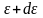 .
.
Функция распределения молекул по энергиям теплового движения
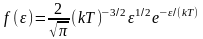 .
.
Средняя
кинетическая энергия
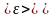 молекулы идеального газа
молекулы идеального газа
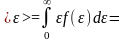
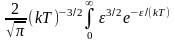 .
.
