
- •1.Техническая тд как теоретическая основа теплоэнергетики.
- •2.Первый закон термодинамики как закон сохранения и превращения энергии
- •3.Термодинамические свойства и процессы идеального газа
- •4.Смеси (смесь) идеальных газов
- •5.Обратимые и необратимые процессы.
- •6.Возрастание энтропии изолированной системы
- •7.Эксергия как мера работоспособности системы
- •8.Статистический смысл второго закона тд
- •9.Характеристические функции и дифференциальные уравнения
- •10.Формулировки и аналитическое выражение третьего закона тд гипотеза планка абсолютная энтропия
- •10.Третий закон тд
- •Отметим, что в модели идеального газа т. Н. Места нет!
- •Закон Дальтона нарушается
- •13. Вириальное уравнение состояния для умеренно сжатых газов.
- •14. Принцип соответственных состояний и подобие
3.Термодинамические свойства и процессы идеального газа
Основные характеристики: p, v, T
Основные свойства определяются принятой моделью - моделью идеального газа.
Внутренняя энергия идеального газа - сумма энергий всех видов движения всех молекул (микрочастиц), из которых состоит газ (внутренняя потенциальная энергия - потенциальная энергия взаимодействия между молекулами и внутримолекулярная энергия считаются равными нулю).
УРАВНЕНИЕ СОСТОЯНИЯ КЛАПЕЙРОНА-МЕНДЕЛЕЕЕВА (Уравнение состояния идеального газа)
Уравнение состояния - функция, описывающая связь p, v, T
pv=RT - уравнение Клапейрона
pV=(m/)RT - уравнение Клапейрона-Менделеева
![]()
где v-удельный объем газа, -молярная масса газа, Т-температура в 0К,
R=8,314 Дж/(кмоль*К)- универсальная газовая постоянная,
![]() -
постоянная Больцмана
-
постоянная Больцмана
![]() -
постоянная Авогадро
-
постоянная Авогадро
МОЛЕКУЛЯРНО-КИНЕТИЧЕСКАЯ ТЕОРИЯ ТЕПЛОЕМКОСТИ ГАЗОВ
Микрочастицы (молекулы, атомы), из которых состоит газ, могут совершать, в общем случае, три типа движений: поступательное, вращательное, колебательное.
Атом как материальная точка может совершать только поступательное движение в трех направлениях (три степени свободы - i=3).
Молекула, состоящая из двух атомов, как система, состоящая из двух материальных точек, может совершать поступательное движение в трех направлениях (три с.с.), вращательное движение вокруг двух осей (две с.с.) и, при определенных условиях, колебательные движение вдоль оси соединяющей атомы (одна или более с.с.). Общее число с.с. (без учета колебательных) i=5.
Молекула, состоящая из трех атомов, как система, состоящая из трех материальных точек, может совершать поступательное движение в трех направлениях (три с.с.), вращательное движение вокруг трех осей (три с.с.) и, при определенных условиях, различные колебательные движение вдоль осей соединяющей атомы (одна или более с.с.). Общее число с.с. (без учета колебательных) i=6.
Как показано в молекулярно-кинетической теории на каждую поступательную или вращательную степень свободы каждой микрочастицы приходится энергия равная (1/2)kT (закон равномерного распределения энергии по степеням свободы). Таким образом, для одного моля газа (число микрочастиц равно числу Авогадро N), внутренняя энергия газа:
![]()
Тогда теплоемкость газа при постоянном объеме:
![]()
Без учета колебательных степеней свободы:
Для газа, состоящего из одноатомных молекул, Сv=(3/2)R
Для газа, состоящего из двухатомных молекул, Сv=(5/2)R
Для газа, состоящего из трехатомных молекул, Сv=(6/2)R
ЗАВИСИМОСТЬ ТЕПЛОЕМКОСТИ ИДЕАЛЬНОГО ГАЗА ОТ ТЕМПЕРАТУРЫ
Теплоемкость [С]= [Дж/К] – кол-во теплоты, необх. для нагрева тела на 1 градус(экстенсивное свойство вещества).
Производная от кол-ва теплоты по температуре
 .
.
Удельная (массовая) теплоемкость [c]- теплоемкость единицы количества вещества.
Объемная теплоемкость
![]()
![]() – отношение теплоемкости тела к его
объему при н.у.
– отношение теплоемкости тела к его
объему при н.у.
Молярная теплоемкость
![]() .
.
Связь между
вышеуказанными теплоемкостями
![]() где
где
![]() - соответственно плотность и объем 1
моль вещ. при н.у.
- соответственно плотность и объем 1
моль вещ. при н.у.
![]() (*)
где
(*)
где
![]() уд.работа,
зависящая от процесса.
уд.работа,
зависящая от процесса.
Обозначим
![]() теплоемкость
ид.газа при нагреве соответственно при
теплоемкость
ид.газа при нагреве соответственно при
![]() .
.
При
![]()
При
![]() .
.
Т.о. при изохорном
нагреве подведенная энергия
![]() Дж
тратится только на увеличение внутренней
энергии, а при изохорном нагреве энергия,
равная R
Дж расходуется на совершение работы.
Дж
тратится только на увеличение внутренней
энергии, а при изохорном нагреве энергия,
равная R
Дж расходуется на совершение работы.
Средняя теплоемкость
данного процесса в интервале температур
от
![]() до
до
![]() называется соотношение
называется соотношение
![]() .
Рис
3.5
.
Рис
3.5
ЭНТАЛЬПИЯ ИДЕАЛЬНОГО ГАЗА
Дифференцируя
![]()
![]()
Изменение энтропии
Из первого закона
термодинамики
![]() покажем, что dq/T
– полный диффернциал:
покажем, что dq/T
– полный диффернциал:
![]() (*).
(*).
В последнем равенстве выполняется условие взаимности
![]()
Тогда
![]() (*).
(*).
Аналогично
![]() (**)- уравнение состояния идеального газа
в дифф. форме.
(**)- уравнение состояния идеального газа
в дифф. форме.
При подстановке в (*) значений dp/p и dv/v из(**) получим:
![]()
![]()
![]()

ОСНОВНЫЕ ПРОЦЕССЫ ИДЕАЛЬНЫХ ГАЗОВ
Изохорный процесс(V=const)
![]()
Работа расширения
газа
![]()
Изменение энтропии
![]() ,
,
А при
![]()
Так как
,
то
![]() ,
т.е. все подведенное тепло расходуется
на увеличение внутренней энергии. По
диаграмме T-s
dl
равна площади под кривой.
,
т.е. все подведенное тепло расходуется
на увеличение внутренней энергии. По
диаграмме T-s
dl
равна площади под кривой.
Рис. 4.2,4.3
Из (*)
установим расположение изохор и при
T=const
![]() ,
т.е. расстояние мужду изохорами не
зависит от Т. Рис.4.4
,
т.е. расстояние мужду изохорами не
зависит от Т. Рис.4.4
Изобарный процесс (p=const)
![]()
Рис. 4.5
Работа расширения
![]()
Рис.4.6
Для изобары
![]()
![]()
Кол-во теплоты
![]()
По T-s диаграмме можно определить:
q как площадь под кривой.
Истинную теплоемкость как касательную под кривой.
Расстояние между
изобарами не зависит от температуры,
т.е. при T=const
получим
![]() ,
т.е. изобары не пересекаются. Рис.4.7
,
т.е. изобары не пересекаются. Рис.4.7
Если изохора и
изобара выходят из одной точки, то линия
изохоры будет более крутой, т.к.
![]() .
Рис.4.8
.
Рис.4.8
Определим долю теплоты, затраченной на работу в изобарном процессе:
![]()
С учетом![]() .
.
Изотермический
процесс
(T=const)
![]()
В p-v координатах график – парабола. du=0, di=0 => 1-й з-н ТД примет вид dq=pdv.
Работа расширения
![]() .
.
По p-v диаграмме работа равна площади под кривой (рис.4.9). По T-s диаграмме теплота равна площади под кривой(рис.4.10).
Т.к.
T=const и
dT=0,
![]() .
.
Адиабатный процесс(dq=0)
Уравнение 1-го з-на
ТД примет вид du+dl=0
u
![]() ,
а при
,
а при
![]() ,
откуда видно , что при адиабатном процессе
работа расширения совершается за счет
убыли внутренней энергии.
,
откуда видно , что при адиабатном процессе
работа расширения совершается за счет
убыли внутренней энергии.
![]()
Дифф. ур.
![]() ,
совместим 2 последних ур-я
,
совместим 2 последних ур-я
![]()
Уравнение адиабаты
примет вид
![]() ,
так как величина k>0,
то устанавливаем, что в p-v
координатах адиабата круче
изотермы.(рис.4.11),
где работа – площадь под кривой.
,
так как величина k>0,
то устанавливаем, что в p-v
координатах адиабата круче
изотермы.(рис.4.11),
где работа – площадь под кривой.
Представим другие определения работы в адиабатном процессе:



Во многих задачах известны p1 и v1=>
 .
.
Можно установить ур-я адиабаты в v-p и p-T координатах:
![]()
По T-s диаграмме (рис.4,12) можно установить как площадь под изохорой.
Политропный процесс
Соотношение между
параметрами устанавливаются по
определенной форме:
![]() ,
где n
– показатель политропы: для порцесса
,
где n
– показатель политропы: для порцесса
изохорного
 ;
;изобарного
 ;
;изотермического
 ;
;адиабатного
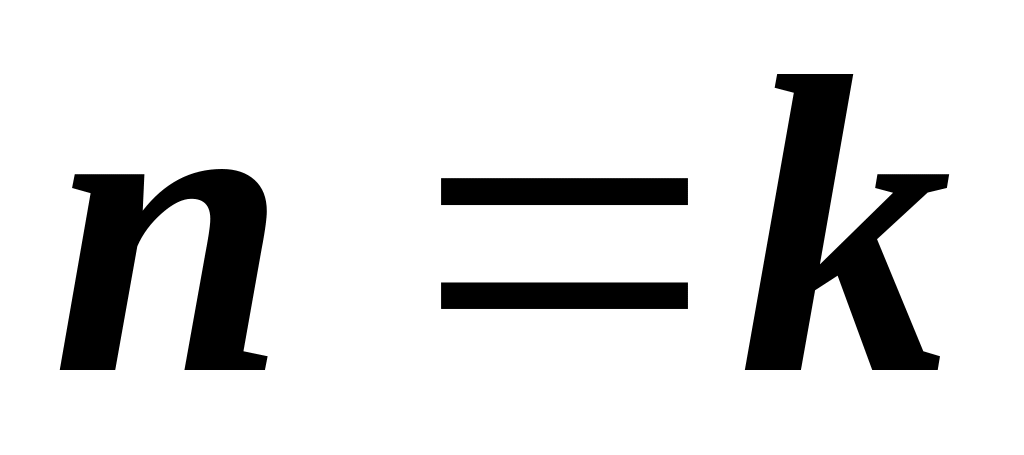 ;
;
Выясним физический
смысл показателя политропы. Представим
1-й з-н ТД в виде
![]() ,
где с – теплоемкость политропного
процесса=>
,
где с – теплоемкость политропного
процесса=>![]()
Продолжим
преобразования:
![]() =>
=>
![]() =>
=>![]() .
.
Обозначим
![]() и после подставления получим уравнение
политропы
.
и после подставления получим уравнение
политропы
.
Получение ф-л
работы при политропном процессе не
отличается от адиабатного процесса
(см.выше):
![]() .
.
Формула определения теплоемкости
![]()
![]()
Также h
можно определить из
![]() и тогда
и тогда
![]()
Тогда для процессов
изохорного с=сv;
изобарного с=ксv=cp;
изотермического с=
 ;
;адиабатного с=0.
