
- •1.Техническая тд как теоретическая основа теплоэнергетики.
- •2.Первый закон термодинамики как закон сохранения и превращения энергии
- •3.Термодинамические свойства и процессы идеального газа
- •4.Смеси (смесь) идеальных газов
- •5.Обратимые и необратимые процессы.
- •6.Возрастание энтропии изолированной системы
- •7.Эксергия как мера работоспособности системы
- •8.Статистический смысл второго закона тд
- •9.Характеристические функции и дифференциальные уравнения
- •10.Формулировки и аналитическое выражение третьего закона тд гипотеза планка абсолютная энтропия
- •10.Третий закон тд
- •Отметим, что в модели идеального газа т. Н. Места нет!
- •Закон Дальтона нарушается
- •13. Вириальное уравнение состояния для умеренно сжатых газов.
- •14. Принцип соответственных состояний и подобие
14. Принцип соответственных состояний и подобие
ТД-СВОЙСТВ ВЕЩЕСТВ
Термодинамическое подобие:
Для веществ в уравнения состояния которых входит не более 2-х индивидуальных постоянных,
(как например в уравнении В-д-В) можно составить единое уравнение состояния через т.н.
приведенные параметры:
π=р/рk , τ=Т/Тk, φ=v/vk
Тогда для данной группы веществ, для которых справедливы вообще говоря разные уравнения состояния можно составить единое уравнение в приведенных параметрах вида:
π =ƒ(φ,τ)
Например для группы В-д-В:
(π+3/φ2)(3φ-1)=8τ
Величина RTk/(рkvk) - критический коэффициент - 2,67 (для всех ВдВ веществ)
Состояния с одинаковыми π, τ, φ называется соответственными состояниями (критические состояния всех веществ является соответственными, поскольку π, τ, φ одинаковы и равны 1)
Закон соответственных состояний:
если несколько веществ удовлетворяют одному и тому же уравнению и имеют одинаковые два из трех приведенных параметров, то и третий приведенный параметр будет у них одинаков.
Такие вещества называются ТД-подобными.
Для них одинаковыми является также приведенные значения теплоемкостей и всех приведенных ф-й состояния:
u c /R ; (S - S0 )/R ; (U - U0 )/(T R ) и т.д.
Это позволяет на одной диаграмме (например π-φ для различных τ) или в одной таблице описывать ТД-свойства целой группы веществ. Такие диаграммы и табл. часто приводятся в справочниках и задачниках.
Для уравнения ВдВ-газа:
(π+3/φ2)(3φ-1)=8τ
Д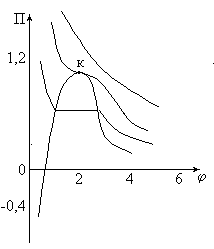 иаграмма
имеет вид:
иаграмма
имеет вид:
Соответствующие диаграммы могут быть построены и для других термодинамически подобных веществ:
Подобие сохраняется и для 2-хфазных состояний.
Поэтому при одинаковых τ будут одинаковы и π и φ насыщенного пара.
Это также позволяет по известным с веществам одного вещества определить с вещества других ТД-подобных ему веществ (без их экспериментального изучения).
ZP-ДИАГРАММА
реальный газ
Существует т.н. коэффициент сжимаемости z=pv/RT, отличие его от 1 характеризует отличие РГ от ИГ. Величина z=f(p,T, рода газа).
Термины:
Давление: отношение силы (ее составляющей, направленной перпендикулярно к поверхности), действующей на поверхность к площади контакта с поверхностью
p=F/S
[p]=Па=1H/1м
Давление газа: результат ударов о поверхность (например стенок сосуда) непрерывно и хаотически движущихся молекул (результат усредненный по времени и площади поверхности).
Для идеального газа p=nmw /3, где n-концентрация молекул, m-масса молекулы, w-средняя квадратичная скорость молекулы.
Диаграмма состояния ТС
Идеальный газ: физическая модель, в которой под газом понимается совокупность непрерывно и хаотически движущихся, не взаимодействующих между собой на расстоянии материальных точек, сталкивающихся друг с другом по закону абсолютно упругого удара. (При давлении близком к атмосферному все газы удовлетворительно описываются с помощью этой модели; объемом молекул по сравнению с объемом занимаемым газом в целом в этой модели пренебрегают).
Материальная точка (модель): тело, имеющее массу, но не имеющее размеров
Модель (физическая, математическая, химическая и т.д.):
Окружающая среда - другие тела и системы, окружающие ТС и не являющиеся объектом исследования в ТД.
Параметры состояния - характеристики состояния вещества (величины, определяющие состояние вещества) - физические величины, характеризующие макроскопические свойства системы (плотность, энергия, вязкость, намагниченность, поляризация и т.д.)
Параметры состояния "интенсивные" - характеристики состояния вещества, не зависящие от количества вещества (давление, температура, ........).
Параметры состояния "термодинамические" - интенсивные параметры состояния ТС
Основными ТД параметрами состояния являются давление, температура, удельный объем.
Параметры состояния экстенсивные - характеристики состояния вещества, зависящие от количества вещества (объем, ........)
Работа сжатия - механическая работа, совершаемая окружающей средой при сжатии ТС.
L'=p'dV или L'=p'(V0-V)
Состояние рабочего тела: его положение в системе ТД-координат (ТД-параметров)
Статистический метод - метод изучения свойств макроскопических систем на основе анализа (с помощью методов математической статистики) закономерностей теплового движения огромного числа микрочастиц, образующих эти системы.
Температура: мера средней внутренней кинетической энергии газа
Термодинамическая поверхность - графическое или аналитическое представление функции состояния F(p,v,T)=0
Термодинамическая система (ТС) - объект исследования в ТД (совокупность макроскопических объектов (тел, полей), обменивающихся энергией в форме работы и теплоты как с друг другом, так и с окружающей средой).
Замкнутая (или изолированная) ТС - если отсутствует всякий обмен энергией между ТС и окружающей средой.
Термодинамический процесс: процесс изменения состояния (параметров) ТД-системы.
Термодинамический метод исследования - метод, использующий законы (начала) ТД и следствия из них (ТД построена дедуктивно: следствия, частные выводы получены из двух законов). Существует другой подход - статистический, в основе которого лежит молекулярно-кинетическая теория, квантовая механика и т.д.
Удельный объем: v=V/m, где V-объем занимаемый газом, m - его масса.
Уравнение состояния.
Флуктуация: Вероятность данного значения флуктуации.
Функция состояния: величина (параметр) ТС, значение которой не зависит от процесса (пути), в результате которого ТС пришла в данное состояние.
Физическая ТД: ТД физических превращений (фазовых превращений, термоэлектрических и магнитных явлений, излучения, поверхностных явлений и т.д.).
Химическая ТД: ТД химических превращений.
Число степеней свободы частицы: число независимых (не являющихся комбинацией других)движений в которых может участвовать данная частица.
Или: число независимых координат, которыми может быть описано движение частицы.
