
- •1. Атом, изотоп, химический элемент, вещество ( простое, сложное, реальное, раствор, смесь).
- •2. Способы выражения состава раствора. Концентрация (молярная, моляльная, массовая доли).
- •3. Квантово-механическая модель атома, квантовые числа, типы атомных орбиталей.
- •4. Основные принципы заполнения Атомных Орбиталей электронами. Принцип Паули, правило Хунда.
- •5. Периодическая система элементов (псэ). Закономерности изменения радиуса атомов химических элементов и электроотрицательности в периодах и группах псэ.
- •6. Химическая связь: природа, основные виды и свойства.
- •1. Энергия связи.
- •3. Валентный угол.
- •4. Полярность.
- •5. Дипольный момент.
- •7. Валентность, степень окисления атома элемента в химическом соединении.
- •8. Ковалентная связь. Насыщаемость, направленность. Строение, структурные формулы. Св-ва веществ.
- •9. Ионная связь, ее свойства. Строение и св-ва веществ с ионной связью. Примеры веществ с ионной связью.
- •10. Металлическая связь и ее свойства. Строение и свойства веществ с металлической связью.
- •11. Типы химических превращений. Уравнения химических реакций в ионно-молекулярной форме.
- •12. Основные законы термохимии ( закон Гесса, закон Лавуазье-Лапласа) и следствия из них.
- •13. Стандартная энтальпия образ в-ва (сложного, простого). Теплов эффект хим превращения, расчет.
- •14. Стандартная энтропия вещества (простого, сложного). Расчет изменения энтропии в химической реакции.
- •6 Частиц (6 ионов):
- •15. Опр направления хим р-ции по термодинамич ф-циям состояния. Энергия Гиббса, расчет.
- •16. Обратимые реакции. Хим равновесие. Закон действующих масс. Константы равновесия
- •17. Равновесие диссоциации слабых к-т и основ. Константа диссоци. З-н разбавления Оствальда. Расчет рН.
- •18. Равновесие гидролиза солей. По катиону,по аниону, рН водных р-ров солей, константа гидролиза.
- •19. Пр малорастворимых соединений . Расчет р-римости соли и концентрации ионов по значению пр.
- •20. Уравнение скорости простой и сложной химической реакции. Порядок и молекулярность реакции.
- •22. Зависимость скорости реакции от температуры ( уравнение Аррениуса, правило Вант-Гоффа).
- •23. Катализ. Гомогенный, гетерогенный и ферментативный катализ.
- •24. Комплексные соединения. Типичные комплексообразователи и лиганды. Координационное число.
- •25. Константа нестойк. Расчет концентрац ионов ко и лигандов в растворе комплексной соли по Кн.
- •26. Химические свойства комплексных солей
- •27. Растворы. Физико-хим взаимодействия в растворах. Сольватация, гидратация, ассоциация, диссоциация.
- •28. Коллигативные свойства растворов. Осмос. Закон Вант-Гоффа.
- •29. Коллигативные св-ва р-ров. Ткип и Тзамерз р-ров. Следствия из з-на Рауля. Определение состояния вещества в р-ре (электролит, неэлектролит, ассоциат) по коллгативным свойствам.
- •30. Коллоидные растворы. Дисперсные системы, классификация, области их применения.
- •31. Строение мицеллы. Правило Пескова-Фаянса. Адсорбция. Св-ва коллоидных р-ров (агрегативная и кинетическая устойчивость, седиментация, коагуляция, оптические и электрические).
- •32. Методы получения и разрушения коллоидных систем.
- •33. Окислительно-восстановительные сис. Степ окисл. Процессы ок и вос. Пр типичных ок и восстанов.
- •35. Окислительно-восстановительная двойственность на примере н2о2 и NaNo2.
- •36. Электрохимические процессы. Двойной электрич слой на границе электрод/электролит.
- •37. Типы электродов (I рода (Ме и НеМе); газовые электроды (водородный и кислородный); ок-вос электроды). Ур-ние Нернста для электрод потенциала. Стандарт водородный электрод как.
- •38. Гальванические элементы. Электродвижущая сила (эдс) гальванических элементов. Токообразующая реакция гальванических элементов.
- •39. Обратимые гальванические эл-ты (аккумуляторы), необратимые гальванические эл-ты (сухие элементы).
- •1) Прямой процесс(работа, т.Е. Получение эл. Тока )
- •2) Обратный процесс(приобретение эл. Энергии (зарядка))
- •2) Обратный процесс
- •40. Коррозия. Хим и электрохим коррозия Ме. Электрохим коррозия Ме в кислой среде ( Fe/Zn и Fe/Sn).
- •41. Методы защиты от коррозии. Защитные покрытия, катодная и протекторная защита от коррозии.
- •42. Лантаноиды (4-f элементы). Особенность электронного строения. Лантаноидное сжатие. Лантаноиды с переменной степенью окисления.
- •43. Свойства соединений церия и европия в разных степенях окисления. Получение и области применения.
- •44. Актиноиды (5-f элементы). Особенность электронного строения. Актиноидное сжатие. Изменение степени окисления в ряду актиноидов.
- •45. Свойства урана и его соединений в разных степенях окисления. Получение и области применения.
- •1.Свойства гидроксидов:
- •Гидролиз:
- •46. Свойства тория и его соединений. Получение и области применения.
- •47. Радиоактивность и радиохим превращения веществ. Стабильные и нестабильные изотопы. Применение.
- •48. Основные виды ионизирующего излучения.
- •49. Реакции радиоактивного распада. Период полураспада. Ядерные реакции.
- •50. Современные методы разделения и очистки веществ на примерах очистки воды, воздуха, извлечения и разделения актиноидов. Химические методы, ионообменная сорбция, экстракция.
19. Пр малорастворимых соединений . Расчет р-римости соли и концентрации ионов по значению пр.
Малорастворимые и нерастворимые соли ограниченно растворимы, но то, что растворяется, распадается на ионы как сильные электролиты.
Ag3РO4 тв↔3Ag+р-ре + РO43-р-ре
С=const
В растворах малорастворимых солей устанавливается гетерогенное равновесие между твёрдой нерастворимой солью и ионами этой соли в водном р-ре - состояние насыщенного раствора.
Это равновесие характеризуется константой – Произведением Растворимости (ПР)
ПР=Кс=С3(Ag+)*C(РO43-)= const (при T= const)
Произведение растворимости - произведение равновесных концентраций ионов соли в её насыщенном р-ре при данной температуре, возведенных в степень = стехиометрич коэф. (эта величина постоянная, табличная)
Насыщенный р-р – раствор, соединяющий мах возможное кол-во растворенного в-ва, при данной t, находящ в динамичном равновесии с нерастворенной частью в-ва.
Значение ПР
ПР характеризует растворимость каждого индивидуального вещества.
По ПР можно рассчитать растворимость вещества и концентрацию ионов соли в насыщенном растворе.
![]() -
растворимость (моль/л). Растворимость
– предельная С вещества в р-ре, или С
насыщенного р-ра.
-
растворимость (моль/л). Растворимость
– предельная С вещества в р-ре, или С
насыщенного р-ра.
Пример
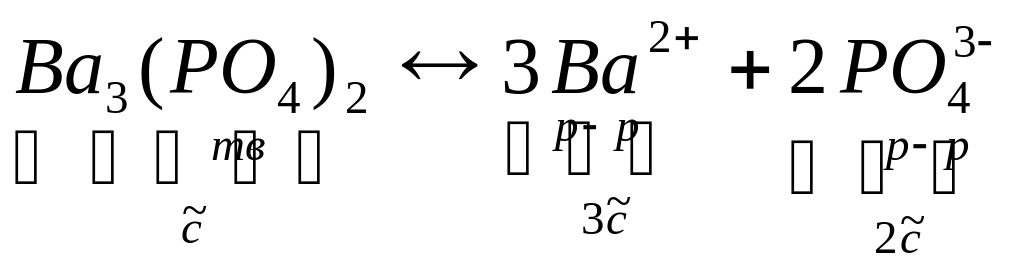 Равновесные
концентрации через
Равновесные
концентрации через
ПР=C3(Ba2+)+C2(PO43-)=(3
)3•(2
)2=108
5
;
=![]() =
=![]() моль/л
моль/л
C(Ba2+)=3 =3•10-8 моль/л; C(PO43-)=2 =2•10-8 моль/л
20. Уравнение скорости простой и сложной химической реакции. Порядок и молекулярность реакции.
Скорость хим. реакции – скорость изменение концентрации реагентов в единицу времени. Так как в химических реакциях учувствуют несколько компонентов, то скорость химической реакции можно вычислить по любому из этих компонентов.
υАА+υВВ→υсС+υДД
V=1/υАdСА/dτ =1/υД dСд/dτ = +-1/υi dСi/dτ , где С – концентрация, τ – время.
<V> = +- ∆Сi/∆τ
Vисх= +- dСi/dτ = tg α
Механизм хим реакции
Механизм – подробная картина, раскрывающая какие частицы и в какой последовательности и каким образом реагируют между собой, образовывая продукты. Бывают: 1. простые и 2. Сложные.
1. простые (элементарные). – одностадийные, т.е. осуществляются за однократное столкновение.
Молекулярность – число частиц, одновременно сталкивающихся в простой реакции.
- одномолекулярные (моно-…)AgBr Ag + ½ Br2
- двумалекулярные (би-…) 2HI H2 +I2
- трехмалекулярные (три-…) 2NO+O2 2NO2
- четырехмалекулярные пока не обнаружено
υАА+υВВ→υсС+υДД
nА= υА ; nВ=υВ ; n=nА+nВ (молекулярность 1,2,3)
υ=К*САυA*CBυB - з-н действ масс
З-н дм позволяет легко оценить влияние разл факторов на V
2. Сложные - совокупность 2х и более простых реакций.
Виды:
- последовательные 1234 (ступенчатая диссоциация и гидролиз); - параллельные (главная – самая быстрая); - цепные (с учетом радикалов); - циклические; - каталитические; -фотозимические 2H2O (hυ+катализатор) 2H2 + O2;
![]() - уравнение для любого «n»
- уравнение для любого «n»
Если сумма стехиометрич коэф υА+υВ>3-сложная, υА+υВ <3-простая
Факторы, определяющие V: Механизм, природа реагентов, Среагентов, t, катализ, проч условия.
Основной з-н хим кинетики – Vхим реакции прямо пропорциональна произведению концентраций реагентов, взятых в некой степени. υАА+υВВ→υсС+υДД
υ=К*САnA*CBnB- ур-ие скорости
СА, CB- концентрация, моль/л
К- const скорости, К=υ при Сi=1 моль/л
nА, nВ- частные порядки; n=nА+nВ- общий порядок
Порядок реакции - формальная величина, может принимать любые значения в зависимости от механизма процесса. Порядок реакции по виду ур-ия невозможно, нужен эксперемент, кроме случаев простых реакций. Принимает любые значения- 0,1,2,3…, дробные, “-”,…,100-1000…
21. Еа. Р-ии между какими частицами идут с заметной V при НУ, какие р-ции требуют инициирования?
Энергия Активации –средняя избыточная энергия, которой должны обладать частицы, чтобы произошла реакция (Еактивации, кДж). Потенциальный барьер, разделяющий исходное и конечное состояние системы, которыйдолжны преодолеть реагирующите частицы, чтобы произошла реакция .
Она тратится на:
Преодоление сил, отталкивающих при сближении частиц (электронные облака отталкиваются)
Разрушение старых связей
Изменение электронной конфигурации реагентов
Реакция идет:
Е![]() Еактивации
Еактивации
Чем больше Еактивации , тем меньше V химической реакции, так как меньше будет активных частиц, способных вступить во взаимодействие.
Зависимость Еактивации от природы реагентов:
если Еа < 100 кДж/моль, то такие реакции относятся к быстрым – они с заметной скоростью протекают уже при стандартных условиях. К ним относятся реакции, с участием свободных атомов, противоположно заряженных ионов, радикалов, а также реакции между самыми активными Ме и НеМе.
если Еа >=100 кДж/моль, то такие реакции или не идут, или с очень медленно. Они требуют инициирования ( активирования, т.е создания в системе активных частиц –активных молекул, атомов, радикалов, ионов)
методы инициирования:
1. термическое
2. фотохимическое
(h![]() -
облучая систему, создаем в ней акт.
частицы)
-
облучая систему, создаем в ней акт.
частицы)
3. радиационно- химический (энергия в сист подается потоком частиц с высокой энергией – нейтроны, протоны и т.п)
