
- •1. Атом, изотоп, химический элемент, вещество ( простое, сложное, реальное, раствор, смесь).
- •2. Способы выражения состава раствора. Концентрация (молярная, моляльная, массовая доли).
- •3. Квантово-механическая модель атома, квантовые числа, типы атомных орбиталей.
- •4. Основные принципы заполнения Атомных Орбиталей электронами. Принцип Паули, правило Хунда.
- •5. Периодическая система элементов (псэ). Закономерности изменения радиуса атомов химических элементов и электроотрицательности в периодах и группах псэ.
- •6. Химическая связь: природа, основные виды и свойства.
- •1. Энергия связи.
- •3. Валентный угол.
- •4. Полярность.
- •5. Дипольный момент.
- •7. Валентность, степень окисления атома элемента в химическом соединении.
- •8. Ковалентная связь. Насыщаемость, направленность. Строение, структурные формулы. Св-ва веществ.
- •9. Ионная связь, ее свойства. Строение и св-ва веществ с ионной связью. Примеры веществ с ионной связью.
- •10. Металлическая связь и ее свойства. Строение и свойства веществ с металлической связью.
- •11. Типы химических превращений. Уравнения химических реакций в ионно-молекулярной форме.
- •12. Основные законы термохимии ( закон Гесса, закон Лавуазье-Лапласа) и следствия из них.
- •13. Стандартная энтальпия образ в-ва (сложного, простого). Теплов эффект хим превращения, расчет.
- •14. Стандартная энтропия вещества (простого, сложного). Расчет изменения энтропии в химической реакции.
- •6 Частиц (6 ионов):
- •15. Опр направления хим р-ции по термодинамич ф-циям состояния. Энергия Гиббса, расчет.
- •16. Обратимые реакции. Хим равновесие. Закон действующих масс. Константы равновесия
- •17. Равновесие диссоциации слабых к-т и основ. Константа диссоци. З-н разбавления Оствальда. Расчет рН.
- •18. Равновесие гидролиза солей. По катиону,по аниону, рН водных р-ров солей, константа гидролиза.
- •19. Пр малорастворимых соединений . Расчет р-римости соли и концентрации ионов по значению пр.
- •20. Уравнение скорости простой и сложной химической реакции. Порядок и молекулярность реакции.
- •22. Зависимость скорости реакции от температуры ( уравнение Аррениуса, правило Вант-Гоффа).
- •23. Катализ. Гомогенный, гетерогенный и ферментативный катализ.
- •24. Комплексные соединения. Типичные комплексообразователи и лиганды. Координационное число.
- •25. Константа нестойк. Расчет концентрац ионов ко и лигандов в растворе комплексной соли по Кн.
- •26. Химические свойства комплексных солей
- •27. Растворы. Физико-хим взаимодействия в растворах. Сольватация, гидратация, ассоциация, диссоциация.
- •28. Коллигативные свойства растворов. Осмос. Закон Вант-Гоффа.
- •29. Коллигативные св-ва р-ров. Ткип и Тзамерз р-ров. Следствия из з-на Рауля. Определение состояния вещества в р-ре (электролит, неэлектролит, ассоциат) по коллгативным свойствам.
- •30. Коллоидные растворы. Дисперсные системы, классификация, области их применения.
- •31. Строение мицеллы. Правило Пескова-Фаянса. Адсорбция. Св-ва коллоидных р-ров (агрегативная и кинетическая устойчивость, седиментация, коагуляция, оптические и электрические).
- •32. Методы получения и разрушения коллоидных систем.
- •33. Окислительно-восстановительные сис. Степ окисл. Процессы ок и вос. Пр типичных ок и восстанов.
- •35. Окислительно-восстановительная двойственность на примере н2о2 и NaNo2.
- •36. Электрохимические процессы. Двойной электрич слой на границе электрод/электролит.
- •37. Типы электродов (I рода (Ме и НеМе); газовые электроды (водородный и кислородный); ок-вос электроды). Ур-ние Нернста для электрод потенциала. Стандарт водородный электрод как.
- •38. Гальванические элементы. Электродвижущая сила (эдс) гальванических элементов. Токообразующая реакция гальванических элементов.
- •39. Обратимые гальванические эл-ты (аккумуляторы), необратимые гальванические эл-ты (сухие элементы).
- •1) Прямой процесс(работа, т.Е. Получение эл. Тока )
- •2) Обратный процесс(приобретение эл. Энергии (зарядка))
- •2) Обратный процесс
- •40. Коррозия. Хим и электрохим коррозия Ме. Электрохим коррозия Ме в кислой среде ( Fe/Zn и Fe/Sn).
- •41. Методы защиты от коррозии. Защитные покрытия, катодная и протекторная защита от коррозии.
- •42. Лантаноиды (4-f элементы). Особенность электронного строения. Лантаноидное сжатие. Лантаноиды с переменной степенью окисления.
- •43. Свойства соединений церия и европия в разных степенях окисления. Получение и области применения.
- •44. Актиноиды (5-f элементы). Особенность электронного строения. Актиноидное сжатие. Изменение степени окисления в ряду актиноидов.
- •45. Свойства урана и его соединений в разных степенях окисления. Получение и области применения.
- •1.Свойства гидроксидов:
- •Гидролиз:
- •46. Свойства тория и его соединений. Получение и области применения.
- •47. Радиоактивность и радиохим превращения веществ. Стабильные и нестабильные изотопы. Применение.
- •48. Основные виды ионизирующего излучения.
- •49. Реакции радиоактивного распада. Период полураспада. Ядерные реакции.
- •50. Современные методы разделения и очистки веществ на примерах очистки воды, воздуха, извлечения и разделения актиноидов. Химические методы, ионообменная сорбция, экстракция.
16. Обратимые реакции. Хим равновесие. Закон действующих масс. Константы равновесия
Обратимые реакции — хим реакции, протекающие одновременно в двух противоположных направлениях (прямом и обратном), пр: 3H2+N2 ⇆ 2NH3 Направление обратимых реакций зависит от концентрац веществ.
Химическое равновесие – это динамическое состояние обратимых процессов, при которой скорость прямой реакции = скорости обратной реакции, а соотношение количеств реагентов и продуктов во времени не меняется.
ЗДМ - соотношение произведения равновесных концентраций с участием их стехиометрических коэф-ов, есть величина постоянная. Согласно Закону Действия масс скорость, с которой вещества реагируют друг с другом, зависит от их концентрации. VаА+VbB↔VcC+VdD
Константы равновесия Может быть записана через равновесные активности (а), равновесные концентрации (C), равновесные парциальные давления (p). AA + BB CC + DD (1).
Для реакции (1): Ka = (aC(C) * aD(D)) / (aA(A) * aB(B)) — ТД константа равновесия.
KC = (CC(C) * CD(D)) / (CA(A) * CB(B)) — концентрационная константа равновесия.
Kp = (CC(C) * CD(D)) / (CA(A) * CB(B)) — константа равновесия для давлений.
Для разбавленных растворов используют константу, выраженную через концентрации. Для газовых реакций используют константу, выраженную через парциальные давления.
Внимание! Ka KС Kp. Под действием внешних факторов равновесные активности/концентрации/давления компонентов системы могут меняться, однако их соотношение, т. е. константа равновесия, всегда остаётся постоянной при данной температуре.
Итак, Ka KС Kp, Ka, KС, Kp = inv (T). K = 1: истинное равновесие; K > 1: равновесие смещено вправо; K < 1: равновесие смещено влево. G = –RT * lnK. С
мещение равновесия подчиняется закону Ле-Шателье: Если на систему, находящуюся в равновесии, оказывается воздействие извне, то равновесие смещается в сторону, подавляющую это воздействие. Константа равновесия изменяется только при температурном воздействии.
Конст равнов -это хар-ка индивидуального процесса, завис от природы всех компонентов и t.
υаА+υbB↔υcC+υdD при равновесии скорость Vпр=Vобр
Vпр=К1*САυА* СBυB
Vобр= К2*Сcυc* СDυD
при равновесии К1*САυА* СBυB= К2*Сcυc* СDυD
К= Сcυc* СDυD/ САυА* СBυB=const – закон действ масс (при t=const)
В
гомогенных
сис-мах
: газовые
2SO2
(г) +О2(г)
= 2SO3
![]() =
=
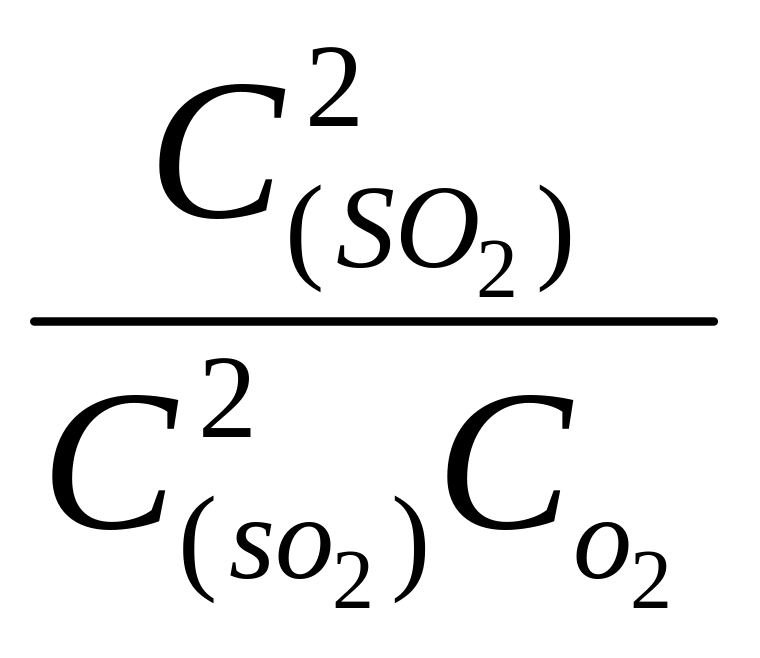 ;
;
в растворе 2NaОНр-р + Н2SO4 р-р→Nа2SO4 р-р+2 Н2О*
ОН-
+
Н +→Н2О
![]() =
const
=
=
const
=
![]()
В гетерогенных сис-мах
Константа равновесия не включает жидкие и твердые вещ-ва. Их состояние можно принять за сос-е чистого вещ-ва, т.е. С - постоянная величина.
MgСО3(тв)![]() Mg
O(тв)
+ СО2(г)
вещества К= С(СО2)
Mg
O(тв)
+ СО2(г)
вещества К= С(СО2)
Если в водном растворе, то Кр записывается для сокращенной ионно-молекулярной формы.
Выражения для константы равновесия записывают на основании уравнения химической реакции. При записи следует помнить, что:
1. Те компоненты, С которых в процессе не меняется, в выражение константы не входят Срастворителя , так как она >>С других компонентов, например если реакция идет в водном растворе, не меняется
2. Твердые и жидкие вещества в гетерогенных реакциях обособленна от остальных компонентов физической границей раздела фаз. Их состояния можно принять за состояние чистого вещества., а Счистого вещества = const
3. Если в водном растворе, то Кравновесия записывается для сокращенной ионно-молекулярной формы.
