
- •1.Свободные колебания системы без трения.
- •2. Математический и физический маятники.
- •3. Энергия гармонического колебания.
- •4. Сложение гармонических колебаний одного направления. Биения.
- •5. Сложение взаимно перпендикулярных колебаний.
- •6.Затухающие колебания.
- •7.Вынужденные колебания. Резонанс.
- •8.Добротность колебательной системы.
- •9.Различные формы записи уравнения состояния идеального газа.
- •10.Уравнение адиабаты идеального газа.
- •11.Рaбота газа при адиабатическом процессе.
- •12.Теплоемкость идеального газа при политропическом процессе, ее связь с Ср и Сv.
- •13.Уравнение Ван-дер-Ваальса.
- •14.Изотермы Ван-дер-Ваальса.
- •15.Внутренняя энергия идеального и ван-дер-ваальсовского газов.
- •16.Основные законы (начала) термодинамики.
- •17.Число ударов молекул газа о стенку.
- •18.Газокинетический вывод выражения для давления газа на стенку.
- •19.Функция распределения вероятностей. Ее свойства.
- •20.Функция распределения вероятностей. Средние зачения.
- •21.Распределение Максвелла.
- •22.Распределение молекул по компонентам скорости.
- •23.Средняя арифметическая, средняя квадратичная и наиболее вероятная скорости молекул.
- •24.Средняя энергия молекул.
- •25.Распределение Больцмана.
- •26.Экспериментальное определение скоростей молекул и атомов.
- •27.Теплоемкость идеального газа при постоянном объеме и при постоянном давлении.
- •28.Кпд тепловой машины. Кпд цикла Карно. Теорема Карно.
- •29.Энтропия и ее свойства.
- •30.Энтропия идеального газа.
- •31.Физические типы кристаллических решеток.Теплоемкость кристаллов. Закон Дюлонга-Пти.
- •32.Давление под изогнутой поверхностью жидкости. Жидкость в капилляре.
- •33.Поверхностное натяжение. Формула Лапласа.
- •34.Пересыщенные пар и перегретая жидкость.
- •35.Уравнение Клапейрона-Клаузиуса.
- •36.Тройная точка. Диаграмма состояния.
- •42.Теплопроводность газов. Газокинетический вывод выражения для коэффициента теплопроводности.
- •37.Средняя длина свободного пробега молекул.
- •38.Вязкость газов. Газокинетический вывод выражения для коэффициента вязкости.
- •39. Работа, совершаемая идеальным газом при политропическом процессе. Частные случаи.
- •40.Диффузия газов. Газокинетический вывод выражения для коэффициента диффузии.
- •41.Первый и второй законы Фика, уравнение диффузии.
- •1.Свободные колебания системы без трения.
- •2.Математический и физический маятники.
17.Число ударов молекул газа о стенку.
Рассмотрим
идеальный одноатомный газ, находящийся
в равновесии в сосуде объемом V. Выделим
молекулы, имеющие скорость от v до v +
dv. Тогда число молекул, движущихся в
направлении углов q и f с этими скоростями
будет равно: dNv,q,f
= dNv·dW/4p.
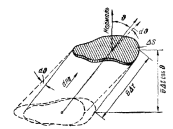
Выделим элементарную поверхность
площадью dП., которую примем за часть
стенки сосуда. За единицу времени до
этой площади дойдут молекулы, заключенные
в косом цилиндре с основанием dП и
высотой v·cos q ( см. рис. 14.3). Число
пересечений выбранными нами молекулами
выделенной поверхности (число ударов
о стенку) в единицу времени dnv,q,f будет
равно произведению концентрации молекул
на объем этого косого цилиндра: dn(v,q,f)
= dП·v·cos
q·dNv,q,f/V,
где V - объем сосуда, в котором содержится
газ. Проинтегрировав выражение по углам
в пределах телесного угла 2p, что
соответствует изменению углов q и f в
диапазоне от 0 до p/2 и от 0 до 2p соответственно,
получим формулу для расчета полного
числа ударов молекул, имеющих скорости
от v до v + dv о стенку.
![]() (2) .
(2) .
![]() Проинтегрировав выражение по всем
скоростям получим, что число ударов
молекул о стенку площадью dП в единицу
времени будет равно(2):. Учитывая
определение средней скорости получим,
что число ударов молекул о стенку
единичной площади в единицу времени
будет равно:
Проинтегрировав выражение по всем
скоростям получим, что число ударов
молекул о стенку площадью dП в единицу
времени будет равно(2):. Учитывая
определение средней скорости получим,
что число ударов молекул о стенку
единичной площади в единицу времени
будет равно:
n = N/V·<v>/4 = n·<v>/4.
18.Газокинетический вывод выражения для давления газа на стенку.
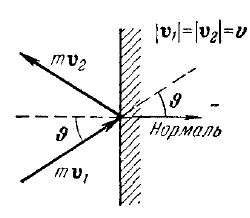
При
абсолютно упругом ударе о стенку сосуда
молекулы массы m,
движущейся под углом q
со скоростью v
к ее нормали, импульс молекулы изменится
на величину dp,
равную dp
= - 2m·v
cos
q.
Импульс стенки при этом изменится на
противоположную по знаку величину. В
соответствии со вторым законом Ньютона
скорость изменения импульса стенки
равна силе, с которой молекула на нее
подействовала. В свою очередь, отношение
нормальной составляющей силы к площади-
есть давление на стенку. Следовательно,
dP
= dp·dnv,q,f
= dp·v·cos
q·dNv,q,f/V.
Подставив и проведя интегрирование по
углам и скоростям, получим, что давление
P
оказываемое всеми молекулами на стенку,
равно:
![]() ,
где dPv
- давление, создаваемое молекулами,
имеющими скорость v,
равное
,
где dPv
- давление, создаваемое молекулами,
имеющими скорость v,
равное
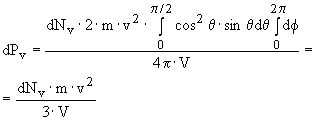
19.Функция распределения вероятностей. Ее свойства.
Функция
статистического распределения—
плотность вероятности в фазовом
пространстве. Знание функции распределения
полностью определяет вероятностные
свойства рассматриваемой системы.
Pi=limN®¥Ni/N
– вероятность появления результата
xi,
при N
– кол-во значений х, Ni
– кол-во измерений. Возьмем величину
а (а – очень мала, скажем а=10-6),
найдем число измерений DN0,
при которых 0<x<a;
DNi
при которых a<x<2a…DNx
при которых результат измерений от х
до х+а и т.д. DP0=DN0/N
– вероятность того что результат
окажется от 0 до а. DP1=DN1/N
и т.д. Возьмем ось Х (1) и отложим на ней
полоски, шириной а и высотой DPx/a.
Такая диаграмма назыв. гистограммой
вероятности. Площадь гистограммы равна
1. Если a®0
то получим (2); f(x),
определяющая аналитически гистограмму
при а®0
назыв. ф-ей распределения вероятностей.
S
столбика. шириной dx
(2) равна вероятности того что результат
измерений окажется в пределах от x
до x+dx.
Обозначим эту вероятность dPx:
dPx=f(x)dx.
Площадь под f(x)=1
Þ
òf(x)dx=òdPx=1.(*)

1) Свойства:Значения функции распределения принадлежат отрезку [0, 1]. 2) Вероятность того, что случайная величина примет значение, заключенное в интервале (a, b) , равна приращению функции распределения на этом интервале. 3) На минус бесконечности функция распределения равна нулю, на плюс бесконечности функция распределения равна единице. 4) Вероятность того, что непрерывная случайная величина Х примет одно определенное значение, равна нулю.
