
- •1.Свободные колебания системы без трения.
- •2. Математический и физический маятники.
- •3. Энергия гармонического колебания.
- •4. Сложение гармонических колебаний одного направления. Биения.
- •5. Сложение взаимно перпендикулярных колебаний.
- •6.Затухающие колебания.
- •7.Вынужденные колебания. Резонанс.
- •8.Добротность колебательной системы.
- •9.Различные формы записи уравнения состояния идеального газа.
- •10.Уравнение адиабаты идеального газа.
- •11.Рaбота газа при адиабатическом процессе.
- •12.Теплоемкость идеального газа при политропическом процессе, ее связь с Ср и Сv.
- •13.Уравнение Ван-дер-Ваальса.
- •14.Изотермы Ван-дер-Ваальса.
- •15.Внутренняя энергия идеального и ван-дер-ваальсовского газов.
- •16.Основные законы (начала) термодинамики.
- •17.Число ударов молекул газа о стенку.
- •18.Газокинетический вывод выражения для давления газа на стенку.
- •19.Функция распределения вероятностей. Ее свойства.
- •20.Функция распределения вероятностей. Средние зачения.
- •21.Распределение Максвелла.
- •22.Распределение молекул по компонентам скорости.
- •23.Средняя арифметическая, средняя квадратичная и наиболее вероятная скорости молекул.
- •24.Средняя энергия молекул.
- •25.Распределение Больцмана.
- •26.Экспериментальное определение скоростей молекул и атомов.
- •27.Теплоемкость идеального газа при постоянном объеме и при постоянном давлении.
- •28.Кпд тепловой машины. Кпд цикла Карно. Теорема Карно.
- •29.Энтропия и ее свойства.
- •30.Энтропия идеального газа.
- •31.Физические типы кристаллических решеток.Теплоемкость кристаллов. Закон Дюлонга-Пти.
- •32.Давление под изогнутой поверхностью жидкости. Жидкость в капилляре.
- •33.Поверхностное натяжение. Формула Лапласа.
- •34.Пересыщенные пар и перегретая жидкость.
- •35.Уравнение Клапейрона-Клаузиуса.
- •36.Тройная точка. Диаграмма состояния.
- •42.Теплопроводность газов. Газокинетический вывод выражения для коэффициента теплопроводности.
- •37.Средняя длина свободного пробега молекул.
- •38.Вязкость газов. Газокинетический вывод выражения для коэффициента вязкости.
- •39. Работа, совершаемая идеальным газом при политропическом процессе. Частные случаи.
- •40.Диффузия газов. Газокинетический вывод выражения для коэффициента диффузии.
- •41.Первый и второй законы Фика, уравнение диффузии.
- •1.Свободные колебания системы без трения.
- •2.Математический и физический маятники.
10.Уравнение адиабаты идеального газа.
Адиабатическим
называется процесс, при котором
отсутствует теплообмен (δQ=0)
между системой и окружающей средой.
δQ=dU+δA.
![]() δA=pdV и
Cv=dU/dT
δA=pdV и
Cv=dU/dT
![]() pV=(m/M)RT=>
pV=(m/M)RT=>
![]() =>
=>
![]() ;
Сp/Сv=γж
;
Сp/Сv=γж
![]() .
Проинтегрируя это
уравнение в пределах от p1 до p2 и
соответственно от V1 до V2, и потенцируя,
придем к выражению
.
Проинтегрируя это
уравнение в пределах от p1 до p2 и
соответственно от V1 до V2, и потенцируя,
придем к выражению
![]() или
или
![]() Полученное
выражение есть уравнение адиабатического
процесса, называемое также уравнением
Пуассона.
Полученное
выражение есть уравнение адиабатического
процесса, называемое также уравнением
Пуассона.
![]() =>
=>
![]()
![]() - называется показателем адиабаты (или
коэффициентом Пуассона).
- называется показателем адиабаты (или
коэффициентом Пуассона).
11.Рaбота газа при адиабатическом процессе.
Cv=dU/dT![]() .
Если газ
адиабатически расширяется от объема
V1
до V2,
то его температура уменьшается от T1
до T2
и работа расширения идеального газ
.
Если газ
адиабатически расширяется от объема
V1
до V2,
то его температура уменьшается от T1
до T2
и работа расширения идеального газ
![]()
![]() а
а
![]()
![]()
![]()
![]()
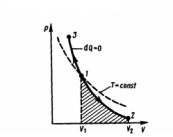 Работа,
которую совершает газом при адиабатическом
расширении 1—2 (определяется площадью,
заштрихованной на рис. 2), меньше, чем
при изотермическом, по причине, что при
адиабатическом расширении осуществляется
охлаждение газа, тогда как при
изотермическом — температура
поддерживается постоянной за счет
притока извне такого же количества
теплоты.
Работа,
которую совершает газом при адиабатическом
расширении 1—2 (определяется площадью,
заштрихованной на рис. 2), меньше, чем
при изотермическом, по причине, что при
адиабатическом расширении осуществляется
охлаждение газа, тогда как при
изотермическом — температура
поддерживается постоянной за счет
притока извне такого же количества
теплоты.
12.Теплоемкость идеального газа при политропическом процессе, ее связь с Ср и Сv.
Политропический
процесс — термодинамический процесс,
во время которого удельная теплоёмкость
газа остаётся неизменной.
![]() Теплоемкость
при политропических процессах не
зависит от температуры. Докажем
это, рассмотрев 1 моль идеального
газа.Cn=const(T).
Теплоемкость
при политропических процессах не
зависит от температуры. Докажем
это, рассмотрев 1 моль идеального
газа.Cn=const(T).

13.Уравнение Ван-дер-Ваальса.
Ван-дер-Ваальса
уравнение, одно из первых уравнений
состояния реального газа, предложенное
голландским физиком Я. Д. Ван-дер-Ваальсом.
![]() р
— давление газа; Т — его температура;
р
— давление газа; Т — его температура;
![]() - объём
одного моля вещества; R — универсальная
газовая постоянная; а и b — константы,
учитывающие отклонение свойств реального
газа от свойств идеального. Член
- объём
одного моля вещества; R — универсальная
газовая постоянная; а и b — константы,
учитывающие отклонение свойств реального
газа от свойств идеального. Член
![]() имеющий размерность давления, учитывает
притяжение между молекулами газа за
счёт ван-дер-ваальсовых сил. Константа
b является поправкой на собственный
объём молекул газа и учитывает
отталкивание молекул на близких
расстояниях. Константы а и b обычно
определяются из экспериментальных
данных. Ван-дер-Ваальса уравнение
является приближённым и количественно
описывает свойства реальных газов лишь
в области высоких температур и низких
давлений. Однако качественно оно
позволяет описывать поведение газа
при высоких давлениях, конденсацию
газа в жидкость и критическое
состояние(предельное состояние
равновесия двухфазных систем, в котором
обе сосуществующие фазы становятся
тождественными по своим свойствам).
имеющий размерность давления, учитывает
притяжение между молекулами газа за
счёт ван-дер-ваальсовых сил. Константа
b является поправкой на собственный
объём молекул газа и учитывает
отталкивание молекул на близких
расстояниях. Константы а и b обычно
определяются из экспериментальных
данных. Ван-дер-Ваальса уравнение
является приближённым и количественно
описывает свойства реальных газов лишь
в области высоких температур и низких
давлений. Однако качественно оно
позволяет описывать поведение газа
при высоких давлениях, конденсацию
газа в жидкость и критическое
состояние(предельное состояние
равновесия двухфазных систем, в котором
обе сосуществующие фазы становятся
тождественными по своим свойствам).
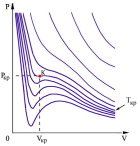 -изотермы
Ван-дер-Ваальса.
При повышении
температуры волнообразный участок
уменьшается и превращается в точку
(точка К). Эта точка называется критической.
-изотермы
Ван-дер-Ваальса.
При повышении
температуры волнообразный участок
уменьшается и превращается в точку
(точка К). Эта точка называется критической.
14.Изотермы Ван-дер-Ваальса.
Ван-дер-Ваальса
уравнение, одно из первых уравнений
состояния реального газа, предложенное
голландским физиком Я. Д. Ван-дер-Ваальсом.
.
-изотермы
Ван-дер-Ваальса. На этих изотермах
хорошо просматривается участок, где
давление растёт с ростом объёма. Этот
участок не имеет физического смысла.
В области, где изотерма делает
зигзагообразный изгиб, изобара пересекает
её три раза, то есть, имеется три значения
объёма V при одинаковых значениях
параметров p
и T.
Это соответствует существованию трёх
действительных корней уравнения. При
повышении температуры волнообразный
участок уменьшается и превращается в
точку (точка К ). Эта точка называется
критической, а значения
![]() ,
,
![]() и
и
![]() в этой точке называются критическими
параметрами. Критической точке
соответствуют три совпадающих корня
уравнения Ван-дер-Ваальса.. При
температурах, превышающих критическую,
изотермы Ван-дер-Ваальса становятся
монотонно убывающими функциями
в этой точке называются критическими
параметрами. Критической точке
соответствуют три совпадающих корня
уравнения Ван-дер-Ваальса.. При
температурах, превышающих критическую,
изотермы Ван-дер-Ваальса становятся
монотонно убывающими функциями
![]() .
Для нахождения критических параметров
подставим их значения в уравнение
.
Для нахождения критических параметров
подставим их значения в уравнение
![]() .
Поскольку в критической точке все три
корня совпадают и равны Vк уравнение
приводится к виду:
.
Поскольку в критической точке все три
корня совпадают и равны Vк уравнение
приводится к виду:
![]() или
или
![]() ,
тогда
,
тогда
![]() =>
=>![]() .Таким образом, из уравнения состояния
газа Ван-дер-Ваальса следует существование
у реальных газов критической точки с
параметрами , и , величина которых
зависит от свойств газа.
.Таким образом, из уравнения состояния
газа Ван-дер-Ваальса следует существование
у реальных газов критической точки с
параметрами , и , величина которых
зависит от свойств газа.
