
- •1.Свободные колебания системы без трения.
- •2. Математический и физический маятники.
- •3. Энергия гармонического колебания.
- •4. Сложение гармонических колебаний одного направления. Биения.
- •5. Сложение взаимно перпендикулярных колебаний.
- •6.Затухающие колебания.
- •7.Вынужденные колебания. Резонанс.
- •8.Добротность колебательной системы.
- •9.Различные формы записи уравнения состояния идеального газа.
- •10.Уравнение адиабаты идеального газа.
- •11.Рaбота газа при адиабатическом процессе.
- •12.Теплоемкость идеального газа при политропическом процессе, ее связь с Ср и Сv.
- •13.Уравнение Ван-дер-Ваальса.
- •14.Изотермы Ван-дер-Ваальса.
- •15.Внутренняя энергия идеального и ван-дер-ваальсовского газов.
- •16.Основные законы (начала) термодинамики.
- •17.Число ударов молекул газа о стенку.
- •18.Газокинетический вывод выражения для давления газа на стенку.
- •19.Функция распределения вероятностей. Ее свойства.
- •20.Функция распределения вероятностей. Средние зачения.
- •21.Распределение Максвелла.
- •22.Распределение молекул по компонентам скорости.
- •23.Средняя арифметическая, средняя квадратичная и наиболее вероятная скорости молекул.
- •24.Средняя энергия молекул.
- •25.Распределение Больцмана.
- •26.Экспериментальное определение скоростей молекул и атомов.
- •27.Теплоемкость идеального газа при постоянном объеме и при постоянном давлении.
- •28.Кпд тепловой машины. Кпд цикла Карно. Теорема Карно.
- •29.Энтропия и ее свойства.
- •30.Энтропия идеального газа.
- •31.Физические типы кристаллических решеток.Теплоемкость кристаллов. Закон Дюлонга-Пти.
- •32.Давление под изогнутой поверхностью жидкости. Жидкость в капилляре.
- •33.Поверхностное натяжение. Формула Лапласа.
- •34.Пересыщенные пар и перегретая жидкость.
- •35.Уравнение Клапейрона-Клаузиуса.
- •36.Тройная точка. Диаграмма состояния.
- •42.Теплопроводность газов. Газокинетический вывод выражения для коэффициента теплопроводности.
- •37.Средняя длина свободного пробега молекул.
- •38.Вязкость газов. Газокинетический вывод выражения для коэффициента вязкости.
- •39. Работа, совершаемая идеальным газом при политропическом процессе. Частные случаи.
- •40.Диффузия газов. Газокинетический вывод выражения для коэффициента диффузии.
- •41.Первый и второй законы Фика, уравнение диффузии.
- •1.Свободные колебания системы без трения.
- •2.Математический и физический маятники.
38.Вязкость газов. Газокинетический вывод выражения для коэффициента вязкости.
Вязкость газов (явление внутреннего трения) — это появление сил трения между слоями газа некоторой толщины Dz, движущимися друг относительно друга параллельно и с разными по величине скоростями V1 и V2. . Взаимодействие двух слоев газа рассматривается как процесс, в ходе которого от одного слоя к другому передается импульс. Пусть в какой-то момент слои обладают импульсами K1,K2. Эти импульсы изменяются т.к. вследствие теплового движения происходит непрерывный переход мол. из одного слоя в другой. Число мол., переходящих через площадку S за сек. опред. выражением: N=(1/6)n<V>S (1). Через площадку S, лежащую на границе раздела слоев, переносится в ед. времени в направлении от первого слоя ко второму импульс: K=N(mV1-mV2), подставим (1): K=(1/6)n<V>Sm(u1-u2) (2). Скорость при переходе через границу раздела меняется по закону V=V(z). В среднем последнее соударение происходит на расстоянии, равном длине своб. пробега l. Поэтому молекулам, летящим в напр. оси z, припишем знач. скор. V1=V(z-l), а мол. летящим в противоп. напр. V2=V(z+l), подставим эти знач. в (2): K=(1/6)n<V>Sm[u(z-l)-u(z+l)]=-(1/6)n<V>Sm(dV/dz)2l, nm=r - плотность газа Þ K=-((1/3)<V>lr)(dV/dz)S, сравнив с формулой K=-h(dV/dz)S – импульс передаваемый за секунду от слоя к слою через поверхность S, получим выраж. для коэф. вязкости: h=(1/3)<V>lr.
39. Работа, совершаемая идеальным газом при политропическом процессе. Частные случаи.
Политропический
процесс
— термодинамический процесс, во время
которого удельная теплоёмкость газа
остаётся неизменной.
.
-показатель
политропы.
const
;
const;
.
![]() ;
;
;
;![]() ;
;![]() ;
для
;
для
![]() :
:
![]() ;
;![]() ;
;
![]() ;
;
![]() ;
для адиабатического
;
для адиабатического
![]() и
и
![]() .
Для изотермического
.
Для изотермического
![]() .
При изобарическом
.
При изобарическом
![]() .Тот
же результат, если n=0. При изохорическом
A=0.
.Тот
же результат, если n=0. При изохорическом
A=0.
40.Диффузия газов. Газокинетический вывод выражения для коэффициента диффузии.
 Диффузией
называется
самостоятельное перемешивание молекул,
обусловленное их тепловым движением.
Диффузия имеет место как в газах и
жидкостях, так и в твердых телах. В газах
диффузия протекает с наиб. скоростью
вследствие большой подвижности молекул
газа. Скорость диффузии во всех агрегатных
сост. в-ва сильно зависит от темпер.
Получ.
ур-я диффузии:
будем считать, что молекулы обоих
компонентов мало отлич. по массе
(m1»m2»m)
и имеют практически одинаковые
эффективные сечения s1»s2»s
Þ
<V1>=<V2>=<V>,
<λ>=
Диффузией
называется
самостоятельное перемешивание молекул,
обусловленное их тепловым движением.
Диффузия имеет место как в газах и
жидкостях, так и в твердых телах. В газах
диффузия протекает с наиб. скоростью
вследствие большой подвижности молекул
газа. Скорость диффузии во всех агрегатных
сост. в-ва сильно зависит от темпер.
Получ.
ур-я диффузии:
будем считать, что молекулы обоих
компонентов мало отлич. по массе
(m1»m2»m)
и имеют практически одинаковые
эффективные сечения s1»s2»s
Þ
<V1>=<V2>=<V>,
<λ>=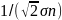 ,
где n1+n2=n.
Допустим, что измен-е концентр. первого
компонента вдоль z
опис. ф-ей n1=n1(z).
Обозн. число мол. первого компонента,
пролет. за сек. через площ. S
в напр. оси z,
- через N’1
и N”1
в противоположных напр. Разность этих
чисел даст поток молекулы первой
компоненты N1
через S:
N1=N’1-N”1
(1).
Пусть мол. движутся вдоль взаимно
перпендик. напр., совпад. с осями x,
y,
z
(x,y||S).
В этом случае число мол., пролет. за сек.
в одном из напр. через единичн. площадку
= (1/6)n<V>
Þ
N’1
и N”1
представимы в виде: N’1=(1/6)n’1<V>S,
N”1=(1/6)n”1<V>S
(2),
где n’1,
n”1
– эффект. концентр. мол. первого компон.
слева и справа от S,
соответственно. В среднем последнее
соударение происходит на расстоянии
от S,
равном средн. длине своб. пробега l.
Поэтому вместо n’1
разумно взять значение n1(z-l),
а вместо n”1
– значение n1(z+l).
Тогда с учетом (1) и (2): N1=(1/6)<V>S[n1(z-l)-n1(z+l)]
(3).
Т.к. l
очень мала то: n1(z-l)-n1(z+l)=-(dn1/dz)2l
(4),
подставим (4) в (3): N1=-((1/3)<V>l)(dn1/dz)S
(5). Сравнив (5) с выражением для потока
молекул i-го
вида, Ni=-D(dni/dz)S,
где D
– коэф. диффузии, получим выраж. для
коэф. диффузии: D=(1/3)<V>l.
Вывод приведший нас к ф-ле (5), в равной
мере применим к обоим компон. смеси. Þ
D
имеет для обоих компон. одинак. значен.
,
где n1+n2=n.
Допустим, что измен-е концентр. первого
компонента вдоль z
опис. ф-ей n1=n1(z).
Обозн. число мол. первого компонента,
пролет. за сек. через площ. S
в напр. оси z,
- через N’1
и N”1
в противоположных напр. Разность этих
чисел даст поток молекулы первой
компоненты N1
через S:
N1=N’1-N”1
(1).
Пусть мол. движутся вдоль взаимно
перпендик. напр., совпад. с осями x,
y,
z
(x,y||S).
В этом случае число мол., пролет. за сек.
в одном из напр. через единичн. площадку
= (1/6)n<V>
Þ
N’1
и N”1
представимы в виде: N’1=(1/6)n’1<V>S,
N”1=(1/6)n”1<V>S
(2),
где n’1,
n”1
– эффект. концентр. мол. первого компон.
слева и справа от S,
соответственно. В среднем последнее
соударение происходит на расстоянии
от S,
равном средн. длине своб. пробега l.
Поэтому вместо n’1
разумно взять значение n1(z-l),
а вместо n”1
– значение n1(z+l).
Тогда с учетом (1) и (2): N1=(1/6)<V>S[n1(z-l)-n1(z+l)]
(3).
Т.к. l
очень мала то: n1(z-l)-n1(z+l)=-(dn1/dz)2l
(4),
подставим (4) в (3): N1=-((1/3)<V>l)(dn1/dz)S
(5). Сравнив (5) с выражением для потока
молекул i-го
вида, Ni=-D(dni/dz)S,
где D
– коэф. диффузии, получим выраж. для
коэф. диффузии: D=(1/3)<V>l.
Вывод приведший нас к ф-ле (5), в равной
мере применим к обоим компон. смеси. Þ
D
имеет для обоих компон. одинак. значен.
