
- •I. Количества веществ относятся к известному количеству раствора.
- •II. Количества веществ относятся к известному количеству растворителя.
- •Теории растворов.
- •Термодинамика многокомпонентных систем. Химические потенциалы.
- •Уравнения Гиббса-Дюгема.
- •Соотношение между химическими потенциалами компонента, входящего в состав нескольких фаз гетерогенной системы.
- •Термодинамические функции идеальных растворов газов (смесей идеальных газов).
- •Неидеальные растворы газов. Летучесть компонентов раствора.
- •Ограниченная взаимная растворимость газов.
- •Давление насыщенного пара бинарных жидких растворов.
- •Закон рауля. Идеальные растворы.
- •Реальные растворы. Отклонения от закона Рауля.
- •Диаграмма равновесия жидкость – пар в бинарных системах.
- •Фракционная (дробная) перегонка. Разделение азеотропных растворов.
- •Ограниченная взаимная растворимость жидкостей.
- •Коэффициент распределения вещества в двух несмешивающихся растворителях. Экстракция.
- •Растворимость газов в жидкостях.
- •Идеальная растворимость твердых веществ.
- •Отклонения от идеальной растворимости.
- •Зависимость растворимости твердых веществ от давления.
- •Криоскопия. Эбуллиоскопия. Криоскопия (Понижение температуры замерзания растворов).
- •Эбуллиоскопия (Повышение т кипения растворов нелетучих веществ).
- •Осмотическое давление.
- •Термодинамика осмотического давления.
- •Интегрируем, считая const :
- •Коллигативные свойства растворов.
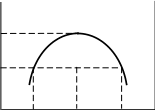
Фракционная (дробная) перегонка. Разделение азеотропных растворов.
Разделение раствора на компоненты перегонкой возможно благодаря различию в составах равновесных жидкости и пара. См. рис. диаграммы Ткип – состав: по мере выкипания в жидкой смеси все больше относительное содержание высококипящих компонентов; отгоняемая фракция относительно богаче более летучим компонентом. Повторяя фракционирование, соединяя близкие по составу фракции последовательных перегонок, постепенно увеличиваем массы крайних фракций конденсата и уменьшаем массы средних фракций и в конце концов приходим к чистым компонентам А и В.
В дефлегмационных и ректификационных колонках последовательные перегонки объединены в один автоматизированный процесс, приводящий к разделению компонентов жидкого раствора, – ректификация.
Разделение раствора на компоненты А и В путем перегонки невозможно, если они образуют азеотропный раствор (при определенном соотношении компонентов). Пусть диаграмма Ткип – состав имеет минимум. Она состоит как бы из
toA
toB
A C B Делится на Делится на А и С В и С |
двух частей, каждая из которых аналогична диаграмме Ткип – состав без экстремума. Перегонка раствора любого состава приведет к концентрированию в остатке одного из компонентов (А или В); в конденсате – азеотроп. В случае азеотропа с максимумом Ткип ректификация раствора приведет к обратным результатам: азеотроп останется в колбе, а в приемнике соберется чистый компонент. Азеотропные растворы могут быть в отдельных случаях разделены на |
чистые компоненты. Рассмотрим эти методы на примере азеотропа вода – этанол.
1. Химические методы (длительное кипячение раствора азеотропного состава с безводным хлористым кальцием; перегонка с металлическим натрием).
2. Возможно улучшить разделение с помощью перегонки при повышенном (пониженном) давлении. При атмосферном давлении Ткип воды 100оС, этанола 78,3оС, азеотропа (содержит 95, 57 вес. % спирта) 78,15оС; при Р = 100 мм рт.ст. содержание спирта в азеотропе возрастает до 99,6 мольн. %, Ткип азеотропа 34,2оС.
3. Другой способ разделения азеотропного раствора путем перегонки – добавление 3-го компонента. В систему вода + этанол добавить бензол, образуется двухфазная система, кипящая при 64,9оС (Р = 1 атм). Остаток после отгонки – абсолютный спирт.
Ограниченная взаимная растворимость жидкостей.
Три случая взаимной растворимости при смешении двух жидкостей:
1. Жидкости смешиваются в любых соотношениях, образуя гомогенную систему (вода – метанол, вода – этанол, вода – ацетон).
2. Жидкости практически не смешиваются друг с другом (вода – бензол, вода – ртуть).
3. Ограниченная взаимная растворимость жидкостей (вода – фенол, вода – эфир, вода – анилин). Рассмотрим диаграмму Т – состав (Р = const):
Гомогенный раствор Ткр
Т1 а О b
Вода N1 No N2 Фенол
|
Кривая расслоения (бинодальная кривая) делит диаграмму на две области: область гомогенную (раствор) и область существования двух фаз (насыщенный раствор воды в феноле и насыщенный раствор фенола в воде; т. Nо, N2, N1). Состав насыщенных растворов зависит от Т и Р. Фигуративные точки, выражающие составы двух равновесных фаз, называются сопряженными точками (т. а и b). Линии, соединяющие сопряженные |
точки, называются нодами (коннодами) (линия аОb; проходит через т. О – фигуративную точку системы). К этой системе приложимо правило рычага.
Во многих случаях соприкасающиеся жидкости остаются лишь частично взаимно растворимыми при всех изменениях Т. Но в ряде систем (как и в рассмотренном случае фенол – вода) с ростом Т взаимная растворимость увеличивается, интервал расслаивания уменьшается, и при Т выше некоторой Ткр жидкости смешиваются во всех соотношениях. Ткр – верхняя критическая Т растворения жидкостей.
А В |
В некоторых случаях наблюдаются нижние критические Т растворения (например, в системе вода – триэтиламин), когда взаимная растворимость увеличивается при понижении Т. |
А В |
Есть системы, у которых полная смешиваемость достигается и при повышении, и при понижении Т (есть верхняя и нижняя критические Т растворения): вода – никотин. Алексеев установил правило прямолинейного диаметра, согласно которому середины нод, |
соединяющих фигуративные точки равновесных растворов, образуют прямую линию, проходящую через максимум (минимум) границы области расслаивания. Правило позволяет найти критические Т; однако оно – довольно грубое приближение, и соблюдается лишь при условии, что состав выражен в весовых %.
Лекция 14
Активность компонентов раствора. Коэффициент распределения вещества в двух несмешивающихся растворителях. Экстракция.
Уравнения для химического потенциала компонентов реального раствора имеют вид :
(1)
i
= iо
(T)
+ RT
ln
![]() пар – идеальный газ
пар – идеальный газ
(2)
i
= iо
(T)
+ RT
ln
![]() пар – реальный газ
пар – реальный газ![]()
Уравнение для химического потенциала компонента в идеальном растворе :
(3) i = iо (T) + RT ln Ni
Видно, что отношение Pi / Pio (или fi /fio ) играет такую же роль в уравнениях для реального раствора, что и мольная доля Ni в уравнениях для идеального раствора. Это отношение называется термодинамической активностью компонента раствора (или просто активностью компонента) :i
ai = ; ai =
(4) i = iо (T) + RT ln ai – выражение для химического потенциала любого неидеального раствора. Используя это уравнение, можно для любого реального раствора получить термодинамические уравнения, которые будут иметь тот же вид, что и уравнения для идеального раствора, но вместо Ni – ai .
При наличии разных значений химического потенциала компонента в различных частях изотермической системы компонент переходит (путем диффузии и др. способами) из части системы с большим значением в часть, где эта величина меньше. Очевидно, что в идеальных растворах (газовых, жидких, твердых) компонент самопроизвольно переходит от части раствора с большей концентрацией этого компонента в часть с меньшей концентрацией; в реальных системах компонент переходит в направлении меньших величин ai . При равновесии эти величины равны во всех частях раствора в одном растворителе, между которыми возможно свободное перемещение компонента.
В соответствии с уравнениями (1) и (2) термодинамической характеристикой компонента раствора может быть его парциальное давление Pi или летучесть fi в насыщенном паре над раствором. Однако эти величины для малолетучих компонентов практически неопределимы, тогда как активность ai может быть определена не только из уравнений (ai = Pi /Pio , ai = fi /fio ), но и др. методами, не требующими измерения давления пара – об этом будет сказано в дальнейшем.
Метод активности в термодинамике – формальный прием, он заключается во введении новой функции состояния, промежуточной между химическим потенциалом и концентрацией. Он ничего не дает для понимания причин, вызывающих то или иное отклонение данного раствора от закона идеальных растворов. Однако этот метод упрощает формальную математическую разработку термодинамики растворов.
Как видно из уравнений для аi , активность компонента в данном растворе есть относительная летучесть ( или относительное давление пара), т.е. отношение летучести при данных условиях к летучести в известном стандартном состоянии. Для стандартного состояния летучесть равна fio и ai = 1. Стандартное состояние – чистый жидкий компонент при той же Т. Однако часто приходится выбирать иные стандартные состояния, т.к. большое число веществ в широком интервале Т существует в твердом состоянии и, кроме того, давления насыщенного пара компонента часто ничтожно малы в опытных условиях.
Изотермы ai – Ni для некоторых растворов (бинарных смесей) :
А В Идеальный раствор (в соответствии с законом Генри) ai = Ni (дибромпропан-дибромэтан) |
А В Положительное отклонение от закона Рауля
ai Ni (бензол-ацетон) |
|
Мерой отклонения свойств раствора от свойств идеального раствора той же концентрации является коэффициент активности компонента i :
i
=
![]() =
=
![]() =
=
![]()
Для идеальных растворов i = 1 ; при наличии положительных отклонений Рi PioNi и i 1 ; в случае отрицательных отклонений Рi PioNi и i 1. В предельно разбавленных растворах, где применим закон Рауля, коэффициенты активности растворителя и растворенных веществ равны 1, если правильно выбраны стандартные состояния.
Возможно сопоставление активностей компонентов с концентрациями, выраженными не только в мольных долях Ni , но и в других единицах :
1) Мольные доли (N) : aN = N
– рациональный коэффициент активности
aN N при N 0 ; aN = N
(индекс указывает на предельно разбавленный раствор)
2) Мольно-объемная концентрация (молярность с) : aC = f c
f – мольный коэффициент активности
aC c при с 0 ; аС = с
3) Моляльность (m) : am = m
– практический (моляльный) коэффициент активности
am m при m 0 ; am = m
широко используется, особенно в применении к электролитам; f используется реже.
В концентрированных растворах все три коэффициента активности различны по величине. В достаточно разбавленных растворах, где величины N, c, m компонента пропорциональны друг другу, коэффициенты , f, равны.


 Т
Т Т
Т Т
Т 1
1
1
1

