
- •I. Количества веществ относятся к известному количеству раствора.
- •II. Количества веществ относятся к известному количеству растворителя.
- •Теории растворов.
- •Термодинамика многокомпонентных систем. Химические потенциалы.
- •Уравнения Гиббса-Дюгема.
- •Соотношение между химическими потенциалами компонента, входящего в состав нескольких фаз гетерогенной системы.
- •Термодинамические функции идеальных растворов газов (смесей идеальных газов).
- •Неидеальные растворы газов. Летучесть компонентов раствора.
- •Ограниченная взаимная растворимость газов.
- •Давление насыщенного пара бинарных жидких растворов.
- •Закон рауля. Идеальные растворы.
- •Реальные растворы. Отклонения от закона Рауля.
- •Диаграмма равновесия жидкость – пар в бинарных системах.
- •Фракционная (дробная) перегонка. Разделение азеотропных растворов.
- •Ограниченная взаимная растворимость жидкостей.
- •Коэффициент распределения вещества в двух несмешивающихся растворителях. Экстракция.
- •Растворимость газов в жидкостях.
- •Идеальная растворимость твердых веществ.
- •Отклонения от идеальной растворимости.
- •Зависимость растворимости твердых веществ от давления.
- •Криоскопия. Эбуллиоскопия. Криоскопия (Понижение температуры замерзания растворов).
- •Эбуллиоскопия (Повышение т кипения растворов нелетучих веществ).
- •Осмотическое давление.
- •Термодинамика осмотического давления.
- •Интегрируем, считая const :
- •Коллигативные свойства растворов.
Эбуллиоскопия (Повышение т кипения растворов нелетучих веществ).
Жидкость начинает кипеть, когда давление ее насыщенного пара становится равным внешнему давлению. Т.к. пар раствора нелетучего вещества содержит лишь чистый растворитель, то, в соответствии с законом Рауля, давление насыщенного пара такого раствора всегда меньше давления насыщенного пара чистого растворителя при той же Т.
P B B B
Po C C C
A A A
T To T1 T2
|
АВ – зависимость давления насыщенного пара чистого растворителя от Т; АВ, АВ – зависимость давления насыщенного пара растворов разной концентрации от Т, N N. Видно : чем больше N (мольная доля растворенного вещества в растворе), тем больше Т = Т – То. |
Пусть раствор предельно разбавлен, так что он подчиняется закону Рауля. Найдем количественную зависимость Т от концентрации раствора при давлении насыщенного пара, равном постоянному внешнему давлению:
Р1 = Р1оN1 = Po = const
Логарифмируем и дифференцируем это уравнение :
![]() =
=
![]() +
+
![]() =
=
![]() = 0 (если Ро
= 1 атм)
= 0 (если Ро
= 1 атм)
В соответствии с уравнением Клапейрона-Клаузиуса :
=
![]() = –
= –
= –
= –
![]()
![]() =
=
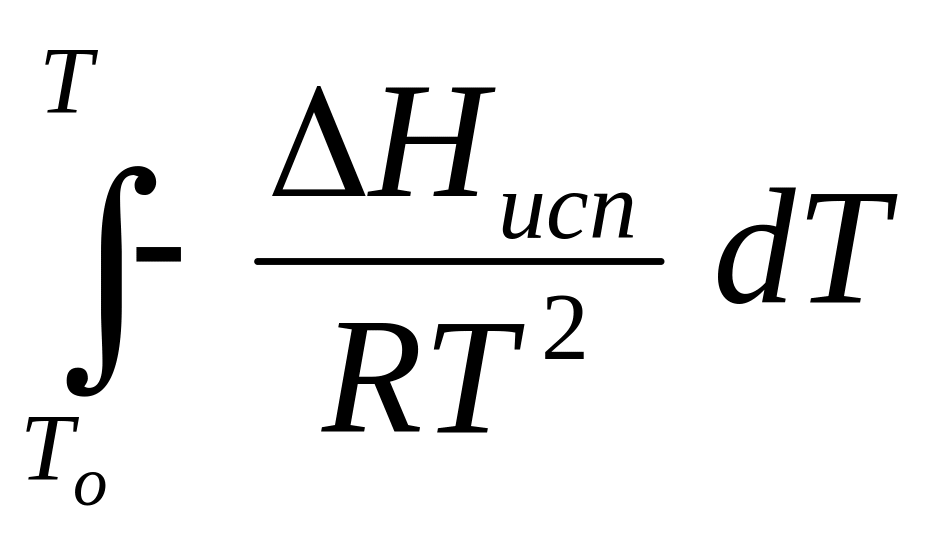
Нисп = const в небольшом интервале Т.
ln
(1 – N)
= –
![]()
![]() = –
= –
![]()
Т.к. величина N достаточно мала, можно разложить ln в ряд и ограничиться первым членом разложения :
– ln (1 – N) = N + + …
Т.к. Т мала, то То Т1 То2. Тогда
N
=
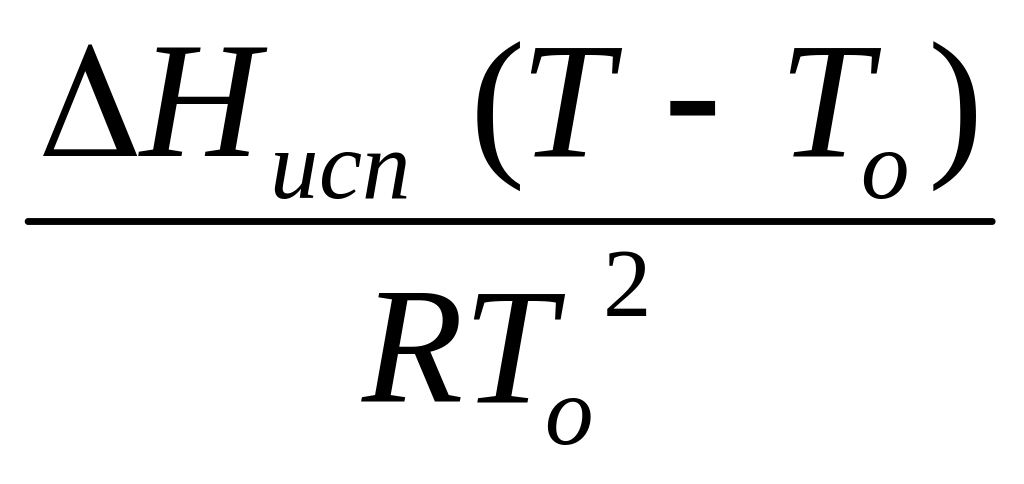 ; Ткип
= Т – То
=
; Ткип
= Т – То
=
 N
N
В разбавленных растворах
N = =
(М1 и М2 – молекулярные веса компонентов, g1 и g2 – их весовые количества в растворе). Положим g1 = 1000 г, тогда g2/М2 = m – моляльность раствора. Получим :
Ткип
=
=
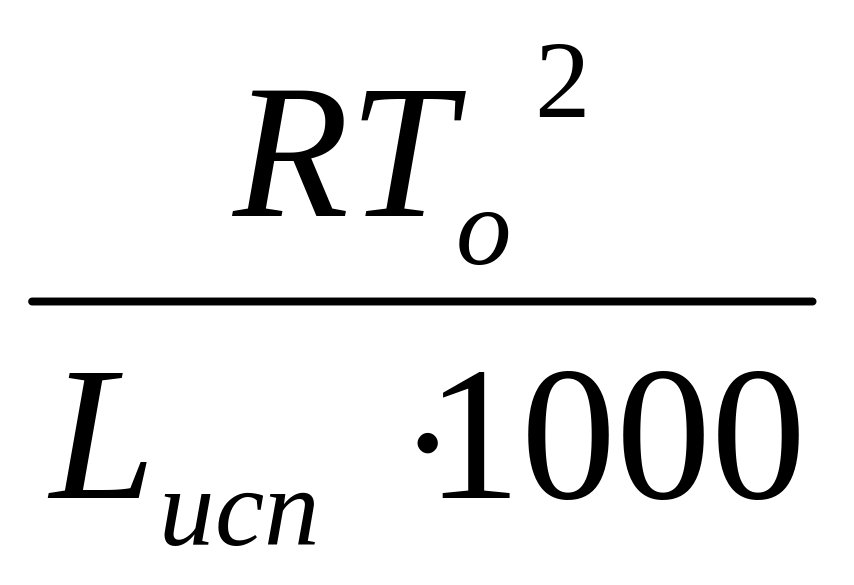 m
m
Lисп = Нисп /М1 – удельная теплота испарения растворителя.
Тисп = Еm = Е
Е – const, характерная для данного растворителя; не зависит от природы растворенного вещества; называется эбуллиоскопической постоянной. Физический смысл Е : равна повышению Ткип одномоляльного раствора; иначе Е называют молекулярным повышением Т кипения. В действительности при m 1 уравнение перестает быть правильным из-за введенных математических упрощений и отклонений от закона Рауля.
Приведенное уравнение дает возможность вычислять молекулярный вес растворенного вещества М2, если известно Ткип раствора определенной весовой концентрации. Метод определения М2 по уравнению называют эбуллиоскопией (эбуллиометрией).
Е = 0,529 2,61-2,64 1,48 2,4 6,09 5,5
вода бензол ацетон этиловый эфир камфара CCl4
Лекция 17

