- •I. Количества веществ относятся к известному количеству раствора.
- •II. Количества веществ относятся к известному количеству растворителя.
- •Теории растворов.
- •Термодинамика многокомпонентных систем. Химические потенциалы.
- •Уравнения Гиббса-Дюгема.
- •Соотношение между химическими потенциалами компонента, входящего в состав нескольких фаз гетерогенной системы.
- •Термодинамические функции идеальных растворов газов (смесей идеальных газов).
- •Неидеальные растворы газов. Летучесть компонентов раствора.
- •Ограниченная взаимная растворимость газов.
- •Давление насыщенного пара бинарных жидких растворов.
- •Закон рауля. Идеальные растворы.
- •Реальные растворы. Отклонения от закона Рауля.
- •Диаграмма равновесия жидкость – пар в бинарных системах.
- •Фракционная (дробная) перегонка. Разделение азеотропных растворов.
- •Ограниченная взаимная растворимость жидкостей.
- •Коэффициент распределения вещества в двух несмешивающихся растворителях. Экстракция.
- •Растворимость газов в жидкостях.
- •Идеальная растворимость твердых веществ.
- •Отклонения от идеальной растворимости.
- •Зависимость растворимости твердых веществ от давления.
- •Криоскопия. Эбуллиоскопия. Криоскопия (Понижение температуры замерзания растворов).
- •Эбуллиоскопия (Повышение т кипения растворов нелетучих веществ).
- •Осмотическое давление.
- •Термодинамика осмотического давления.
- •Интегрируем, считая const :
- •Коллигативные свойства растворов.
Зависимость растворимости твердых веществ от давления.
Обычное представление о малом влиянии Р на растворимость твердых тел в жидкостях справедливо лишь при небольших Р. Однако в настоящее время доступный для исследования диапазон Р расширился до десятков тысяч атмосфер и влияние Р на растворимость оказалось значительным.
Применяя ту же схему вывода, что и для зависимости растворимости от Т, можно получить следующее уравнение :
![]() =
–
=
–
![]() – уравнение
Планка – Ван-Лаара
– уравнение
Планка – Ван-Лаара
![]() =
=
![]() –
–
![]() – прирост объема при растворении 1
моля твердого вещества в его насыщенном
растворе. Уравнение
применимо к идеальным и предельно
разбавленным растворам.
– прирост объема при растворении 1
моля твердого вещества в его насыщенном
растворе. Уравнение
применимо к идеальным и предельно
разбавленным растворам.
Лекция 16
Криоскопия. Эбуллиоскопия. Криоскопия (Понижение температуры замерзания растворов).
Раствор не затвердевает целиком при одной Т. Кристаллы начинают выделяться при одной Т; по мере понижения Т количество кристаллов растет и, наконец, раствор отвердевает. Затвердевание раствора происходит в интервале Т.
Т начала кристаллизации (т.е. та Т, при которой начинается образование кристаллов) – это не что иное, как Т, при которой этот раствор становится насыщенным относительно твердого растворителя. При этой Т раствор и твердый растворитель находятся в равновесии и давления насыщенного пара растворителя над раствором и над твердым растворителем должны быть равны. Т.к. давление пара растворителя над раствором всегда меньше, чем над чистым растворителем при той же Т, то раствор будет затвердевать при более низкой Т, чем растворитель. Это видно из рис. :
P
D
A C D D A C A C
В
T2 T1 To Т |
ВС – показывает зависимость давления насыщенного пара чистого твердого растворителя от Т; AD – зависимость давления насыщенного пара чистого жидкого растворителя от Т; AD, AD – давление пара растворителя над растворами нелетучего вещества с концентрациями N N. |
Точки пересечения этих кривых (точки С, С, С) – это Т начала затвердевания чистого жидкого растворителя (То) и растворов (Т1, Т2 …). Видно, что понижение Т начала затвердевания становится более значительным по мере увеличения концентрации раствора.
Найдем количественную зависимость между понижением Т начала затвердевания раствора и его концентрацией. Уравнение для идеальной растворимости твердых веществ имеет вид (N – концентрация растворенного вещества):
lnN = – ( – )
Подставим концентрацию растворителя N1 = 1 – N :
ln
(1
– N) = –
![]()
![]()
To
– T1
= T
= –
![]() ln
(1
– N)
ln
(1
– N)
Т.к. величина N достаточно мала, можно разложить ln в ряд и ограничиться первым членом разложения :
– ln
(1
– N) = N +
![]() + …
+ …
Т.к. Т мала, то То Т1 То2. Тогда
Т
=
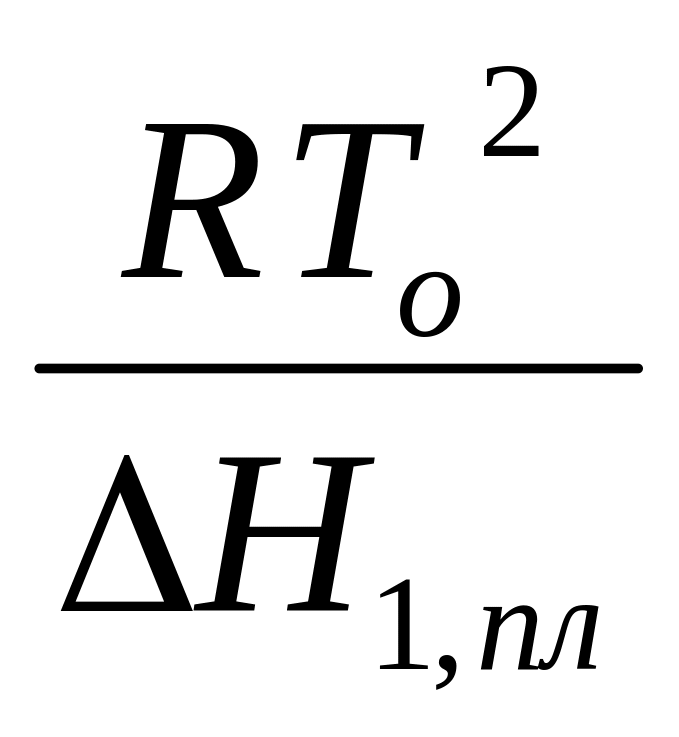
N
N
В разбавленных растворах
N
=
![]()
=
=
![]()
(М1 и М2 – молекулярные веса компонентов, g1 и g2 – их весовые количества в растворе). Положим g1 = 1000 г, тогда g2/М2 = m – моляльность раствора. Получим :
Т
![]() =
=
![]() =
=
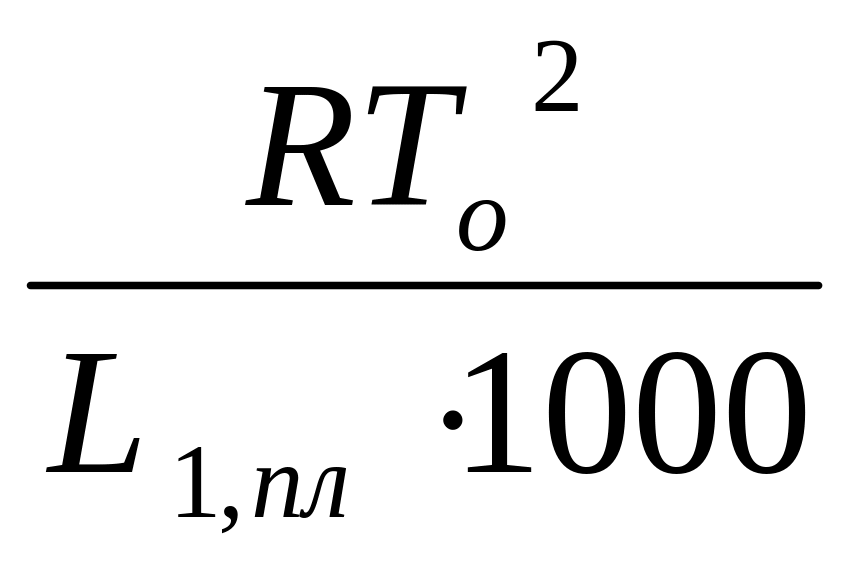 m
m
L1, пл = Н1, пл /М1 – удельная теплота плавления растворителя.
Тзам = Кm
К зависит только от свойств чистого растворителя и характерна для данного растворителя. Физический смысл К : она равна понижению Т затвердевания одномоляльного раствора. К называют молекулярным понижением точки затвердевания раствора. Уравнение :
Тзам
= Кm
= К
![]()
дает возможность определить молекулярный вес М2 растворенного вещества по понижению точки затвердевания Т раствора этого вещества, содержащего g2 г его в 1000 г растворителя.
Изучение Т затвердевания растворов называют криоскопией, а метод определения молекулярных весов – криоскопическим. К называют также криоскопической константой. Определение молекулярных весов криоскопическим методом является более точным, чем их определение эбуллиоскопическим методом. Для повышения точности измерения Т удобно пользоваться растворителями с высокими значениями К (камфарой или камфеном – метод Раста).
К = 1,84 4,9 3,9 7,4 40
вода бензол уксусн. к-та фенол камфора
Правильные результаты получаются при отсутствии диссоциации или ассоциации молекул растворенного вещества в разбавленном растворе. Если молекулярный вес известен из др. данных, то по Тзам можно получить степень диссоциации или ассоциации молекул растворенного вещества.
В случае идеальных растворов уравнение ln (1 – N) = – можно использовать для определения Т затвердевания растворов любого состава. Это уравнение неприменимо для неидеальных растворов. Применяя уравнение = к растворителю и интегрируя его, можно из криоскопических данных вычислить активность растворителя в реальном растворе. Это один из наиболее точных методов вычисления активности.