
- •I. Количества веществ относятся к известному количеству раствора.
- •II. Количества веществ относятся к известному количеству растворителя.
- •Теории растворов.
- •Термодинамика многокомпонентных систем. Химические потенциалы.
- •Уравнения Гиббса-Дюгема.
- •Соотношение между химическими потенциалами компонента, входящего в состав нескольких фаз гетерогенной системы.
- •Термодинамические функции идеальных растворов газов (смесей идеальных газов).
- •Неидеальные растворы газов. Летучесть компонентов раствора.
- •Ограниченная взаимная растворимость газов.
- •Давление насыщенного пара бинарных жидких растворов.
- •Закон рауля. Идеальные растворы.
- •Реальные растворы. Отклонения от закона Рауля.
- •Диаграмма равновесия жидкость – пар в бинарных системах.
- •Фракционная (дробная) перегонка. Разделение азеотропных растворов.
- •Ограниченная взаимная растворимость жидкостей.
- •Коэффициент распределения вещества в двух несмешивающихся растворителях. Экстракция.
- •Растворимость газов в жидкостях.
- •Идеальная растворимость твердых веществ.
- •Отклонения от идеальной растворимости.
- •Зависимость растворимости твердых веществ от давления.
- •Криоскопия. Эбуллиоскопия. Криоскопия (Понижение температуры замерзания растворов).
- •Эбуллиоскопия (Повышение т кипения растворов нелетучих веществ).
- •Осмотическое давление.
- •Термодинамика осмотического давления.
- •Интегрируем, считая const :
- •Коллигативные свойства растворов.
Термодинамика осмотического давления.
Растворитель и раствор, разделенные полупроницаемой перегородкой и находящиеся в равновесии, представляют две фазы, один из компонентов которых, свободно проходящий из одной фазы в другую, должен иметь в обеих фазах равные химические потенциалы.
В чистом растворителе его химический потенциал 1о = const при Т, Р1 = const (Р1 – внешнее давление). В растворе же его значение 1 изменяется с изменением мольной доли N1 и давления Р2 (Р2 = Р1 + – сумма первоначального давления и дополнительного гидростатического давления в растворе, равного ). Это изменение можно найти, дифференцируя равенство 1 = 1о по N1 и Р2 , учитывая, что d1o = 0.
d1
=
![]() dN1
+
dN1
+
![]() dP2
= d1o
= 0
dP2
= d1o
= 0
=
![]() =
=
![]() =
=
![]()
(
Т.к. i
=
и
![]() = V
)
= V
)
– обозначение частной производной по ni
1
= 1o
+ RT
ln
a1
= RT
![]()
RT dN1 + dP2 = 0
dP2
= –
![]() dN1
dN1
Интегрируем, считая const :
 = –
= –
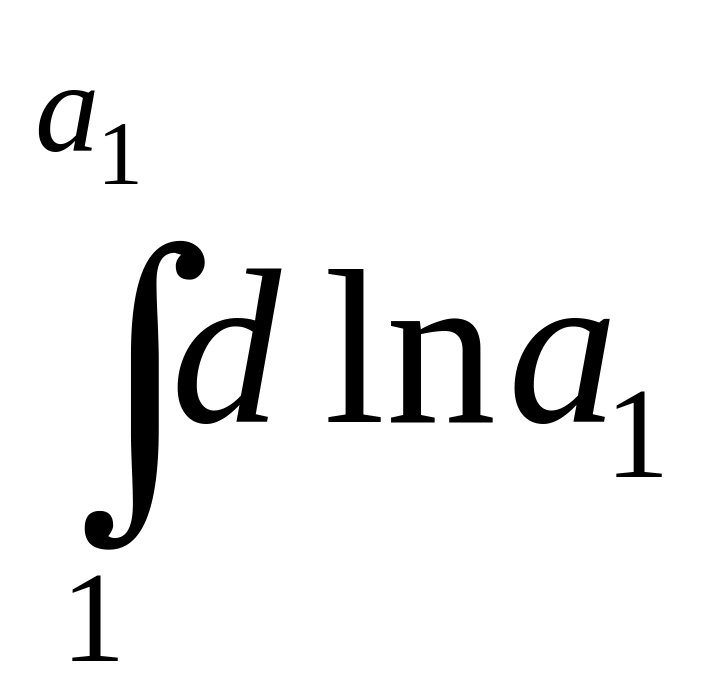
(пределы интегрирования : нижний – чистый растворитель, верхний – раствор)
Р1 + – Р1 = – ln a1
a1 = P1 / P1o ; P1 и P1o – давление насыщенного пара растворителя над раствором и над чистым растворителем.
=
–
ln
![]() (1)
(1)
Для идеальных растворов N1 = P1 / P1o (уравнение Рауля):
ид = – ln N1 = – ln (1 – N) (2)
Для разбавленных растворов (N 1):
– ln (1 – N) = N + + … N ; N =
разб
=
![]() =
=
![]()
n2
n2
Если n2 n1 , то n1 = V (объему раствора); n2 /V = c2 – моляльность. Окончательно получаем для разбавленных растворов уравнение Вант-Гоффа :
разб = с2RT = RT (3)
Т.о., это уравнение справедливо только для разбавленных растворов, подчиняющихся закону Рауля. При повышении концентрации, даже если раствор подчиняется закону Рауля, т.е. идеален, уравнение Вант-Гоффа неприменимо и заменяется уравнением (2); в общем же случае неидеальных растворов справедливо лишь уравнение (1).
Давление реальных газов в обычных условиях, как правило, меньше давления идеальных газов вследствие влияния кохезионных сил (сил притяжения между молекулами газа). Осмотическое давление реальных растворов значительно больше идеального раствора. Одно это обстоятельство указывает на то, что аналогия между осмотическим и газовым давлением случайна и не имеет существенного значения.
Осмотическое давление является тем добавочным давлением, которое увеличивает химический потенциал растворителя в растворе и этим компенсирует уменьшение химического потенциала растворителя, вызванное растворением второго компонента. Такая компенсация создает возможность равновесия раствора с чистым растворителем в особых условиях – при наличии полупроницаемой перегородки.
Коллигативные свойства растворов.
Величина разбавленных растворов пропорциональна числу молекул всех веществ, растворённых в данном объёме раствора, и не зависит от природы растворённых веществ. Это же относится и к величинам некоторых других свойств разбавленных растворов : относительное понижение давления пара растворителя, Тзам, Ткип. Все эти свойства разбавленных растворов носят название коллигативных свойств.
Величины коллигативных свойств прямо пропорциональны друг другу. Каждая из этих величин может быть использована для определения молекулярного веса растворенного вещества; определение возможно только при отсутствии ассоциации или диссоциации растворенного вещества в растворе. Ассоциация молекул растворителя и сольватация (присоединение молекул растворителя к молекулам растворенных веществ) не препятствует определению М растворенного вещества в разбавленных растворах.
Измерение как метод определения М нашло лишь ограниченное применение, главным образом для определения молекулярного веса ВМС.
