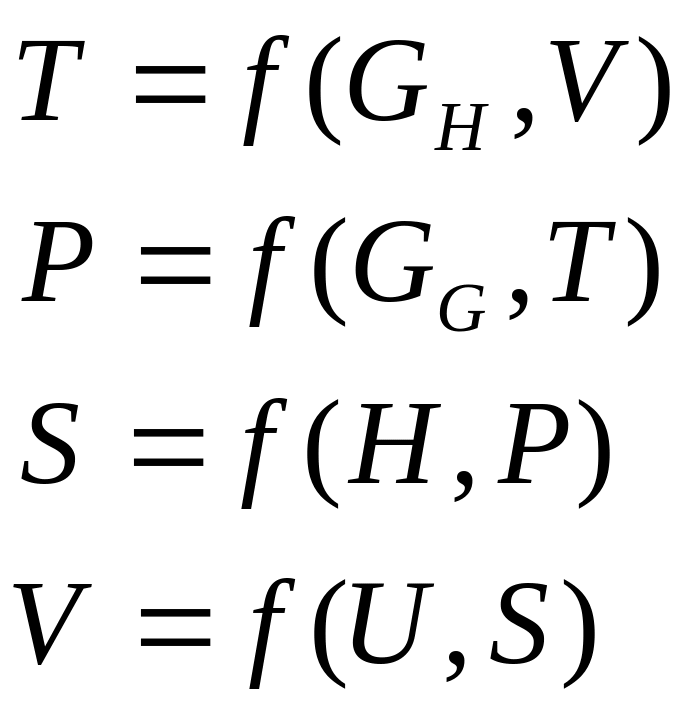- •Роль физико-химических процессов в технологии и конструировании электронных средств.
- •Основные термодинамические понятия.
- •Законы термодинамики.
- •Энтропия.
- •Условия равновесия термодинамических систем. Правило фаз.
- •Диаграммы состояния различных систем и их роль при проектировании технологических процессов.
- •Однокомпонентные системы.
- •Объемные диаграммы состояния.
- •Многокомпонентные системы.
- •Основные типы диаграмм равновесия бинарных систем.
- •Статистический характер второго закона термодинамики.
- •Характеристические функции и термодинамические потенциалы системы.
- •Явления и процессы на поверхности раздела двух фаз. Адсорбция физическая и химическая.
- •Термодинамическое равновесие поверхностного слоя с объемными фазами.
- •Растворы и их применение в технологии эс.
- •Виды химической связи между атомами. Равновесное состояние системы атомов. Основные свойства материалов, определяемые особенностями химической связи.
- •Металлическая связь:
- •Молекулярная связь:
- •Пространственное расположение частиц при образовании кристалла.
- •Кристаллические решётки. Типы симметрии и виды решёток. Индексы Миллера.
- •Структура жидкости.
- •Структура полимеров.
- •Жидкие кристаллы.
- •Образование и структура пленок.
- •2. Ионно-плазменное распыление:
- •3. Электрохимическое осаждение:
- •Получение тонких пленок на ориентирующих подложках (эпитаксия).
- •Особенности структуры пленок. Влияние физико-химических факторов на структуру и свойства пленок.
- •Влияние физико-химических факторов на свойства пленок.
- •Закономерности и механизмы диффузии в полупроводниковых и планарных структурах.
- •Диффузия в твердых телах. Механизмы диффузии.
- •Законы диффузии Фика.
- •Использование диффузии для введения примеси в полупроводниковые кристаллы. Диффузия из ограниченного и неограниченного источника.
- •Физические основы ионной имплантации.
Характеристические функции и термодинамические потенциалы системы.
Второй закон термодинамики и понятие об энтропии были введены в физику первоначально при рассмотрении наиболее простого вида систем – систем изолированных, т.е. лишенных обмена энергией или веществом с окружающей средой. Только для таких систем направление самопроизвольного течения процессов и условия равновесия могли быть выражены однозначно через изменение энтропии S. Однако на практике большей частью приходится иметь дело с системой взаимодействующей с окружающей средой. Энтропия мало подходит для характеристики процессов в этих условиях.
В конце прошлого века в результате работ Гиббса, Массье, Гельмгольца и других были открыты термодинамические функции, изменения которых при тех или иных условиях существования системы давали возможность в простой форме определить направление самопроизвольного течения процесса и условия равновесия.
Характеристической функцией называется такая функция состояния системы, посредством которой или её производных могут быть выражены в явной форме термодинамические свойства системы.
Работа равновесного термодинамического процесса может быть рассчитана из следующего выражения:
![]() (1)
(1)
d – полный дифференциал;
- бесконечно малое изменение этой величины.
Отсюда:
![]() (2)
(2)
где Q – теплота; А – работа; U – внутренняя энергия системы.
А – для работы расширения по бесконечно малому объему:
![]() (3)
(3)
![]()
![]() (4)
(4)
Если подставить (3) и (4) в (2), то
![]() (5)
(5)
Термодинамическая система при стремлении к равновесию высвобождает часть внутренней энергии, передавая её в окружающую среду в виде теплоты или работы, эта составляющая внутренней энергии представляемая окружающей среде называется свободной энергией – G.
Свободная энергия имеет две составляющие тепловую и потенциальную. Взаимосвязь этих составляющих свободной энергии лежит в основе ряда физических явлений и превращений.
Свободная энергия является функцией состояния системы, поэтому её изменение зависит только от разности начальных и конечных состояний системы и не зависит от пути перехода из одного состояния в другое.
![]() ,
,
где Р – давление;
Т – температура;
V – объем;
Sn – площадь поверхности системы;
С – концентрация компонентов;
Се – концентрация электрического заряда;
Е – напряженность электрического поля;
Hm – напряженность магнитного поля;
g – гравитационный потенциал.
Для удобства обозначим:
![]()
dG – функция от параметров состояния системы. Если параметры состояния термодинамической системы известны, то её можно описать следующим уравнением:
![]() (6)
(6)
Пусть в систему входит к – компонентов, тогда концентрация:
![]()
![]()
Частные производные от свободной энергии G по параметрам системы входящим в уравнение (6) имеют определенный физический смысл:
![]() -объем
системы;
-объем
системы;
![]() -
энтропия системы;
-
энтропия системы;
![]() -
давление системы;
-
давление системы;
![]() -
энергия поверхностного натяжения;
-
энергия поверхностного натяжения;
![]() -
химический потенциал i
–го компонента;
-
химический потенциал i
–го компонента;
![]() -
энергия Ферми;
-
энергия Ферми;
![]() -
температура;
-
температура;
и т.д.
![]() -
параметрические потенциалы системы.
-
параметрические потенциалы системы.
Если для конкретной термодинамической системы некоторые параметры системы неважные, то уравнение (6) можно упростить. В отсутствии электрических, магнитных и гравитационных полей уравнение (6) можно записать:
![]() (8)
(8)
Часть
свободной энергии системы G,
которая может превращаться в работу
расширения, обозначается
![]() и рассчитывается:
и рассчитывается:
![]() (9)
(9)
![]() - свободная энергия Гельмгольца
(изохорный потенциал).
- свободная энергия Гельмгольца
(изохорный потенциал).
Если имеют место другие виды работы, кроме работы расширения, то функцию состояния можно записать следующим образом:
![]() (10)
(10)
![]() - свободная энергия Гиббса (изобарный
потенциал).
- свободная энергия Гиббса (изобарный
потенциал).
Энтальпия Н – это функция состояния системы, численно равная количеству теплоты выделяемой или поглощаемой системой в данном процессе:
![]() (11)
(11)
Связь между свободной энергией Гельмгольца и внутренней энергией системы определяется уравнением:
![]() (12)
(12)
Связь между свободной энергией Гиббса и этальпией определяется:
![]() (13)
(13)
Подставим выражения для частных производных и в (12) и (13):
 (14)
(14)
Получим:
 (15) уравнение Гиббса – Гельмгольца.
(15) уравнение Гиббса – Гельмгольца.
Внутренняя энергия U, свободная энергия Гельмгольца , свободная энергия Гиббса , энтальпия Н и энтропия S – наиболее широко применяемые в термодинамике характеристические функции. Они также называются термодинамическими потенциалами. Через их производные можно явно выразить все термодинамические свойства системы.
Из выражений (5), (9), (10), (11) видно, что систему можно характеризовать не только через характеристические функции U, , и Н, но и через параметры состояния T, P, S, V если выразить их через характеристические функции, так, например: