
- •Роль физико-химических процессов в технологии и конструировании электронных средств.
- •Основные термодинамические понятия.
- •Законы термодинамики.
- •Энтропия.
- •Условия равновесия термодинамических систем. Правило фаз.
- •Диаграммы состояния различных систем и их роль при проектировании технологических процессов.
- •Однокомпонентные системы.
- •Объемные диаграммы состояния.
- •Многокомпонентные системы.
- •Основные типы диаграмм равновесия бинарных систем.
- •Статистический характер второго закона термодинамики.
- •Характеристические функции и термодинамические потенциалы системы.
- •Явления и процессы на поверхности раздела двух фаз. Адсорбция физическая и химическая.
- •Термодинамическое равновесие поверхностного слоя с объемными фазами.
- •Растворы и их применение в технологии эс.
- •Виды химической связи между атомами. Равновесное состояние системы атомов. Основные свойства материалов, определяемые особенностями химической связи.
- •Металлическая связь:
- •Молекулярная связь:
- •Пространственное расположение частиц при образовании кристалла.
- •Кристаллические решётки. Типы симметрии и виды решёток. Индексы Миллера.
- •Структура жидкости.
- •Структура полимеров.
- •Жидкие кристаллы.
- •Образование и структура пленок.
- •2. Ионно-плазменное распыление:
- •3. Электрохимическое осаждение:
- •Получение тонких пленок на ориентирующих подложках (эпитаксия).
- •Особенности структуры пленок. Влияние физико-химических факторов на структуру и свойства пленок.
- •Влияние физико-химических факторов на свойства пленок.
- •Закономерности и механизмы диффузии в полупроводниковых и планарных структурах.
- •Диффузия в твердых телах. Механизмы диффузии.
- •Законы диффузии Фика.
- •Использование диффузии для введения примеси в полупроводниковые кристаллы. Диффузия из ограниченного и неограниченного источника.
- •Физические основы ионной имплантации.
Многокомпонентные системы.
Для решения практических задач используют диаграммы состояния многокомпонентных систем. Они позволяют представить связь между параметрами состояния и электрофизическими свойствами системы.
Получить нужное свойство сплава или раствора можно изменив его состав или структуру. Данные необходимые для такого подбора приводятся в справочниках.
Для разработки технологического синтеза полупроводниковых соединений и сплавов, для легирования их различными примесями, для выращивания монокристаллов и эпитаксиальных слоев необходимо знание диаграмм равновесия однокомпонентных или многокомпонентных систем содержащих полупроводниковые фазы.
По характеру диаграммы равновесия бинарных или многокомпонентных систем делятся на различные типы, причем многообразие их тем больше, чем больше число компонентов входящих в их состав. Основное влияние на структуру диаграммы равновесия оказывает склонность компонентов к взаимодействию в твердом, жидком и газообразном состоянии, т.е. их взаимная растворимость (полная или частичная), образование химических соединений (промежуточных фаз). Реальные диаграммы состояния строятся на основе ряда экспериментальных исследований (термический анализ, фазовый анализ). Однако основные типы диаграмм и их элементы могут быть выведены из теории термодинамических потенциалов и на основе знаний термодинамических свойств.
Основные типы диаграмм равновесия бинарных систем.

Существует несколько видов простейших диаграмм равновесия бинарных систем. Они различаются между собой характером взаимодействия компонентов А и В в твердом состоянии.
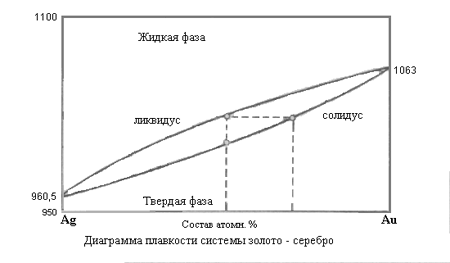
а) системы, компоненты которых образуют растворы (полная растворимость), твердые растворы – смешанные кристаллы.
Состав фаз определяется по правилу рычага: Точка, отвечающая составу гетерогенной двойной системы, располагается на прямой, соединяющей точки, представляющие сосуществующие фазы. При этом отрезки, отсекаемые на прямой этой точкой, обратно пропорциональны количествам каждой из фаз.
б) системы с полной растворимостью:
с точкой максимума и с точкой минимума.


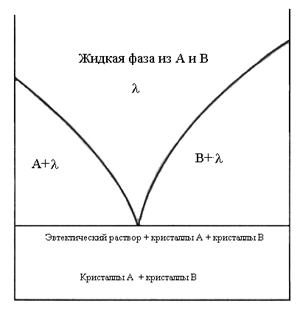
в) диаграмма типа эвтектика – полная растворимость в жидком состоянии и полная нерастворимость в твердом.

д) эвтектика из твердых растворов и . Полная растворимость в жидком состоянии, и ограниченная растворимость в твердом.
П утем
различных сочетаний основных элементов
диаграмм можно получить все многообразие
диаграмм равновесия, которое встречается
в реальных бинарных системах.
утем
различных сочетаний основных элементов
диаграмм можно получить все многообразие
диаграмм равновесия, которое встречается
в реальных бинарных системах.
Если пик дистектики имеет острую форму, то вещества образуют устойчивое химическое соединение, если - тупую, то химическое соединение неустойчивое.
Статистический характер второго закона термодинамики.
Первый закон термодинамики справедлив для обычных систем, состоящих из большого числа частиц, и для систем состоящих из небольшого числа частиц, и для отдельных частиц. Второй же закон носит статистический характер и относится исключительно к системам, состоящим из очень большого числа частиц, так как только к таким системам строго применимы законы статистики. Если же рассматривать системы из не очень большого числа частиц, то выводы из второго закона не могут быть строго применимы к ним. К системам, состоящим из малого числа частиц, второй закон не относится.
Как хорошо видно на примере газов такие понятия, как температура и давление, играющие основную роль в термодинамике, обладают по существу статистической природой, т.е. являются выражением некоторых свойств вещества, обусловленных совместным действием очень большого числа частиц.
Температура определяется средней кинетической энергией поступательного движения частиц, хотя кинетическая энергия отдельных частиц может значительно отличаться от этой величины. Точно также давление газа выражает суммарный эффект ударов молекул о стенку сосуда и является величиной средней для большого количества молекул, отдельные из которых обладают в момент удара самыми различными количествами движения и ударяются о стенку под самыми разными углами.
Статистической природой обладают такие величины, как плотность, удельный или мольный объем и.т.д.
Системы, состоящие из очень большого числа частиц, мы не можем в настоящее время описывать на основе обычных законов механики. Но, применяя теорию вероятности, законы которой в сочетании с законами механики образуют статистическую механику, можно определить большую или меньшую вероятность данного состояния системы. Системы с большим числом частиц достаточно строго описываются законами вероятности, и отклонения настолько маловероятны, что практически их можно считать невозможными.
Второй закон термодинамики с этой точки зрения устанавливает критерий большей или меньшей вероятности сравниваемых состояний и то, что в системе, состоящей из большого числа частиц, самопроизвольно могут происходить переходы только из состояния менее вероятного в состояние более вероятное.
Так возможность самопроизвольного перехода теплоты от более горячего тела к более холодному и невозможность самопроизвольного течения процесса в обратном направлении объясняется так:
Если в системе из двух тел с разной температурой, частицы, обладающие в среднем большей кинетической энергией в одной части, то через некоторое время за счет беспорядочного соударения частиц установится равномерное распределения средней кинетической энергией, что будет отвечать выравниванию температуры.
Процесс обратный соответствовал бы тому, что молекулы с большей кинетической энергией («более горячие») должны были бы сгруппироваться в одной части системы, а «более холодные» в другой, что, очевидно, является процессом совершенно невероятным, т.е. практически невозможным. При малом же числе частиц таких выводов сделать нельзя.
Макроскопическое состояние, характеризуемое определенными термодинамическими параметрами, может существовать при различном распределении молекул, т.е. оно осуществляется разными микросостояниями отличающимся друг от друга по определенному признаку. Вероятность каждого макросостояния пропорционально числу микросостояний, которыми оно осуществляется. Это число называется термодинамической вероятностью, этой величиной в статистической физике пользуются как мерой вероятности состояний.
Чтобы от термодинамической вероятности перейти к математической вероятности, необходимо значение термодинамической вероятности разделить на полное число всех возможных распределений молекул по данному признаку. Математическая вероятность всегда меньше единицы, а термодинамическая вероятность выражается большими числами.
Имеем
систему, состоящую из двух частей. Всего
N
молекул, в одной части
![]() - молекул, в другой (N-
).
- молекул, в другой (N-
).
Термодинамическая
вероятность:
![]()
Таким образом, второй закон термодинамики является не абсолютным законом, а статистическим, который соблюдается с высокой степенью точности для большого количества молекул, и тем меньше применим, чем меньше размеры системы.
Статистический характер второго закона термодинамики установил Больцман, который установил связь между энтропией системы и вероятностью состояния системы.
Энтропия S и термодинамическая вероятность W возрастает при необратимых процессах приближающих систему к равновесию и принимает максимальное значение при равновесии системы.
![]()
S
– аддитивна, т.е.
![]() ,
,
а
W
– мультипликативна, т.е.
![]() .
.
![]() т.к.
т.к.
![]() ;
;![]() и.т.д.
то
и.т.д.
то
![]()
Отсюда следует, что функция f является логарифмической, т.е. функция произведения равна сумме функций отдельных частей.
Результатом решения этого уравнения является уравнение Больцмана, устанавливающее связь между S и W:
![]()
Возьмем в рассмотрение термодинамическую систему представляющую идеальный кристалл, т.е. кристалл без дефектов структуры и рассмотрим при Т=0К.
Вероятность
состояния такой системы при абсолютном
нуле равна единице. При абсолютном нуле
кристалл может быть осуществлен только
одним распределением молекул, атомов,
ионов. Все молекулы данного сорта
неразличимы по своим энергиям и
расположению и обмен местами различных,
по какому – либо признаку молекул
невозможен, тогда: если
![]() (Постулат
Планка).
(Постулат
Планка).
