
- •Значение периодического закона
- •2. Горение
- •3. Разложение.
- •4. Изомеризация.
- •2. Циклоалканы, их общая формула, строение, свойства, нахождение в природе, практическое значение.
- •1. Реакции окисления.
- •2. Реакции присоединения.
- •3. Реакции полимеризации.
- •2. Реакции присоединения
- •3. Полимеризация
- •1. Реакции окисления
- •2. Реакции присоединения
- •3. Полимеризация
- •1. Окисление.
- •2. Реакции замещения.
- •3. Реакции присоединения
- •1. Все атомы, образующие молекулы органических веществ, связаны в определённой последовательности согласно их валентности.
- •2. Свойства веществ зависят не только от того, какие атомы и в каком количестве входят в состав молекулы, но и от порядка соединения атомов в молекуле (то есть от химического строения).
- •3. По свойствам данного вещества можно определить строение его молекулы, а по строению молекулы можно предвидеть свойства.
- •4. Атомы и группы атомов в молекулах веществ взаимно влияют друг на друга.
- •3. Изомерия положения функциональной группы.
- •4. Межклассовая изомерия.
- •2) По числу и составу исходных и образующихся веществ.
- •3) По тепловому эффекту.
- •4) По признаку обратимости.
- •4. Повышение температуры.
- •5. Катализаторы.
- •1. Соли, их состав и названия, взаимодействие с металлами, кислотами, щелочами, друг с другом с учетом особенностей реакций окисления-восстановления и ионного обмена.
- •1. Электрохимический ряд напряжений металлов. Вытеснение металлов из растворов солей другими металлами.
- •Свойства веществ в свете теории электролитической диссоциации. Ионные реакции.
- •2. Анилин взаимодействует с кислотами с образованием солей:
2) По числу и составу исходных и образующихся веществ.
а. Реакции разложения - реакции, в результате которых из одного вещества образуются несколько других веществ: АВ→А+В
Cu(OH)2→CuO+H2O
CH4→C+2H2
б. Реакции соединения - реакции, в результате которых из двух или нескольких веществ образуется одно новое вещество: А+В→АВ
СаО+Н2О→Са(ОН)2
СН2=СН2+Н2→СН3-СН3
Реакции замещения - реакции, при которых атомы простого вещества замещают атомы одного из элементов в сложном веществе: АВ+С→СВ+А. Реакции замещения всегда идут с изменением степеней окисления.
2AgNO3 + Fe → Fe(NO3)2 + 2Ag
Fe + 2HCl → FeCl2 + H2
В органической химии реакции замещения понимаются шире:
CH4+Cl2→CH3Cl+HCl
Реакции обмена - реакции, протекающие между двумя сложными веществами, при которых их составные части обмениваются местами: АВ+СD→CB+AD
Na2SO4
+ BaCl2
→
BaSO4![]() + 2NaCl
+ 2NaCl
NaOH+CH3COOH→CH3COONa+H2O
3) По тепловому эффекту.
Химические реакции по тепловому эффекту подразделяются на две группы:
а .Экзотермическими называют реакции, которые протекают с выделением теплоты:
2H2 + О2 → 2H2О + Q
б. Эндотермическими называют реакции, которые протекают с поглощением теплоты.
2CH4→C2H2+3H2 - Q
4) По признаку обратимости.
а. Необратимыми называют такие реакции, которые протекают до конца, то есть до полного израсходования одного из реагирующих веществ.
AlCl3
+ 3AgNO3
→
3AgCl![]() + Al(NO3)3
+ Al(NO3)3
б. Обратимые химические реакции протекают при данных условиях во взаимно противоположных направлениях.
N2
+ 3H2
![]() 2NH3
+ Q
2NH3
+ Q
N2 + O2 2NO – Q
2.
Предельные одноатомные спирты, их строение, свойства. Применение и получение этилового спирта.
Предельные одноатомные спирты (алканолы) содержат одну гидроксильную группу –ОН, соединённую с насыщенным углеводородным радикалом. Общая формула алканолов: СnH2n+1OH
Гидроксильная группа – ОН является функциональной группой спиртов. Функциональными группами называются группы атомов, которые обусловливают характерные химические свойства данного класса веществ.
Гомологический ряд алканолов: CH3OH метанол, метиловый спирт
C2H5OH этанол, этиловый спирт
C3H7OH пропанол
C4H9OH бутанол
C5H11OH пентанол
Изомерия C4H9OH
4 3 2 1
CH3 – CH2 – CH2 – CH2 – OH бутанол-1
3 2 1 4 3 2 1
СН3-СН-СН2-ОН СН3-СН2-СН-СН3
СН3 ОН
2-метилпропанол-1 2-бутанол
Физические свойства. Одноатомные предельные первичные спирты с короткой цепью углеродных атомов – жидкости, а высшие (начиная с С12Н25ОН) – твёрдые вещества. Метанол, этанол, пропанол – бесцветные жидкости, растворимы в воде, имеют спиртовой запах. Метанол – сильный яд. Все спирты ядовиты, обладают наркотическим действием.
Химические свойства
Растворы спиртов имеют нейтральную реакцию на индикаторы
Взаимодействие с щелочными металлами
2C2H5OH + Na → 2C2H5ONa + H2
этанол этилат натрия
Взаимодействие с галогеноводородами
C2H5OH + HCl →C2H5Cl + H2O
хлорэтан
Дегидратация (при t и в присутствии H2SO4)
C2H5OH → C2H4 + H2O
этилен
2 C2H5OH→ C2H5 –О— C2H5
диэтиловый эфир
Горение
C2H5OH + 3O2 → 2CO2 + 3H2O +Q
Окисление
C2H5OH + CuO → Cu + H2O + CH3-CHO
этанол уксусный альдегид
Взаимодействие с карбоновыми кислотами (реакция этерификации)
C2H5OH + CH3COOH → CH3COOC2H5 + H2O
Получение этанола:
Этанол получают из
этилена: C2H4 + HOH → C2H5OH (при катализаторе и t)
брожением глюкозы: C6H12O6 → 2C2H5OH + 2CO2
Применение этанола: получение уксусной кислоты, лекарств, духов и одеколонов, каучуков, горючего для двигателей, красителей, лаков, растворителей и других веществ.
Билет 12.
1.
Обратимость химических реакций. Химическое равновесие и способы его смещения: изменение концентрации реагирующих веществ, температуры, давления.
Реакции, протекающие при данных условиях как в прямом, так и в обратном направлении, называются обратимыми.
N2 + 3H2 2NH3 + Q
Одну из реакций называют прямой (→), другую обратной (←). В таких реакциях сколько молекул образуется в единицу времени, столько и расходуется.
При изменении условий (температуры, давления и концентрации) состояние равновесия нарушается. Смещение химического равновесия определяется по принципу Ле Шателье:
если на систему, находящуюся в равновесии, оказывать какое-либо воздействие, то равновесие смещается в направление ослабления этого воздействия.
Рассмотрим смещение равновесия на примере окисления оксида серы (IV):
2SO2 + O2 2SO3 + Q
2V + 1V = 2V
1. Реакции идёт с выделением тепла, при повышении температуры равновесие смещается влево, то есть в сторону обратной реакции, так как это смещение ослабит воздействие температуры.
2. При повышении давления равновесие смещается в сторону реакции, ведущей к уменьшению объёма. Данная реакция идёт с уменьшением объёма: взаимодействуют 2 объёма оксида серы (IV) + 1 объём кислорода = 3 объёма, а образуется 2 объёма оксида серы (VI), поэтому равновесие сместится вправо.
3. При увеличении концентрации исходных веществ равновесие смещается в сторону прямой реакции (вправо).
Таким образом, чтобы сместить равновесие в данной реакции вправо, нужно: уменьшить температуру, увеличить концентрацию исходных веществ и увеличить давление.
Катализаторы в равной степени ускоряют как прямую, так и обратную реакции и поэтому не смещают равновесие, но ускоряют наступление равновесия.
2.
Глицерин – представитель многоатомных спиртов. Строение, физические и химические свойства (реакция этерификации), применение.
Глицерин – трёхатомный спирт:
СН2ОН
СНОН
СН2ОН
Глицерин – бесцветная сиропообразная жидкость сладковатого вкуса, хорошо растворимая в воде, гигроскопичная. Глицерин получают расщеплением жиров.
Химические свойства.
1. Взаимодействие с щелочными металлами
СН2ОН CH2ONa
СНОН + 2Na → CHONa + H2
СН2ОН CH2OH
2. Взаимодействие с галогеноводородами
СН2ОН CH2Cl
СНОН +3HCl → CH Cl + 3H2O
СН2ОН CH2Cl
3. Реакция этерификации (нитрование-взаимодействие с азотной кислотой )
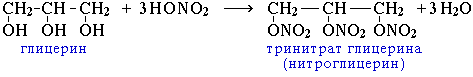
4. Качественная реакция на многоатомный спирт
СН2ОН CH2O
СНОН + Cu(OH)2 → CHO — Cu +H2O
СН2ОН CH2OH
Образуется синий раствор глицерата меди.
Применение глицерина – в медицине – для смягчения кожи и приготовлении мазей, в кожевенном производстве – для предохранения кож от высыхания, для получения пластмасс и взрывчатых веществ (нитроглицерин).
Билет 13.
1.
Скорость химических реакций. Зависимость скорости от природы, концентрации веществ, температуры, катализатора.
Одни химические реакции протекают мгновенно (реакции обмена, взрыв горючих газов), другие – медленно (ржавление железа).
Условия, влияющие на скорость химических реакций:
Природа реагирующих веществ.
Металлы с одним и тем же веществом – водой – реагируют с различными скоростями:
Na+H2O→ быстрая реакция; Mg+H2O→ медленная реакция.
Концентрация реагирующих веществ.
С увеличением концентрации скорость реакции увеличивается, так как число столкновений между молекулами возрастает. Например, горение в чистом кислороде протекает значительно интенсивнее, чем в воздухе, где концентрация кислорода почти в пять раз меньше.
3. Поверхность реагирующих веществ.
С измельчением вещества скорость реакции увеличивается.
