
- •Значение периодического закона
- •2. Горение
- •3. Разложение.
- •4. Изомеризация.
- •2. Циклоалканы, их общая формула, строение, свойства, нахождение в природе, практическое значение.
- •1. Реакции окисления.
- •2. Реакции присоединения.
- •3. Реакции полимеризации.
- •2. Реакции присоединения
- •3. Полимеризация
- •1. Реакции окисления
- •2. Реакции присоединения
- •3. Полимеризация
- •1. Окисление.
- •2. Реакции замещения.
- •3. Реакции присоединения
- •1. Все атомы, образующие молекулы органических веществ, связаны в определённой последовательности согласно их валентности.
- •2. Свойства веществ зависят не только от того, какие атомы и в каком количестве входят в состав молекулы, но и от порядка соединения атомов в молекуле (то есть от химического строения).
- •3. По свойствам данного вещества можно определить строение его молекулы, а по строению молекулы можно предвидеть свойства.
- •4. Атомы и группы атомов в молекулах веществ взаимно влияют друг на друга.
- •3. Изомерия положения функциональной группы.
- •4. Межклассовая изомерия.
- •2) По числу и составу исходных и образующихся веществ.
- •3) По тепловому эффекту.
- •4) По признаку обратимости.
- •4. Повышение температуры.
- •5. Катализаторы.
- •1. Соли, их состав и названия, взаимодействие с металлами, кислотами, щелочами, друг с другом с учетом особенностей реакций окисления-восстановления и ионного обмена.
- •1. Электрохимический ряд напряжений металлов. Вытеснение металлов из растворов солей другими металлами.
- •Свойства веществ в свете теории электролитической диссоциации. Ионные реакции.
- •2. Анилин взаимодействует с кислотами с образованием солей:
2. Циклоалканы, их общая формула, строение, свойства, нахождение в природе, практическое значение.
Циклоалканы – циклические углеводороды с простыми связями и общей формулой СnН2n. Циклоалканы входят в состав нефти.
Гомологический ряд циклоалканов:
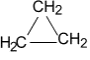



циклопропан циклобутан циклопентан циклогексан
Изомеры циклопентана С5Н10:
СН2-СН-СН3 СН – СН2-СН3
СН2-СН2 СН2-СН2
циклопентан 1-метилциклобутан 1-этилциклопропан
Химические свойства циклоалканов. Циклоалканы по свойствам сходны с алканами: малоактивны, горючи, атомы водорода в них могут замещаться галогенами.
1. Окисление. Циклоалканы горят, не обесцвечивают KMnO4
С4Н8 + 6О2→4СО2 + 4Н2О
2. Реакции замещения – галогенирование:

Практическое значение: циклоалканы входят в состав нефтепродуктов (топливо), используются как растворители органических веществ, из них получают ароматические углеводороды.
Билет 3.
1.
Виды химической связи: ионная, ковалентная (полярная, неполярная); простые и кратные связи в органических соединениях.
Химическая связь – электрические силы притяжения, которые удерживают частицы друг около друга. В образовании химической связи могут участвовать атомы, ионы или молекулы. Атомы химических элементов, имеющих незавершённый внешний уровень, неустойчивы и стремятся его завершить. В процессе химических реакций осуществляется завершение внешних уровней, что достигается либо отдачей электронов (у металлов), либо присоединением (у неметаллов), а также образованием общих электронных пар. Различают несколько типов химических связей:
1.Ковалентная связь осуществляется за счёт образования общих электронных пар, связывающих ядра атомов. Ковалентная связь образуется между атомами неметаллов.
Ковалентная неполярная связь образуется между атомами с одинаковой электроотрицательностью (в простых веществах – неметаллах):
Н◦ + ◦Н → Н◦◦Н (или Н—Н)
Общие электронные пары в равной степени принадлежат обоим атомам.
2.Ковалентная полярная связь образуется при взаимодействии атомов, электроотрицательности которых различаются незначительно.
![]()
Атом хлора имеет большую электроотрицательность, чем атом водорода, поэтому общая электронная пара смещена в его сторону. Соответственно возникнут заряды: на атоме хлора - отрицательный, на атоме водорода – положительный. Такая связь называется полярной. (Примеры: Н2О, H2S, CH3Cl)
3. Ионная связь. Ионы - это заряженные частицы, в которые превращаются атомы в результате отдачи или присоединения электронов.
Химическая связь между ионами, осуществляемая за счет электростатического притяжения, называется ионной связью. Ионная связь образуется при взаимодействии атомов, которые сильно различаются по электроотрицательности (связь между типичным металлом и типичным неметаллом).
![]()
Атом натрия полностью отдаёт один электрон, а атом хлора его принимает, образуются ионы, которые притягиваются друг к другу и образуют ионную кристаллическую решётку:

Ионная связь характерна для щелочей, солей, оксидов типичных металлов.
Простые и кратные связи
Если атомы связаны между собой одной общей электронной парой, то возникает одна ковалентная связь, которая называется простой, одинарной или σ-связью. Это основной вид связи, он существует во всех молекулах: Н-Н; Br-Br; CH3-CH3
σ-связи – это ковалентные связи, при образовании которых перекрывание электронных облаков осуществляется вдоль линии связи, соединяющей центры атомов.
Двойные и тройные связи имеют общее название: кратные связи.
π-Связи – это ковалентные связи, при образовании которых область перекрывания электронных облаков находится по обе стороны от линии, соединяющей центры атомов.
π-Связь образуется в тех случаях, когда между двумя атомами возникает две или три общие электронные пары.
Если связь между двумя атомами образована двумя общими электронными парами, то такая связь называется двойной связью. Любая двойная связь состоит из одной σ-связи и одной π-связи: СН2=СН2; О=О.
Если связь между двумя атомами образована тремя общими электронными парами, то такая связь называется тройной связью. Любая тройная связь состоит из одной σ-связи и двух
π-связей: СН≡СН; N≡N.


2.
Алкены ряда этена (этилена), их общая формула и химическое строение гомологов данного ряда. Этилен, его химические свойства (горение, реакции присоединения и полимеризации) и применение.
Алкены – нециклические углеводороды с одной двойной связью и общей формулой СnН2n
Двойная связь – сочетание прочной σ–связи и непрочной π –связи.
Гомологический ряд алкенов:
СН2=СН2 этен
СН2=СН-СН3 пропен
СН2=СН-СН2-СН3 бутен-1
СН2=СН-СН2-СН2-СН3 пентен-1
Изомерия алкенов:
а) Изомерия положения двойной связи
СН2=СН-СН2-СН3 бутен-1 СН3-СН=СН-СН3 бутен-2
б) Изомерия углеродного скелета
СН2=С -СН3 2-метилпропен-1
СН3
Химические свойства этилена. Для алкенов характерны реакции окисления, присоединения, полимеризации.
