
- •Значение периодического закона
- •2. Горение
- •3. Разложение.
- •4. Изомеризация.
- •2. Циклоалканы, их общая формула, строение, свойства, нахождение в природе, практическое значение.
- •1. Реакции окисления.
- •2. Реакции присоединения.
- •3. Реакции полимеризации.
- •2. Реакции присоединения
- •3. Полимеризация
- •1. Реакции окисления
- •2. Реакции присоединения
- •3. Полимеризация
- •1. Окисление.
- •2. Реакции замещения.
- •3. Реакции присоединения
- •1. Все атомы, образующие молекулы органических веществ, связаны в определённой последовательности согласно их валентности.
- •2. Свойства веществ зависят не только от того, какие атомы и в каком количестве входят в состав молекулы, но и от порядка соединения атомов в молекуле (то есть от химического строения).
- •3. По свойствам данного вещества можно определить строение его молекулы, а по строению молекулы можно предвидеть свойства.
- •4. Атомы и группы атомов в молекулах веществ взаимно влияют друг на друга.
- •3. Изомерия положения функциональной группы.
- •4. Межклассовая изомерия.
- •2) По числу и составу исходных и образующихся веществ.
- •3) По тепловому эффекту.
- •4) По признаку обратимости.
- •4. Повышение температуры.
- •5. Катализаторы.
- •1. Соли, их состав и названия, взаимодействие с металлами, кислотами, щелочами, друг с другом с учетом особенностей реакций окисления-восстановления и ионного обмена.
- •1. Электрохимический ряд напряжений металлов. Вытеснение металлов из растворов солей другими металлами.
- •Свойства веществ в свете теории электролитической диссоциации. Ионные реакции.
- •2. Анилин взаимодействует с кислотами с образованием солей:
3. Изомерия положения функциональной группы.
Молекулярной формуле C3H7OH в зависимости от положения гидроксильной группы в молекуле соответствуют два вещества:
CH3
– CH2
– CH2
– OH
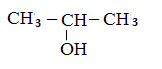
1-пропанол 2-пропанол
4. Межклассовая изомерия.
Алкены изомерны циклоалканам. Например, формуле С4Н8 соответствуют алкены и циклоалканы:
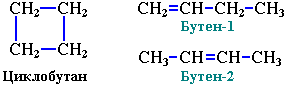
Алкины изомерны алкадиенам: СН≡С-СН2-СН3 бутин-1 (С4Н6)
СН2=СН-СН=СН2 бутадиен-1,3 (С4Н6)
Билет 9.
1.
Металлы, их положение в периодической системе химических элементов Д. И. Менделеева, строение их атомов, металлическая связь. Общие химические свойства металлов.
Металлы – элементы, имеющие мало валентных электронов (1, 2, 3) и отдающие их для завершения энергетического уровня. Металлы – восстановители, образуют положительно заряженные ионы.
Металлическая связь образуется во всех металлах. Это связь, которую осуществляют относительно свободные электроны с положительными ионами металлов в кристаллической решётке. Атомы металла легко отдают валентные электроны и превращаются в положительные ионы (катионы). Относительно свободные электроны перемещаются между положительными ионами металла и как бы цементируют их в кристаллической решётке.
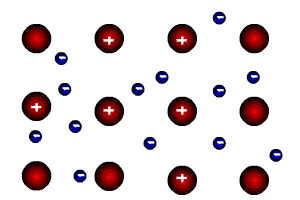
Металлическая связь обусловливает характерные физические свойства металлов: непрозрачность, высокую тепло- и электропроводность, ковкость, пластичность.
Химические свойства металлов.
Взаимодействие с неметаллами:
2Na+Cl2→2NaCl
2Mg+O2→2MgO
Взаимодействие с водой:
2Na+2H2O→2NaOH+H2
Mg+2H2O→Mg(OH)2+H2
С водой с образованием основания и водорода взаимодействуют только активные металлы (стоящие в ряду напряжений до алюминия).
Взаимодействие с кислотами:
2Na+H2SO4→2Na2SO4+H2
Mg+2HCl→MgCl2+H2
Водород из кислот вытесняют металлы, стоящие в ряду напряжений до водорода.
Взаимодействие с растворами солей
Zn+CuSO4 →Cu+ZnSO4
Fe+2AgNO3→2Ag+Fe(NO3)2
Более активный металл (стоящий в ряду напряжений левее) вытесняет менее активный металл из раствора его соли.
2.
Природный газ и его практическое использование.
Природный газ относится к полезным ископаемым. Часто является попутным газом при добыче нефти. Природный газ в земных недрах находится в газообразном состоянии — в виде отдельных скоплений (газовые залежи) или в виде газовой шапки нефтегазовых месторождений, либо в растворённом состоянии в нефти или воде.
Химический состав
Основную часть природного газа составляет метан (CH4) — до 98 %. В состав природного газа могут также входить более тяжёлые углеводороды — гомологи метана: этан (C2H6), пропан (C3H8), бутан (C4H10); чем выше молекулярная масса углеводорода, тем меньше его в природном газе.
Чистый природный газ не имеет цвета и запаха, ядовит. Чтобы можно было определить утечку по запаху, в газ добавляют небольшое количество веществ, имеющих сильный неприятный запах.
К природному газу относится и попутный нефтяной газ, который находится над нефтью и растворён в ней. Он отличается от природного газа меньшим содержанием метана и увеличением количества этана, пропана, бутана, пентана, гексана. Смесь пропана и бутана используют как топливо в быту. Смесь пентана и гексана – газовый бензин – добавляют к бензину для облегчения запуска двигателя.
Применение
Природный газ широко применяется как энергетически эффективное и дешёвое топливо в быту, как топливо для машин, котельных, ТЭЦ, заводах и др. При сгорании его образуется значительно меньшее количество вредных веществ по сравнению с другими видами топлива. Сейчас он используется в химической промышленности как исходное сырьё для получения различных органических веществ, например пластмасс.
Основные процессы переработки газа можно выразить уравнениями:
СН4→С (сажа)+Н2
2СН4→С2Н2 (ацетилен)+3Н2
С2Н6→С2Н4 (этилен)+Н2
2СН4+О2→2СО+4Н2→2СН3ОН (метанол)
синтез-газ
Билет 10.
1.
Неметаллы, их положение в периодической системе химических элементов Д. И. Менделеева, строение их атомов.
Неметаллы в периодической системе расположены в правой верхней части, справа от диагонали «бор – астат». Это элементы главных подгрупп III, IV, V, VI, VII и VIII групп. К неметаллам относятся: бор, углерод, кремний, азот, фосфор, мышьяк, кислород, сера, селен, теллур, водород, фтор, хлор, бром, йод, астат. К неметаллам также относятся благородные газы: гелий, неон, аргон, криптон, ксенон, радон.
На внешнем электронном слое у атомов неметаллов находится большое число электронов – от 4 до 8, поэтому для атомов неметаллов более характерной является способность присоединять электроны для завершения электронного слоя. В периодах неметаллические свойства увеличиваются слева направо, в группах – уменьшаются сверху вниз. Самый неметаллический элемент – фтор. Неметаллы – окислители. Благородные газы имеют завершённый электронный слой и соединений почти не имеют.
2.
Нефть и её практическое использование.
Физические свойства нефти
Нефть — жидкость от светло-коричневого (почти бесцветная) до тёмно-бурого (почти чёрного) цвета с характерным запахом. Она немного легче воды и практически в ней не растворяется, растворима в органических растворителях. Нефть – смесь различных углеводородов, у неё нет определённой температуры кипения. Нефть — легко воспламеняющаяся жидкость.
Химический состав нефти
Нефть представляет собой смесь около 1000 индивидуальных веществ, из которых большая часть — жидкие углеводороды (80—90 % по массе). В зависимости от месторождения нефть имеет различный состав.
В основном в нефти представлены алканы и циклоалканы, в меньшей степени — ароматические углеводороды.
Применение
Сырая нефть непосредственно почти не применяется. Для получения из неё технически ценных продуктов, главным образом моторных топлив, растворителей, сырья для химической промышленности, её подвергают переработке. Вначале из неё удаляют растворённые газообразные углеводороды. Затем нефть нагревают. Первыми переходят в парообразное состояние углеводороды с небольшим числом атомов углерода в молекуле, имеющие относительно низкую температуру кипения. С повышением температуры смеси перегоняются углеводороды с более высокой температурой кипения. Таким образом можно собрать отдельные смеси (фракции) нефти. Основные фракции нефти следующие:
1.Газолиновая фракция, собираемая от 40 до 200°С, содержит углеводороды от С5Н12 до С11Н24. При дальнейшей перегонке выделенной фракции получают: газолин (40-70°С), бензин (70-120°С) авиационный, автомобильный и т.д.
2.Лигроиновая фракция, собираемая от 150 до 250°С, содержит углеводороды от С8Н18 до С14Н30. Лигроин применяется как горючее для тракторов.
3.Керосиновая фракция, собираемая от 180 до 300°С, содержит углеводороды от С12Н26 до С18Н38. Керосин используется в качестве горючего для тракторов, реактивных самолётов и ракет.
4.Газойль – дизельное топливо (выше 275°С)
5.Остаток после перегонки нефти – мазут – содержит углеводороды С19Н40 – С53Н108. Мазут также разделяют на фракции: соляровые масла – дизельное топливо, смазочные масла, вазелин (основа для косметических средств и лекарств). Из некоторых сортов нефти получают парафин (для производства свечей, спичек). После отгонки остаётся гудрон, который применяют в дорожном строительстве.
Главный недостаток перегонки нефти – малый выход бензина (не более20%).
Крекинг нефтепродуктов.
Крекингом называется процесс расщепления углеводородов, содержащихся в нефти, в результате которого образуются углеводороды с меньшим числом атомов углерода в молекуле.
С помощью крекинга выход бензина из нефти можно значительно увеличить до 70%.
Процесс крекинга можно выразить уравнениями:
С16Н34 → С8Н18 + С8Н16
октан октен
С8Н18 → С4Н10 + С4Н8
бутан бутен
С4Н10 → С2Н6 + С2Н4
этан этен
Различают два основных вида крекинга: термический (протекающий при высокой температуре) и каталитический (протекающий при более низкой температуре в присутствии катализаторов).
Нефть занимает ведущее место в мировом топливно-энергетическом балансе: доля её в общем потреблении энергоресурсов составляет 48 %. В перспективе эта доля будет уменьшаться вследствие возрастания применения атомной и иных видов энергии, а также увеличения стоимости и уменьшения добычи.
Экология
В экологическом отношении природный газ является самым чистым видом минерального топлива. Однако сжигание человечеством огромного количества различных видов топлива, в том числе природного газа, за последние полвека привело к заметному увеличению содержания углекислого газа в атмосфере, который является, как и метан, парниковым газом. Большинство ученых именно это обстоятельство считают причиной наблюдающегося в настоящее время потепления климата.
Нефть, попадая в воду, образует на её поверхности тончайшие плёнки толщиной в микрон, которые не пропускают воздух. Это наносит водоёмам существенный урон: нарушается биологическое равновесие, страдают водные растения, животные, гибнут птиц
Билет 11.
1.
Классификация химических реакций в неорганической и органической химии.
Химические реакции можно классифицировать по следующим признакам:
По изменению степени окисления.
Процессы, в результате которых происходит изменение степени окисления, называют окислительно-восстановительными реакциями.
2Feо + Cl2о → 2Fe+3Cl3-1
