
- •Значение периодического закона
- •2. Горение
- •3. Разложение.
- •4. Изомеризация.
- •2. Циклоалканы, их общая формула, строение, свойства, нахождение в природе, практическое значение.
- •1. Реакции окисления.
- •2. Реакции присоединения.
- •3. Реакции полимеризации.
- •2. Реакции присоединения
- •3. Полимеризация
- •1. Реакции окисления
- •2. Реакции присоединения
- •3. Полимеризация
- •1. Окисление.
- •2. Реакции замещения.
- •3. Реакции присоединения
- •1. Все атомы, образующие молекулы органических веществ, связаны в определённой последовательности согласно их валентности.
- •2. Свойства веществ зависят не только от того, какие атомы и в каком количестве входят в состав молекулы, но и от порядка соединения атомов в молекуле (то есть от химического строения).
- •3. По свойствам данного вещества можно определить строение его молекулы, а по строению молекулы можно предвидеть свойства.
- •4. Атомы и группы атомов в молекулах веществ взаимно влияют друг на друга.
- •3. Изомерия положения функциональной группы.
- •4. Межклассовая изомерия.
- •2) По числу и составу исходных и образующихся веществ.
- •3) По тепловому эффекту.
- •4) По признаку обратимости.
- •4. Повышение температуры.
- •5. Катализаторы.
- •1. Соли, их состав и названия, взаимодействие с металлами, кислотами, щелочами, друг с другом с учетом особенностей реакций окисления-восстановления и ионного обмена.
- •1. Электрохимический ряд напряжений металлов. Вытеснение металлов из растворов солей другими металлами.
- •Свойства веществ в свете теории электролитической диссоциации. Ионные реакции.
- •2. Анилин взаимодействует с кислотами с образованием солей:
3. Полимеризация
3C2H2 → C6H6 (бензол)
Получение ацетилена
а)
Из метана: 2CH4
→ C2H2![]() + 3H2
+ 3H2
б) Из карбида кальция: CaC2 + 2HOH → C2H2 + Ca(OH)2
Применение ацетилена: сварка и резка металлов, получение уксусного альдегида, пластмасс, растворителей, лекарств, красителей и многих других веществ.
Билет 6:
1.
Высшие оксиды химических элементов третьего периода. Закономерности в изменении их свойств в связи с положением химических элементов в периодической системе.
группа |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
элемент |
Na |
Mg |
Al |
Si |
P |
S |
Cl |
Ar |
Валентность по кислороду |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
-
|
Высший оксид |
Na2O |
MgO |
Al2O3 |
SiO2 |
P2O5 |
SO3 |
Cl2O7 |
- |
Химический характер |
основный. |
основный. |
амфотер. |
кислот.
|
кислот.
|
кислот.
|
кислот.
|
-
|
Изменение свойств элементов и их соединений
|
Металличность элементов ослабляется, неметалличность усиливается
Основный характер оксидов и гидроксидов уменьшается, кислотный - усиливается |
|||||||
В периоде слева направо металлические свойства элементов ослабляются, неметаллические – усиливаются, высшая степень окисления увеличивается, следовательно, наблюдается изменение свойств высших оксидов элементов: от основных, через амфотерные к кислотным
2.
Арены (ароматические углеводороды), их общая формула. Бензол, его структурная формула, свойства, применение.
Арены или ароматические углеводороды – это соединения, молекулы которых содержат ароматическую связь – единую π-электронную систему из шести электронов. Ароматическая связь прочнее π –связи и менее прочная, чем σ–связь. Для бензола и его гомологов характерны реакции замещения, реакции присоединения идут с трудом.
Общая формула аренов СnН2n-6
Простейший представитель - бензол.
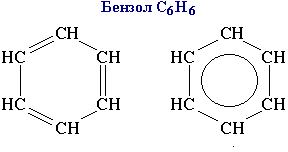 Бензол
– бесцветная, нерастворимая в воде
жидкость с приятным запахом. Легче воды.
Ядовит.
Бензол
– бесцветная, нерастворимая в воде
жидкость с приятным запахом. Легче воды.
Ядовит.
Гомологи бензола: метилбензол C6H5-CH3
этилбензол C6H5-C2H5
пропилбензол C6H5-C3H7
Химические свойства бензола.
1. Окисление.
Бензол горит, но не обесцвечивает KMnO4.
2. Реакции замещения.
а) Галогенирование: С6Н6+Cl2 → HCl+C6H5Cl (хлорбензол)
б) Нитрование: С6Н6+HONO2 → H2O + C6H5NO2 (нитробензол)
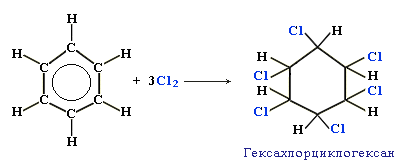
3. Реакции присоединения
а) Галогенирование: С6Н6+3Cl2 → C6H5Cl6 (гексахлорциклогексан)
б) Гидрирование: С6Н6+3Н2 → C6H12 (циклогексан)
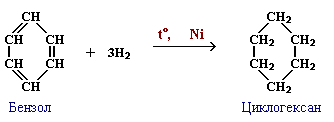
Получение бензола:
а) из ацетилена: 3 C2H2 → C6H6
б) из циклогексана: C6H12 → C6H6 + 3H2
Применение бензола:
Бензол С6Н6 используется как исходный продукт для получения различных ароматических соединений, применяемых в производстве лекарств, пластмасс, красителей, ядохимикатов и многих других органических веществ.
Билет 7.
1.
Высшие кислородсодержащие кислоты химических элементов третьего периода, их состав и сравнительная характеристика свойств.
Высшие кислородсодержащие кислоты образуют элементы-неметаллы в высшей положительной степени окисления.
группа |
4 |
5 |
6 |
7 |
элемент |
Si |
P |
S |
Cl |
Валентность по кислороду |
4 |
5 |
6 |
7 |
Высший оксид |
SiO2 |
P2O5 |
SO3 |
Cl2O7 |
Высший гидроксид (кислота) |
H2SiO3 |
H3PO4 |
H2SO4 |
HClO4 |
Изменение свойств элементов и их соединений
|
Усиление кислотных свойств
|
|||
H2SiO3 (кремниевая) - очень слабая кислота, практически нерастворима в воде.
H3PO4 (фосфорная) – кислота средней силы, хорошо растворима в воде.
H2SO4 (серная) – сильная кислота, хорошо растворима в воде.
HClO4 (хлорная) – самая сильная из кислот в этом ряду.
2.
Основные положения теории химического строения органических веществ
А.М. Бутлерова. Химическое строение как порядок соединения и взаимного влияния атомов в молекулах.
Основы теории химического строения сформулировал в 1861 г. профессор Казанского университета Александр Михайлович Бутлеров. А.М. Бутлеров ввёл понятие о химическом строении веществ. Химическое строение – это последовательность соединения атомов в молекуле, порядок их взаимосвязи и взаимного влияния друг на друга.
Сущность теории химического строения можно выразить в следующих положениях:
