
- •Значение периодического закона
- •2. Горение
- •3. Разложение.
- •4. Изомеризация.
- •2. Циклоалканы, их общая формула, строение, свойства, нахождение в природе, практическое значение.
- •1. Реакции окисления.
- •2. Реакции присоединения.
- •3. Реакции полимеризации.
- •2. Реакции присоединения
- •3. Полимеризация
- •1. Реакции окисления
- •2. Реакции присоединения
- •3. Полимеризация
- •1. Окисление.
- •2. Реакции замещения.
- •3. Реакции присоединения
- •1. Все атомы, образующие молекулы органических веществ, связаны в определённой последовательности согласно их валентности.
- •2. Свойства веществ зависят не только от того, какие атомы и в каком количестве входят в состав молекулы, но и от порядка соединения атомов в молекуле (то есть от химического строения).
- •3. По свойствам данного вещества можно определить строение его молекулы, а по строению молекулы можно предвидеть свойства.
- •4. Атомы и группы атомов в молекулах веществ взаимно влияют друг на друга.
- •3. Изомерия положения функциональной группы.
- •4. Межклассовая изомерия.
- •2) По числу и составу исходных и образующихся веществ.
- •3) По тепловому эффекту.
- •4) По признаку обратимости.
- •4. Повышение температуры.
- •5. Катализаторы.
- •1. Соли, их состав и названия, взаимодействие с металлами, кислотами, щелочами, друг с другом с учетом особенностей реакций окисления-восстановления и ионного обмена.
- •1. Электрохимический ряд напряжений металлов. Вытеснение металлов из растворов солей другими металлами.
- •Свойства веществ в свете теории электролитической диссоциации. Ионные реакции.
- •2. Анилин взаимодействует с кислотами с образованием солей:
1. Соли, их состав и названия, взаимодействие с металлами, кислотами, щелочами, друг с другом с учетом особенностей реакций окисления-восстановления и ионного обмена.
Соли – электролиты, при диссоциации которых образуются катионы металлов (или NH4+) и анионы кислотных остатков.
BaCl2→ Ba2+ + 2Cl- K2CO3 →2K+ + CO32-
Химические свойства солей:
1.Взаимодействие солей с металлами (более активный металл - стоящий в ряду напряжений металлов левее - вытесняет менее активный металл из раствора его соли):
Fe + CuSO4 FeSO4 + Cu Fe + Cu2+ +SO42- Fe2++SO42- + Cu Fe + Cu2+ Fe2++ Cu
2. Взаимодействие солей с щелочами (реакция возможна, если исходные вещества растворимы, а в результате выпадает осадок):
CuSO4+2NaOH → Cu(OH)2↓+ Na2SO4
Cu2++SO42- +2Na+ +2OH-→Cu(OH)2↓+2Na++ SO42-
Cu2+ +2OH- → Cu(OH)2↓
3.Взаимодействие солей с солями (реакция возможна, если исходные вещества растворимы, а в результате выпадает осадок):
NaCl +AgNO3 AgCl + NaNO3 Na+ + Cl- + Ag+ + NO3- AgCl + Na + +NO3- Ag+ + Cl- AgCl
4. Взаимодействие солей с кислотами (реакция возможна, если в результате реакции образуется осадок, газ, слабый электролит)
HCl +AgNO3 AgCl + HNO3 H+ + Cl- + Ag+ + NO3- AgCl + H+ +NO3- Ag+ + Cl- AgCl
CO2
Na2CO3+2HCl → 2 NaCl+H2CO3
H2O
2Na+ +CO32- +2H+ + 2Cl- → 2Na+ + 2Cl- + CO2↑+ H2O
CO32- +2H+→ CO2↑+H2O
2.
Глюкоза - представитель моносахаридов, строение, физические и химические свойства, применние.
Глюкоза С6Н12О6 – моносахарид, не гидролизующийся с образованием более простых углеводов.
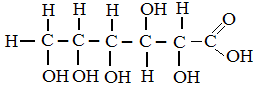
Как видно из структурной формулы, глюкоза является одновременно многоатомным спиртом и альдегидом, то есть альдегидоспиртом. В водных растворах глюкоза может принимать циклическую форму.
Физические свойства
Глюкоза – бесцветное кристаллическое вещество со сладким вкусом, хорошо растворимое в воде. По сравнению со свекловичным сахаром менее сладкая.
Химические свойства
Глюкоза обладает химическими свойствами, характерными для спиртов и альдегидов. Кроме того, она обладает и некоторыми специфическими свойствами.
1. Глюкоза – многоатомный спирт.
Глюкоза с Cu(OH)2 даёт раствор синего цвета (глюконат меди)
2. Глюкоза – альдегид.
а) Реагирует с аммиачным раствором оксидом серебра с образованием серебряного зеркала:
СН2ОН-(СНОН)4-СНО+Ag2O → СН2ОН-(СНОН)4-СОOH + 2Ag
глюконовая кислота
б) С гидроксидом меди даёт красный осадок Cu2O
СН2ОН-(СНОН)4-СНО + 2Cu(OH)2 → СН2ОН-(СНОН)4-СОOH + Cu2O↓ + 2H2O
глюконовая кислота
в) Восстанавливается водородом с образованием шестиатомного спирта (сорбита)
СН2ОН-(СНОН)4-СНО + H2 → СН2ОН-(СНОН)4-СH2OH
3. Брожение
а) Спиртовое брожение (для получения спиртных напитков)
С6H12O6 → 2СH3–CH2OH + 2CO2
этиловый спирт
б) Молочнокислое брожение (скисание молока, квашение овощей)
C6H12O6 →2CH3–CHOH–COOH
молочная кислота
Применение, значение
Глюкоза образуется в растениях в процессе фотосинтеза. Животные получают её с пищей. Глюкоза – главный источник энергии в живых организмах. Глюкоза является ценным питательным продуктом. Применяется в кондитерском деле, в медицине как укрепляющее средство, для получения спирта, витамина С и др.
Билет 19.
