
- •Оглавление
- •Лекция 1 экология как наука предмет и задачи экологии
- •Основные разделы экологии.
- •Концепция устойчивого развития общества.
- •Лекция 2 уровни организации жизни. Уровни организации жизни:
- •Фундаментальные свойства живых существ
- •Экологические сукцессии
- •Основные типы экосистем
- •1. Пустыня
- •2. Травянистые экосистемы.
- •3. Лесные экосистемы
- •Лекция 3 Биосфера. Основные составляющие биосферы.
- •3. Биосфера есть планетное явление космического характера.
- •1. Атмосфера
- •2. Гидросфера
- •3. Литосфера
- •Эволюция биосферы
- •Лекция 4 пищевые сети. Экологические пирамиды. Поток энергии в экосистеме. Правило 10%.
- •Поток энергии в экосистеме
- •Лекция 5 биохимические круговороты веществ в природе
- •Лекция 6 экологические факторы среды
- •Экологическое значение основных абиотических факторов
- •1. Эдафические факторы.
- •2. Климатические факторы
- •1. Ксерофиты (растения засушливых местообитаний с высокой выносливостью), распространены в пустынях, степях, жестколистных вечнозеленых лесах. По принципу адаптации подразделяются на:
- •2. Мезофиты (средней выносливостью – лиственные древесные породы, многие лесные и луговые травянистые растения).
- •3. Топографические факторы
- •Основные законы действия абиотических факторов на живые системы
- •Закон оптимума.
- •2. Закон минимума
- •3. Закон толерантности.
- •6. Закон относительной независимости адаптации – высокая адаптированность к одному из экофакторов не дает такой же степени приспособления к другим условиям среды.
- •7. Правило экологической индивидуальности видов – каждый вид специфичен по своим экологическим возможностям адаптации: двух идентичных видов не существует (л. Г. Раменский в 1924г. ).
- •Взаимодействие видов в экосистемах (биотические факторы)
- •Межвидовая конкуренция.
- •Лекция 7 Антропогенные экологические кризисы
- •Основы устойчивости экосистем и биосферы в целом. Нарушение человеком основных принципов устойчивости.
- •Лекция 9 природные ресурсы и рациональное природопользование.
- •1.1. Ресурсы, участвующие в постоянном обороте и потоке энергии:
- •Почвенные и водные ресурсы
- •Пищевые ресурсы.
- •Невозобновимые энергетические ресурсы.
- •40% Разведанных запасов находится в России, она же является крупнейшей страной в мире по добыче газа. Следом идут Иран (14%), сша (6%), Катар (4%).
- •Возобновимые и неисчерпаемые энергетические ресурсы.
- •Энергосбережение
- •Лекция 10 классификация видов загрязнения окружающей среды.
- •Размещение отходов добычи, переработки и использования природного сырья, а также продуктов промышленности и сельского хозяйства.
- •Нефтехимия, нефте- и газопереработка.
- •Крупные плотины и водохранилища.
- •Классификация видов загрязнения окружающей среды
- •Устойчивость, т.Е. Продолжительность существования в определенной среде.
- •3. Коэффициент выброса мк.
- •7. Другие специфичные особенности выбросов: влажность, давление, линейная скорость и т. Д.
- •Загрязнения гидросферы
- •Характеристика агрессивных псв
- •Лекция 11
- •Экологический анализ промышленного региона.
- •Источники загрязнения промышленного региона Лекция 12
- •Экологические аспекты проблемы народонаселения
- •2. Изменение климата
- •3. Разрушение озонового слоя
- •Виды использования хфу.
- •4. Кислотные осадки
- •1. Влияние на водные экосистемы.
- •2. Влияние на леса.
- •3.Снижение буферной емкости.
- •1.Устранение симптомов.
- •2. Сокращение выбросов кислотообразующих веществ.
- •2.1 Замена топлива.
- •2.2 Промывание угля.
- •2.3. Сжигание в псевдоожиженном слое.
- •2.4. Скрубберы.
- •2.6. Энергосбережение.
- •Лекция 13
- •2. Экологические требования к хозяйственной деятельности человека.
- •Законодательство российской федерации в области экологии Основы экоправа. Закон как источник экоправа
- •Принципы экологического права
- •Правовые основы информационного обеспечения природопользования и охраны окружающей среды
- •1. Понятие и роль экологически значимой информации
- •1. Источники нормативной экологически значимой информации
- •2. Государственный статистический учет и отчетность
- •4. Государственные кадастры природных ресурсов и объектов
- •5. Экологический паспорт предприятия.
- •6. Государственный доклад о состоянии окружающей природной среды в Российской Федерации
- •Регламентация воздействия на биосферу
- •Нормативы качества окружающей среды
- •Нормативы качества опс
- •Лекция 15 экологическая экспертиза и контроль
- •Лекция 16
- •Лекция 17 международное сотрудничество в области охраны окружающей среды
- •Неправительственные международные организации:
- •Особоохраняемые природные территории
- •5) Природные парки
- •6) Дендрологические парки и ботанические сады
- •Ответственность за экологические правонарушения
- •Затратно-прибыльный механизм при проведении мероприятий по защите окружающей среды
- •Влияние временнного фактора на затратно-прибыльный механизм
- •Литература
4. Кислотные осадки
Кислотными называют любые осадки (дожди, туманы, снег, сухие частицы), кислотность которых выше нормальной. Кислота - это любое химическое вещество, высвобождающее при растворении в воде ионы водорода.
Количественной характеристикой кислотности осадков является водородный показатель - величина рН, характеризующая активность или концентрацию ионов водорода в растворах.
Растворение в воде кислоты ведет к возрастанию концентрации ионов Н+ и уменьшению концентрации ионов ОН-. Таким образом, рН = 7 – нейтральная среда, рН< 7 - кислая и рН >7 - щелочная. Например, рН лимона 2,3; молока 6,5; аммиака 11,8.
Чистая дождевая вода имеет рН = 5,6. У кислотных осадков рН ниже этого показателя. Максимальная зарегистрированная в Западной Европе кислотность осадков - рН = 2,3, в основном же они имеют значение рН = 4,5-5,5.
Кислотные осадки на 2/3 обусловлены выбросами диоксида серы (SO2) и на 1/3 выбросами оксидов азота (NOx).
В результате деятельности человека соединения серы попадают главным образом в виде ее двуокиси. Среди источников этих соединений на первом месте стоит уголь, сжигаемый в зданиях и на электростанциях, который дает 70 % антропогенных выбросов.
Содержание серы (несколько %) в угле достаточно велико (особенно в буром угле). В процессе горения сера превращается в сернистый газ, а часть серы остается в золе в твердом состоянии. Ниже приведено содержание серы %, сгорающей в разных видах топлива:
лигнит......……………..1,1-1,6 бурый уголь……….............1,2-3,2
каменный уголь.............1,4 нефтепродукты................ 0,5-3,7
Наиболее важные соединения азота, находящиеся в атмосфере, представлены в таблице 7.
Таблица 7
Соединения азота и их концентрации вблизи поверхности Земли
Соединение |
Химическая формула |
Концентрация, мкг/м3 загрязненный отдаленные океан район районы |
||
Окись азота |
NO |
5-50 |
0,05-0,5 |
0,05 |
Двуокись азота |
NO2 |
5-50 |
0,2-2,0 |
0,2
|
Азотная кислота |
HNO3 |
2 |
0,2-2,0 |
0,2 |
Аммиак |
NH3 |
- |
0,1-10,0 |
0,3 |
Среди антропогенных источников образования оксидов азота на первом месте стоит горение ископаемого топлива (уголь, нефть, газ и т.д.). Во время горения в результате возникновения высокой температуры находящиеся в воздухе азот и кислород соединяются. Количество образовавшегося оксида азота NOх пропорционально температуре горения. Кроме того, оксиды азота образуются в результате горения имеющихся в топливе азотосодержащих веществ. Сжигая топливо, человек ежегодно выбрасывает в воздух 12 млн т оксидов азота. Немного меньше оксидов азота (8 млн. т. в год) поступает от двигателей внутреннего сгорания. Значительным источником оксидов азота является транспорт.
Промышленность, выбрасывающая в воздух ежегодно 1 млн. т. оксидов азота не представляет собой серьезного источника загрязнения по сравнению с отоплением и транспортом.
Таким образом, по крайней мере 37% из почти 56 млн. т. ежегодных выбросов оксидов азота образуются из антропогенных источников.
Попадая в атмосферу, кислые газы взаимодействуют с влагой и трансформируются в кислоты. Особую опасность представляют выбросы диоксида серы. Диоксид серы растворяется в каплях атмосферной влаги, образуя раствор серной кислоты. Агрессивность таких осадков резко возрастает. Серную кислоту обнаруживают в осадках, за 1000-1500 км от источников выброса SO2.
Влияние кислых осадков на окружающею среду и на человека .
Уже более ста лет кислотные осадки признаются серьезной проблемой в индустриальных и прилегающих к ним районах, но их влияние на экосистемы было отмечено только около 35 лет назад, когда рыбаки заметили резкое сокращение популяции рыбы во многих озерах Шведции, провинции Онтарио (Канада) и гор Адирондак (штат Нью-Йорк). В поисках причины этого были предложены разнообразные гипотезы. Шведские ученые первыми определили, что все дело в повышенной кислотности воды, и связали ее с ненормально низкими значениями рН осадков. С тех пор по мере распространения экологического ущерба выяснились различные пути разрушительного влияния осадков на экосистемы (рис.30).
окисление
 SO2
Н2SO4
SO2
Н2SO4
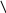 окисление
окисление

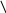
 NOх
HNO3
памятники старины
NOх
HNO3
памятники старины

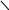
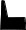








 твердые и жидкие осадки культурное
наследие
твердые и жидкие осадки культурное
наследие


 пища
пища
п ромышленный
ромышленный
район лес сельскохозяйственные земли






 озерные
и водные грунтовые воды
озерные
и водные грунтовые воды
 организмы
человек
организмы
человек







пища и питьевая вода
Рис. 30. Влияние кислотных осадков на окружающую среду и на человека
Влияние кислотных осадков на ОС проявляется в следующем:
