
- •7.0917.06 “Технологія зберігання, консервування і переробки плодів та овочів”
- •7.0917.07 “Технологія зберігання, консервування та переробки м’яса”
- •7.0917.11 “Технологія харчування”
- •Програма курсу вступ
- •Теоретичні уявлення в органічній хімії
- •Вуглеводні алкани
- •Алкадієни
- •Циклоалкани і циклоалкени
- •Галогенпохідні вуглеводнів
- •Похідні вуглеводнів, що містять гідроксил
- •Карбонільні сполуки (оксосполуки) альдегіди і кетони
- •Карбонові кислоти
- •Окси- і оксокислоти
- •Вуглеводи
- •Органічні сполуки, що містять азот
- •Амінокислоти
- •Гетероциклічні сполуки
- •Пестициди
- •Методичні рекомендації
- •Класифікація органічних сполук
- •Правила техніки безпеки у лабораторії органічної хімії та надання першої допомоги ( загальні правила )
- •Перша допомога при опіках та отруєннях
- •Гасіння місцевої пожежі та одягу що горить
- •Лабораторна робота №1 виділення та очищення органічних сполук, визначення фізичних констант, якісний аналіз
- •1. Перекристалізація
- •Перекристалізація з води
- •2. Сублімація (возгонка)
- •3. Екстракція (витяг)
- •4. Фракційна (дробна) перегонка
- •5. Визначення температури плавлення
- •6. Відкриття вуглецю і водню в органічній речовині
- •Лабораторна робота № 2 насичені та ненасичені вуглеводні
- •1. Одержання метану і дослідження його властивостей.
- •2. Одержання етилену і вивчення його властивостей
- •3. Одержання та властивості ацетилену
- •Завдання для самостійної роботи
- •Лабораторна робота №3 ароматичні вуглеводні
- •1. Одержання бензолу з бензойнокислого натрію
- •2. Відношення бензолу до брому
- •3. Взаємодія бензолу з водним розчином марганцевокислого калію
- •4. Властивості гомологів бензолу.
- •Завдання для самостійної роботи
- •Лабораторна робота № 4 галогенпохідні вуглеводнів
- •1. Одержання хлористого етилу
- •2. Утворення йодоформу з етилового спирту
- •3. Взаємодія хлороформу і чотирихлористого карбону з лугом Реактиви: хлороформ, чотирихлористий карбон, 10% розчин NaOh, нітратна кислота, AgNo3, kMnO4, аміак.
- •Завдання для самостійної роботи
- •Лабораторна робота №5 одно- й багатоатомні спирти. Феноли. Етери
- •1. Виявлення води у спирті
- •2. Розчинність спиртів у воді
- •3. Утворення алкоголяту і його гідроліз
- •4. Окиснення спиртів
- •5. Виявлення домішки метилового спирту в етиловому спирті
- •6. Відкриття сивушної олії
- •7. Якісна реакція на багатоатомні спирти
- •8. Розчинність, кислотний характер фенолів і нафтолів
- •9. Бромування фенолів
- •10. Кольорові реакції фенолів
- •Завдання для самостійної роботи
- •Лабораторна робота № 6 альдегіди і кетони
- •1.Одержання оцтового альдегіду при окисленні етилового спирту
- •2.Одержання ацетону з ацетату кальцію
- •Лабораторна робота №7 карбонові кислоти
- •1. Визначення реакції середовища деяких кислот
- •2. Доведення кислотних властивостей карбонових кислот
- •3. Дослідження окиснюваності деяких органічних кислот
- •4.Розклад мурашиної кислоти
- •5. Розклад щавлевої кислоти
- •6. Проба на ненасиченість олеїнової кислоти
- •7. Ізомеризація олеїнової кислоти в елаїдинову
- •8. Дія хлориду заліза (ііі) на оцтову кислоту (якісна реакція)
- •Завдання для самостійної роботи
- •Лабораторна робота №8 гідроксикислоти. Альдегідокислоти. Кетокислоти
- •1. Якісна реакція на a- оксикислоти з FeCl3
- •2.Розкладання молочної кислоти
- •3. Окислення молочної кислоти у піровиноградну
- •4. Утворення кислої і середньої солі винної кислоти
- •5. Доведення наявності оксигруп у винній кислоті
- •6. Розкладання лимонної кислоти
- •7. Взаємодія галової кислоти і таніну з FeCl3
- •Завдання для самостійної роботи
- •Лабораторна робота №9 естери. Жири та масла. Мила
- •1. Розчинність жирів у різноманітних розчинниках
- •2. Емульгування жирів
- •3. Одержання складних естерів
- •4. Акролеїнова проба на жири
- •5. Омилення жиру
- •6. Дослідження властивостей мила
- •В). Виділення вільних жирних кислот з мила.
- •7. Визначення йодного числа
- •Завдання для самостійної роботи
- •Лабораторна робота № 10 вуглеводи (моносахариди,дисахариди, полісахариди)
- •1. Загальна реакція на вуглеводи з - нафтолом
- •(Реакція Моліша)
- •2.Осмолення моносахаридів
- •3. Окислення моносахаридів реактивом Фелінга
- •4. Окислення моносахаридів аміачним розчином оксиду срібла (реакція срібного дзеркала)
- •9.Виявлення лактози у молоці
- •10. Кольорові реакції на сахарозу.
- •11.Карамелізація сахарози
- •12. Реакція крохмалю з йодом
- •13. Кислотний гідроліз крохмалю
- •14. Одержання рослинного пергаменту
- •15. Розчинення целюлози у мідно-аміачному розчині (реактиві Швейцера)
- •Завдання для самостійної роботи
- •Лабораторна робота №11 тема: аміни . Амінокислоти. Білки
- •1. Одержання аміну і дослідження деяких його властивостей
- •2.Реакції - амінокислот
- •3. Буферні властивості розчину білка
- •4. Осадження білків солями важких металів
- •5. Осадження білків мінеральними кислотами
- •6. Висолювання білків з розчинів
- •7. Осадження білків при нагріванні
- •8. Кольорові реакції білка.
- •Б) Ксантопротеінова реакція на білки й ароматичні амінокислоти
- •9. Відкриття аміногруп і сірки у білках
- •Завдання для самостійної роботи
- •Список рекомендованої літератури Основна
- •Додаткова
Методичні рекомендації
Тема: Вступ. Теорія хімічної будови О.М. Бутлерова
Програма по розділу «Вступ» охоплює матеріал для починаючого вивчати органічну хімію.
В цьому розділі розглядаються важливі положення теорії хімічної будови О.М. Бутлерова. Теорія хімічної будови органічних сполук пояснює суть ізомерії, дає можливість передбачити синтез нових речовин та інше. Сучасні уявлення про будову органічних сполук пояснюють природу простого, подвійного та потрійного зв’язку між атомами вуглецю, типи та механізм органічних реакцій.
Основні типи органічних реакцій:
Реакція заміщення:
СН4 + Сl2 ® CH3Cl + HCl
хлорметан
Реакція приєднання і полімеризації:
CH2=CH2 + Cl2 ® CH2Cl-CH2Cl
1,2 - дихлоретан
nCH2=CH2 ® [-CH2-CH2-]n
поліетилен
Реакція окислення:
CH4 + 2O2 ® CO2 + 2H2O
CH2=CH2
![]() CH2-CH2
CH2-CH2
ï ï
OH OH
4. Реакція відщеплення.
CH2-CH2 + Zn ® ZnBr2 + CH2=CH2
ï ï етилен
Br Br
Розрізняють два способи розпаду ковалентних зв’язків - гомолітичний і гетеролітичний.
Гомолітичний (радикальний) розпад зв’язку:
Н3С ÷ Н ® •СН3 + Н•
Гетеролітичний - розпад зв’язку:
H H
H : C[ : Br ® H : C+ + Br-
H H
Утворені радикали і іони - активні частинки і швидко взаємодіють з різними органічними сполуками. По радикальному і іонному механізму протікають реакції заміщення, приєднання, відщеплення.
Класифікація органічних сполук
Самостійно вивчаючи курс органічної хімії, необхідно звернути увагу на класифікацію органічних сполук. Органічну хімію можна вважати як хімію вуглеводнів та їх похідних.
Замінюючи атоми водню у вуглеводнях на різні атоми та групи атомів (-Cl, -Br, -J, -OH, -NO2, -NH2, -SO3H, -C=O та інш.),
 H
H
можна вивести різні похідні вуглеводнів.
Наприклад, від метану і етану можна вивести такі ряди похідних:
вуглеводні галогенопохідні спирти альдегіди
CH4 CH3Cl CH3OH H-C=O
H
C2H6 C2H5Cl C2H5OH CH3-C =O
H
кислоти нітросполуки аміносполуки сульфосполуки
H -C=O CH3-NO2
CH3-NH2
CH3-SO3H
-C=O CH3-NO2
CH3-NH2
CH3-SO3H
OH
CH3-C=O C2H5-NO2 C2H5-NH2 C2H5-SO3Н
OH
Кожний ряд похідних вміщує характерну групу (-С=O, >C=O, -ОН та інші), яка називається функціональною групою. Всі органічні сполуки, які містять однакову функціональну групу, об’єднуються в класи (спирти, альдегіди, кислоти та інші).
Сполуки одного класу схожі за хімічною будовою, схожі за хімічними властивостями. Тому при вивченні того чи іншого класу сполук достатньо ознайомитись з властивостями всього декількох представників.
Тема: Вуглеводні
А. В молекулах насичених вуглеводнів атоми вуглецю зв’язані між собою простим зв’язком (s- зв’язок), утворюючи прямий або розгалуджений ланцюг.
Всі одиниці валентності атома вуглецю, не використані на зв’язок між вуглецевими атомами, насичені атомами водню.
Всі атоми зв’язані між собою тільки s-/сігма/ зв’язком - ковалентним зв’язком. Необхідно запам’ятати назву і формули перших десяти представників гомологічного ряду насичених вуглеводнів /алканів/, засвоїти принцип побудови гомологічного ряду. Цей принцип буде повторюватись при побудові всіх гомологічних рядів.
Найважливішою номенклатурою є міжнародна (систематична, ІЮПАК).
Використовується також тривіальна (випадкова) назва органічних сполук. Так, перші чотири члени гомологічного ряду алканів мають тривіальні назви:
CH4 - метан; C2H6 - етан; C3H8 - пропан; C4H10 - бутан.
Насичені вуглеводні за нормальних умов малоактивні сполуки. Пояснюється це тим, що всі атоми в молекулах зв’язані між собою s-зв’язками, які є міцними.
При підвищеній температурі, опромінюванні, дії активних реагентів вони вступають в реакції.
Так, при взаємодії хлору з метаном при опромінюванні світлом проходить реакція заміщення атомів водню на хлор.
H3C-H + Cl2 ® H3C-Cl + HCl
хлорметан
Ця реакція йде по ланцюговому радикальному механізму заміщення.
Cl
: Cl
![]() 2Сl·
2Сl·
CH3 : H + Cl· ® CH3· + HCl
CH3· + Cl : Cl ® CH3-Cl + Cl· і тощо…
При високих температурах проходять реакції розщеплення вуглецевого ланцюга молекул алканів (крекінг). Наприклад:
CH3-CH2-CH2-CH2-CH2-CH2-CH2-CH2-CH2-CH3
![]()
декан
® CH3-CH2· + ·CH2-CH2-CH2-CH2-CH2-CH2-CH2-CH3 ®
етил (радикал) октил (радикал)
® CH2=CH2 + CH3-(CH2)6-CH3
етен октан
Б. Ненасичені вуглеводні (етиленові, дієнові, ацетиленові) мають в молекулах подвійні і потрійні зв’язки між атомами вуглецю (CH2=CH2; CH2=CH-CH=CH2; CHºCH). В зв’язку з цим треба звернути увагу на природу подвійного і потрійного зв’язків. Вуглеводні з такими типами зв’язків мають здатність легко вступати в різні реакції.
Реакції приєднання і полімеризації:
CH2=CH2 + Br2 ® CH2-CH2
ï ï 1, 2- диброметан
Br Br
nCH2=CH2 ® [-CH2-CH2-]n поліетилен
Реакції окислення:
CH2=CH2
+ [O] + H-OH
![]() CH2-CH2
CH2-CH2
ï ï етандіол
OH OH
В. Ароматичні вуглеводні мають велике значення при одержанні фарбників, полімерів, фармацевтичних препаратів тощо.
Типовим представником ароматичних вуглеводнів є бензол. В молекулі бензолу немає звичайних простих і подвійних зв’язків
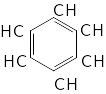
Всі зв’язки С-С рівноцінні по довжині і по енергії утворення. Електронна густина в молекулі бензолу розподіляється рівномірно:
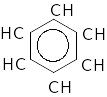
Внутрішнє коло відображає замкнутий цикл з шести рухомих r-електронів.
Найбільш типовими реакціями бензолу і його гомологів є реакція електрофільного заміщення атомів водню на галоген, нітрогрупу (-NO2), сульфогрупу (-SO3H). У зв’язку з тим, що зв’язки в -CH- бензолу рівноцінні, то реакція заміщення водню може бути у кожного з атомів вуглецю.
При умові введення другого замісника в бензольне кільце, він буде направлятись першим замісником у зазначене положення. З метою вивчення цього питання необхідно знати правило заміщення в бензольному кільці.
Г. Аліциклічні вуглеводні. Вивчаючи аліциклічні вуглеводні (циклоалкани), необхідно звернути увагу на міцність циклів, які складаються з різної кількості атомів вуглецю (теорія напруги) та залежність властивостей циклоалканів від розміру циклу. До аліциклічних сполук відносять терпени. Це особлива група ненасичених вуглеводнів складу C10H16. Вони входять до складу ефірних олій, скипидару¼ Вивчаючи терпени, слід звернути увагу на класифікацію. Для кожної з груп терпенів треба знати один-два представника: ациклічні терпени (мірцен, гераніол), моноциклічні (лімонен, ментол), біциклічні (пінен, камфора). У молекулах терпенів одна, дві або три подвійних зв’язка, різні функціональні групи. Терпени входять до складу ефірних олій, кропу, сельдирею, цитрусових, петрушки та ін.
Каротиноїди - природні пігменти (фарбники), які містяться в моркві, шипшині, помідорах і ще в багатьох рослинах. Молекули каротиноїдів вміщують спряжені подвійні зв’язки, що обумовлюють червоне або жовте забарвлення.
Найважливішим представником каротиноїдів є каротин. Каротин -C40H56- це три ізомери: a-каротин, b-каротин, g-каротин. b-каротину в цій суміші 85%.
СН3 СН3 СН3 СН3
 |
|
|
|
![]() С
С
С
С
![]() Н2С
С(-СН=СН-С=СН-)2-СН=СН-(-СН=С-СН=СН-)2-С
СН2
Н2С
С(-СН=СН-С=СН-)2-СН=СН-(-СН=С-СН=СН-)2-С
СН2
| |
Н2С С-СН3 СН3 СН3 Н3С-С СН2
СН2 b- каротин СН2
У чистому вигляді b- каротин являє собою жовті кристали нерозчинні у воді, а розчинні в жирах. В тваринних організмах під дією ферменту каротинази з однієї молекули b- каротину утворюється 2 молекули вітаміну А.
СН3 СН3
 |
|
-(-СН=СН-С=СН-)2-СН2ОН
|
-СН3 СН3 Вітамін А
Вітамін А в рослинних організмах не синтезується. Він міститься в молоці, яєчному жовтку, риб’ячому жирі, в печінці тварин.
Вітамін А - кристалічна речовина розчинна в жирах. Недостатня кількість вітаміну А в їжі приводить до порушення обмінних процесів, затримання росту, виснаження нервової системи, ороговіння шкіри.
b- каротин і вітамін А, накопичені в організмі, можуть зберігатися більше року, тому дуже корисно в літньо-осінній період вживати більше їжі, яка містить цей вітамін (морква, помідори, щавель, кропива, салат, зелена цибуля, абрикоси, персики, шипшина та ін.). Теплова кулінарна обробка мало впливає на зниження А-вітамінної активності.
Тема: Галогенопохідні
Для багатьох галагенопохідних насичених вуглеводнів важливою особливістю є легкість заміщення атому галогену на інші атоми або групи атомів. Ця особливість галагенопохідних використовується для одержання інших класів сполук (спиртів, альдегідів, кислот, ефірів¼).
Атом галогену при подвійному зв’язку (CH2=CH - хлорвініл)
ï
Cl
і
в ароматичному ядрі (такого напрямку
будови
![]() хлорбензол)
хлорбензол)
утримується міцно. Заміщення галогену йде дуже повільно.
Тема: Спирти та феноли
Спирти - це похідні вуглеводнів, в молекулах яких один або декілька атомів водню заміщується на гідроксогрупу -OH. Група -OH є функціональною групою спиртів. По кількості гідроксильних груп спирти розподіляють на одноатомні і багатоатомні. Одноатомні спирти мають загальну формулу R-OH, де R - вуглеводневий радикал. Розрізняють первинні, вторинні і третинні спирти. Наприклад:
CH3-CH2-OH - первинний спирт CH3
етанол-1 ï
CH3-CH-CH3 – вторинний спирт CH3-C-CH3 – третинний спирт
ï ï
OH пропанол-2 OH 2-метил-пропанол-2
Багатоатомні спирти. Найважливішими представниками багатоатомних спиртів є етиленгліколь і гліцерин
CH2-OH CH2-OH
ï ï
CH2-OH CH-OH
етиленгліколь ï
CH2-OH гліцерин
Хімічні властивості спиртів обумовлені функціональною групою -OH. Спирти з лужними металами утворюють алкоголяти, з кислотами - складні ефіри, окиснюються, протікають реакції міжмолекулярної і внутрішньомолекулярної дегідратації.
Якісною реакцією на багатоатомні спирти є реакція з Cu(OH)2
CH2-OH CH2-O
ï ï ñCu
CH-OH
+ Cu(OH)2¯
![]() CH-O
CH-O
ï ï
CH2-OH CH2-OH розчин гліцерату міді
Гідроксильна група може входити в склад сполук інших класів, проявляючи властивості притаманні цій функціональній групі.
Феноли.
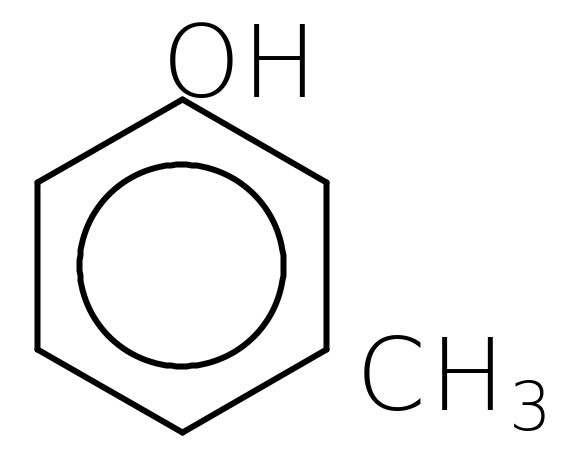
Похідні ароматичних вуглеводнів, де у ароматичних ядрах замість атомів водню є група -ОН.
![]()

![]()
фенол о-крезол м-крезол п-крезол
Одноатомні феноли (ізомери по положенню групи -ОН у толуолі)
Багатоатомні феноли:
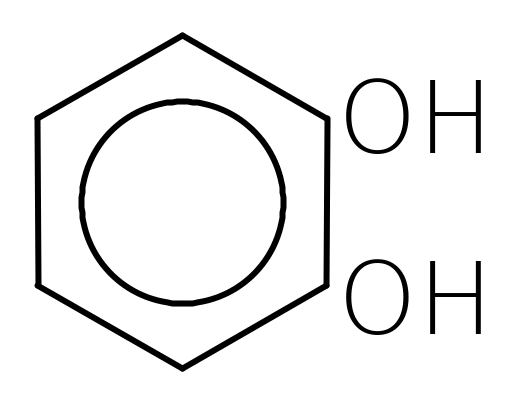

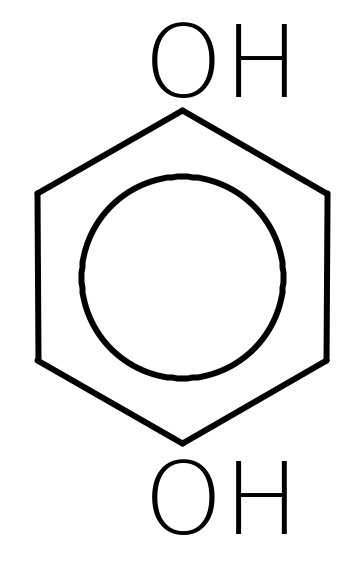
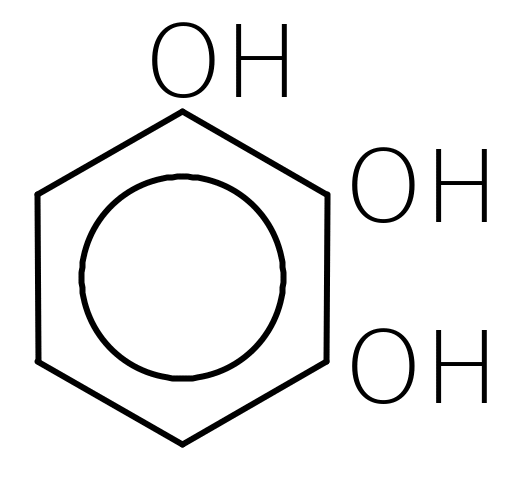
пірокатехін резорцин гідрохінон пірогалол
Феноли проявляють слабкі кислотні властивості, в розчинах дисоціюють: C6H5-O-H « C6H5O- + H+
Як кислоти феноли реагують з лугами:
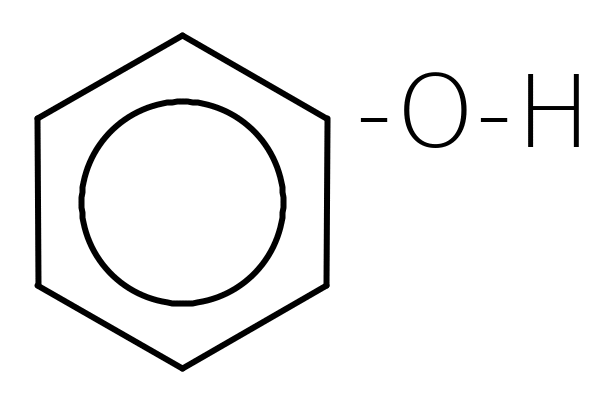 -Н
-Н![]() 2О
2О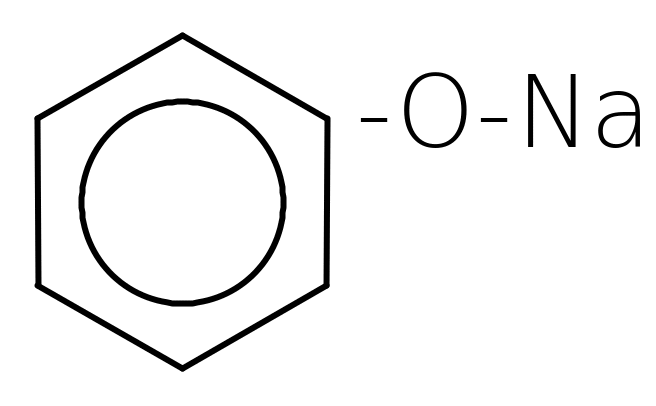 фенолят натрію
фенолят натрію
Феноли, як і спирти, за рахунок функціональної групи -ОН утворюють прості і складні ефіри, окиснюються.
Якісною реакцією на феноли є реакція з FeCl3. Різні феноли з цим реагентом дають різне забарвлення. За ароматичним ядром феноли вступають у реакцію заміщення водню на галоген, сульфогрупу, нітрогрупу.
Тема: Альдегіди і кетони
Альдегіди і кетони мають функціональну групу – С– карбонільну групу. ||
О
В альдегідах карбонільна група зв’язана з вуглеводневим радикалом і воднем: R – C – H
||
O
У кетонів карбонільна група зв’язана з двома вуглеводневими радикалами R– C– R
||
O
Альдегіди і кетони схожі у властивостях, так як мають однакову функціональну групу. Альдегіди називають по кількості атомів вуглецю з закінченням -аль. Часто альдегіди називають по кислотам, в які вони окиснюються.
H - C = O CH3 - C = O CH3 - CH2 - CH2 - C = O
Н Н Н
метаналь етаналь бутаналь
мурашиний альдегід оцтовий альдегід масляний альдегід
Кетони називають по кількості атомів вуглецю з закінченням -ОН. Прості кетони називають, перелічуючи радикали:
1 2 3
СН3 - C - СН3
||
O пропанон, диметилкетон
Альдегіди і кетони сполуки дуже активні. Основним типом хімічної реакції для альдегідів і кетонів є реакція приєднання водню і сполук, які мають легко рухомий водень (H2, H - CN, NaHSO3). Слід звернути увагу на те, що альдегіди легко окиснюються в кетони на відміну від кетонів, які окиснюються важко.
Якісними реакціями окиснення на альдегіди є реагенти: Cu(OH)2, Ag2O, реактив Фелінгу.
Ag2O
CH3
- C = O
![]() CH3
- C = O
CH3
- C = O
H OH
оцтова кислота
Крім цього, для альдегідів і кетонів характерна реакція заміщення кисню, реакції в радикалі. Карбонільна група -С- входить до складу сполук інших класів. ||
О
Тема: Карбонові кислоти
А. Карбоновими кислотами називають органічні сполуки, які мають в молекулах карбоксильну функціональну групу -С=О, зв’язану з вуглеводневим радикалом R - С = О О-Н
О-Н
По кількості карбоксильних груп карбонові кислоти розподіляють на одноосновні і багатоосновні.
Гомологічний ряд одноосновних карбонових кислот:
H - С = О - мурашина кислота,
О-Н
CH3 - С = О - оцтова кислота,
О-Н
CH3 - CH2 - С = О - пропіонова кислота,
О-Н
 CH3
- CH2
- CH2
- С = О - масляна
кислота,
CH3
- CH2
- CH2
- С = О - масляна
кислота,
О-Н
CH3 - CH2 - CH2 - CH2 - С = О - валеріанова кислота,
О-Н
CH3 - CH2 - CH2 - CH2 - CH2 - С = О - капронова кислота,
О-Н
C15H31-СОOH - пальмітинова, C17H35С=ОО-Н-стеаринова кислоти.
Гомологічний ряд двохосновних карбонових кислот:
HOOC-СOOH - щавлева, HOOC-CH2-СОOH – малонова,
HOOC-CH2-CH2-СОOH - янтарна кислоти. Коли в радикалі є p- зв’язки, то такі кислоти відносять до ненасичених карбонових кислот:
CH2 = CH - С = О - акрилова кислота,
ОН
CH2 = C - С = О - метакрилова кислота,
| ОН
CH3
CH3-CH=CH-COOH - кротонова кислота, C17Н33-COOH - олеїнова кислота, C17H31-СОOH - лінолева кислота, C17H29-СОOH - ліноленова кислота. Карбонові кислоти частіше називають за тривіальною номенклатурою. Для всіх кислот характерні реакції з участю карбоксильної групи: -С=О
 О-Н
О-Н
З міщення
електронної густини в карбоксилі: R -
Cd+
= Оd-
міщення
електронної густини в карбоксилі: R -
Cd+
= Оd-
 О
¬
Н
О
¬
Н
Таке зміщення електронної густини приводить до дисоціації кислот
 R
R
 -Cd+
= Оd-
R-C=О-
+
Н+
-Cd+
= Оd-
R-C=О-
+
Н+
 О¬Н
О –
О¬Н
О –
Всі карбонові кислоти мають кислотні властивості: змінюють забарвлення індикаторів, утворюють солі. Карбонові кислоти можуть давати похідні, коли -ОН в карбоксилі заміщується на іншу групу атомів. Похідні карбонових кислот активні сполуки і їх застосовують в органічному синтезі. R - С = О - галогенпохідні,
Cl
R - C - O - С - R - ангідриди,
|| ||
O О
R - C - O - R - складні ефіри,
||
O
R - С = О – аміди.
NH2
В хімічних реакціях беруть участь і вуглеводневі радикали кислот. Радикали насичених і ненасичених кислот по різному реагують з одним і тим же реагентом.
Реакція заміщення водню:
+Cl2
CH3
- CH2
- С = О
![]() CH3
- CH - СОOH
CH3
- CH - СОOH
ОН |
пропіонова кислота Cl 2-хлорпропіонова кислота
Реакція приєднання:
+Cl2
CH2=CH
- СООН
![]() CH2
- CH - СООН
CH2
- CH - СООН
| |
пропенова кислота Cl Cl 2, 3 - дихлорпропанова кислота
Зверніть увагу на здатність ненасичених кислот приєднувати водень:
CH3-(CH2)7-CH=CH-(СH2)7-COO![]() CH3-(CH2)8-CH2-(СH2)7-COOH
CH3-(CH2)8-CH2-(СH2)7-COOH
олеїнова кислота (рідина) стеаринова кислота (тверда)
Така реакція лежить в основі перетворення рідких олій в тверді жири.
Карбоксильна група входить до складу сполук інших класів.
Б.
Ароматичними кислотами
називають похідні ароматичних вуглеводнів,
де карбоксильна група знаходиться біля
ароматичного кільця:
![]() бензойна
кислота. Ароматичні
кислоти проявляють типові властивості
по карбоксильній групі. У ароматичному
ядрі ідуть реакції заміщення на галоген,
сульфогрупу (-SO3H...).
бензойна
кислота. Ароматичні
кислоти проявляють типові властивості
по карбоксильній групі. У ароматичному
ядрі ідуть реакції заміщення на галоген,
сульфогрупу (-SO3H...).
Двохосновні ароматичні кислоти:

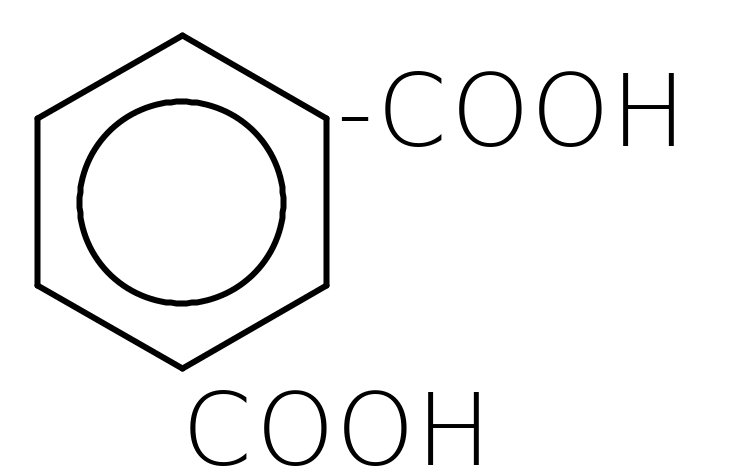

фталева ізофталева терефталева
Деякі з них широко застосовуються в органічному синтезі.
Тема: Естери. Жири
Складні ефіри є похідними кислот, спиртів і мають загальну формулу:
R-C-O-R R - C - кислотний радикал - O - R - залишок спирту
|| ||
O O
Назву складних ефірів складають з назви кислоти і спирту.
CH3-C=О
+ HO-CH3
![]() CH3-C-O-CH3
CH3-C-O-CH3
ОН ||
оцтова метиловий О
кислота спирт оцтовометиловий складний ефір
Складні ефіри розповсюджені в природі. Аромат квітів, плодів, ягід залежить в значній мірі від наявності в них складних ефірів.
Жири - складні ефіри, утворені гліцерином і жирними кислотами. Такі ефіри називають гліцеридами.
O
||
CH2-OH CH2-O-C-C17H35
O
ï ï ||
CH-OH
+ 3C17H35-С=О
![]() CH-O-C-C17H35
CH-O-C-C17H35
ОН O
ï ï ||
CH2-OH CH2-O-C-C17H35
В утворенні жирів беруть участь близько 50 різних кислот. Частіше всього зустрічаються кислоти: стеаринова, пальмітинова, олеїнова, лінолева... (див. тему «Кислоти»). Жири, молекули яких утворені більшою кількістю насичених кислот - тверді, а коли утворені більшою кількістю ненасичених кислот - рідкі. Міру ненасиченості жиру визначають йодним числом. Жири як складні ефіри вступають в реакцію гідролізу: O
||
CH2-O-C-C17H35
O CH2-OH
ï || ï
CH-O-C-C17H35
+3H-OH![]() CH-OН
+ 3C17H35COOH
CH-OН
+ 3C17H35COOH
O ï
ï || CH2-OH
CH2-O-C-C17H35 гліцерин стеаринова кислота
Гідроліз жиру в присутності лугу - лужний гідроліз. Цим методом одержують мило:
O
||
CH2-O-C-C17H35
O CH2-OH
ï || ï
CH-O-C-C17H35
+ 3NaOH
![]() CH-OH + 3C17H35COONa
CH-OH + 3C17H35COONa
O ï
ï || CH2-OH мило
CH2-O-C-C17H35
Рідкі жири реагують з воднем. Таким чином одержують тверді жири з рідких. Жири - одна з головних складових частин їжі людини. При зберіганні жири псуються. Визначають стадії псування жирів: прокисання, прогіркання, осалювання.
Тема: Оксикислоти (спиртокислоти)
А. Оксикислоти відносять до сполук з двома функціональними групами: -ОН та - СООН.
a
CH2-COOH CH3-CH-COOH
ï ï
OH OH
оксиоцтова кислота a-оксипропіонова кислота
В цій темі вивчається Оксикислоти, в основному, проявляють властивості як спиртів, так і кислот. Важливо вміти пристосувати до нової теми раніше вивчений матеріал.
оптична активність сполук, оптична ізомерія. Оптична активність притаманна багатьом представникам органічних сполук. В рекомендованій літературі оптична активність викладена добре.
Б. Фенолокислоти - оксипохідні (фенолопохідні) ароматичних кислот. Найважливішими представниками є:
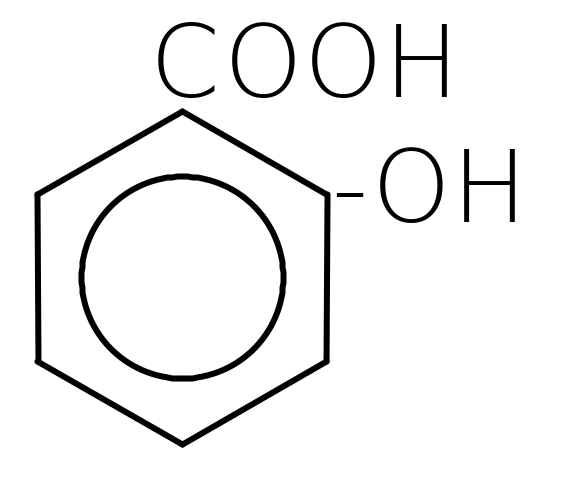
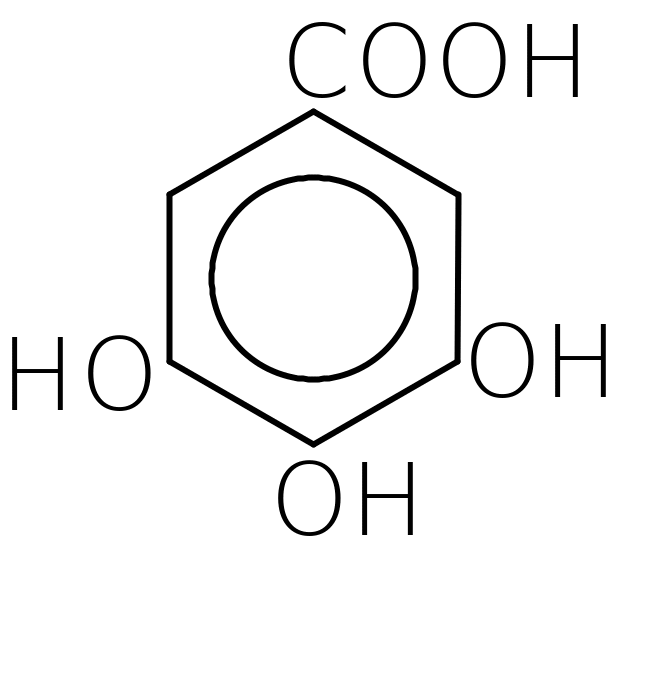
о-оксибензойна кислота триоксибензойна кислота
(саліцилова) (галова)
Фенолокислоти проявляють властивості фенолів і карбонових кислот (див. теми: Феноли. Карбонові кислоти). Крім цього, проходять типові реакції заміщення водню в ароматичному ядрі. (див. тему: Ароматичні вуглеводні).
Фенолокислоти широко розповсюджені в природі. В рослинах вони беруть участь в утворенні складних ефірів. Галова кислота входить до чаю, дубильних речовин.
Дубильні речовини входять до складу чаю, хмелю, яблук, ягід... Вони утворюють гіркуватий, терпкий присмак, запобігають псуванню, так як мають антисептичні властивості. До дубильних речовин відносять таніни і катехіни. Перші - гідролізуються, другі - ні. Таніни - складні ефіри, катехіни - конденсовані фенольні ядра.
Тема: Вуглеводи
Для засвоєння матеріалу цієї теми треба насамперед засвоїти класифікацію вуглеводів. Слід звернути увагу на прості вуглеводи та складні. Вивчаючи прості вуглеводи, слід звернути увагу на їх будову, на присутність раніше вивчених функціональних груп: -ОН, -С-, -С=О.
ïê \
О Н
Вуглеводи повинні мати властивості спиртів, альдегідів, кетонів. Прості вуглеводи (моноцукри) вивчають на прикладах глюкози, фруктози. На цих представниках слід розібратися в явищі таутомерії як одного з видів ізомерії. На прикладах ізомерах - таутомерах засвоїти властивості циклічних структур простих вуглеводів.
Складні вуглеводи поділяються на найбільш поширені - дисахариди і несахароподібні вищі полісахариди. Звернути увагу на будову і властивості мальтози, лактози, сахарози.
Вивчити будову і властивості найбільш типових представників полісахаридів: крохмалю, клітковини. При вивченні вуглеводів повинна сформуватись система знань: розчиняються вуглеводи у воді чи ні; які вуглеводи гідролізуються та які сполуки при цьому одержують; які вуглеводи окиснюються і відносяться до редукуючих вуглеводів і які не окиснюються і відносяться до нередукуючих вуглеводів. У групі вищих полісахаридів слід звернути увагу на пектинові сполуки, які застосовуються в харчовій промисловості.
Тема: Аміни
Аміни можна уявити як похідні аміаку, в молекулі якого атоми водню заміщуються на вуглеводневі радикали. Розрізняють аміни: первинні, вторинні, третинні. Назви амінів складаються за тими радикалами, які входять до молекул, з додатком слова - амін.
NH3; а) СН3-NН2 б) CН3 в) СН3
 аміак
первинний
NH N– СН3
аміак
первинний
NH N– СН3
метиламін СН3 CH3
вториннний амін третинний амін
диметиламін триметиламін
Подібно до аміаку, аміни виявляють основні властивості. Аміни - органічні основи. Вони можуть реагувати з кислотами, а низькомолекулярні аміни реагують з водою. Основні властивості амінів забезпечуються власною електронною парою атома азоту, до якої притягуються протони водню:
СН3 - NH2 + H+Cl- ® [CH3-NH3]+Cl-
сіль
хлорид метиламонію
СН3 - NH2 + H+OH- ® [CH3 - NH3]+OH-
гидроксид метиламонію
Деякі аміни можуть вміщати в молекулі декілька аміногруп. Тоді назва такої сполуки складається за принципами міжнародної номенклатури: 1 2 3 4 5
CH2 - CH2 - CH - СH2 - CH3
ï ï
NH2 NH2 1,3 - диамінопентан
Відомі
ароматичні аміни. Це похідні ароматичних
вуглеводнів, де біля ароматичного кільця
знаходяться аміногрупи (одна або
декілька):
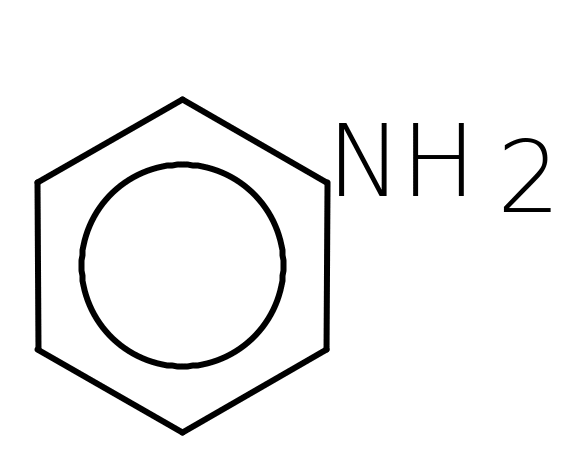 амінобензол (анілін). Ароматичні аміни
також розглядають як первинні, вторинні,
третинні. Властивості аналізуються за
аміногрупою і за ароматичним циклом.
Ароматичні аміни - слабкі основи.
Послаблення основних властивостей
викликає наявність ароматичного ядра.
Треба звернути увагу на особливості
властивостей первинних ароматичних
амінів. За аміногрупою (-NH2) вони
дають солі при взаємодії з кислотами.
Вони здатні реагувати з азотистою
кислотою з утворенням солей діазонію.
Солі діазонію використовуються для
одержання різних класів сполук і в тому
числі азофарбників. Можна виділити такі
стадії одержання азофарбника:
амінобензол (анілін). Ароматичні аміни
також розглядають як первинні, вторинні,
третинні. Властивості аналізуються за
аміногрупою і за ароматичним циклом.
Ароматичні аміни - слабкі основи.
Послаблення основних властивостей
викликає наявність ароматичного ядра.
Треба звернути увагу на особливості
властивостей первинних ароматичних
амінів. За аміногрупою (-NH2) вони
дають солі при взаємодії з кислотами.
Вони здатні реагувати з азотистою
кислотою з утворенням солей діазонію.
Солі діазонію використовуються для
одержання різних класів сполук і в тому
числі азофарбників. Можна виділити такі
стадії одержання азофарбника:
а) одержання солі:
 -NH2
+ Н+С1-
®
[
-NH3]+С1
-NH2
+ Н+С1-
®
[
-NH3]+С1
анілін хлорид феніламонію (сіль)
б) реакція діазотування (взаємодія солі з азотистою кислотою). Одержання солі діазонію:
[
-NH3]+С1-
![]() [
-NºN]С1-
[
-NºN]С1-
сіль діазонію
в) реакція азосполучення - це взаємодія солей діазонію з окси- або амінопохідними ароматичних сполук. Сіль діазонію називають діазоскладаючою, а окси- або амінопохідні називають азоскладаючою. Сполучення діазоскладаючої з азоскладаючою проходить за рахунок відщеплення водню в пара- або орто-положенні азоскладаючої:
[
-NºN]С1-
+Н
-ОН
![]() -N=N-
-OH
-N=N-
-OH
оксіазосполука -N=N- - азогрупа.
Тема: Амінокислоти
Амінокислотами називають похідні органічних кислот, де в радикалі може бути одна або декілька аміногруп. По положенню аміногрупи амінокислоти розподіляють на a, b, g...Амінокислоти називають, беручи за основу назву кислоти з додатком -аміно. Багато амінокислот називають за тривіальною номенклатурою.
CH2 - CООH;
ï
NH2 амінооцтова кислота, гліцин
a b
CH3 - CH - CООH; СH2 - CH2 - CООH;
ï ï
NH2 NH2
a-амінопропіонова кислота, аланін b-амінопропіонова кислота
Амінокислоти містять дві функціональні групи за протилежними властивостями (кислотні і основні). Тому вони проявляють амфотерні властивості, реагуючи з кислотами і основами, утворюючи солі:
-H2O![]() CH2 -
C = О
CH2 -
C = О
ï ОН ï O-Na
NH2 NH2
H+
Cl-
CH2 - C = О ¾¾® [ CH2 - C = О ] +Cl-
ï О-Н ï OH
:NH2 NH3 сіль
Амінокислоти проявляють типові властивості по карбоксильній групі (-C = О ) та по аміногрупі (-NH2; -NH-; -N-).
ОН
Велике значення a-амінокислот, так як з них збудовані молекули білків.
Прикладами a- амінокислот є:
CH2 - CООH; CH3 - CH - CООH; CH2 - CH - CООH;
ï![]() ï
ï
ï
ï
ï
ï
NH2 NH2 NH2
гліцин аланін фенілаланін
CООH; CООH;
ï ï
NH2-C-H NH2-C-H
ï ï
(CH2)3 CH2
ï ï
CH2 CH2
ï ï
NH2 S
ï
лізин CH3 метіонін
a-амінокислоти при певних умовах можуть реагувати між собою, утворюючи сполуки з пептидними зв’язками:
CH2-C=О
+ CH3-CН-С=О
+ CH2-C=О
...
![]()
ï О-Н ï OH ï OH
NH2 NH2 NH2
О О
úç úç
®CH2-C-NH-CH-C-NH-CH2-C=О -C-NH- пептидний зв’язок.
ï ï OH úç
NH2 NH2 О
Тема: Білки
Природні високомолекулярні сполуки синтезовані з a-амінокислот. Білки виконують різні функції. Це ферменти, гормони, антибіотики. Вони входять до складу тваринних і рослинних організмів. Білкові речовини - найважливіша складова частина їжі людини і тварини. Білки містять вуглець, водень, кисень, сірку, фосфор і азот. По кількості визначеного азоту можна зробити висновок про кількість білку у цьому зразку.
Численні досліди встановили, що в молекулах білків залишки амінокислот зв’язані пептидними зв’язками -С - NH -.
úç
О
У будові молекул білків виділяють чотири структури. Деякі білки характеризуються трьома структурами. Первинна структура - певний порядок сполучення залишків a -амінокислот. Основний міжатомний тип зв’язку - пептидний. Вторинна структура - розміщення поліпептидного ланцюга в просторі у вигляді спіралі. Міжатомний тип зв’язку - водневий.
-C-NH-
úç
 O
O
-NH-C-
úç
O
Третинна структура - утворення певної форми білкової молекули за рахунок взаємодії певних функціональних груп амінокислот між собою. Можна умовно виділити глобулярну і фібрилярну форму білкової молекули. Четвертинна структура - об’єднання кількох структур, які мають первинну, вторинну і третинну будову в більш складні молекули.
Білки мають специфічні фізичні і хімічні властивості. Слід звернути увагу на відношення білків до розчинників, на зворотне і незворотне осадження, на денатурацію білків, гідроліз, кольорові реакції, амфотерний характер, ізоелектричний стан, ізоелектричну точку, методи розділу суміші білків і їх очищення.
Для формування системи знань слід звернути увагу на класифікацію білків, на групи білків-протеїнів і протеїдів.
