
- •Лекция 1
- •1.1. Органические топлива
- •1.1.1. Классификация углеводородных горючих
- •1.1.2. Состав топлив
- •1.1.3. Характеристики топлив
- •1.1.4. Разновидности горения
- •1.1.5. Основные стадии гетерогенного горения
- •1.1.6. Фазы горения
- •Лекция 2
- •1.1.7. Скорость горения
- •1.2. Расчет процессов горения
- •2. Определение количества и состава продуктов сгорания.
- •1.2.1. Определение потребного количества окислителя для полного сжигания 1кг горючего
- •1.2.2. Определение массы воздуха для сжигания 1кг топлива
- •1.2.3. Коэффициент избытка воздуха
- •1.2.4. Определение количества и состава продуктов сгорания
- •1.2.5. Определение состава продуктов сгорания
- •1.2.6. Определение температуры конца сгорания
- •1.2.7. Упрощенная форма уравнения теплового баланса
- •Лекция 3
- •2.1. Основные понятия и определения термодинамики
- •2.2. Параметры состояния системы
- •2.3. Первый закон термодинамики. Работа и теплота.
- •2.4. Свойства рv – и Тs – диаграмм
- •Лекция 4
- •2.5. Термодинамические процессы идеальных газов
- •2.5.1. Политропный процесс
- •Вывод уравнения политропного процесса
- •Соотношения между параметрами состояния в политропном процессе
- •Определение изменения внутренней энергии
- •Определение изменения энтальпии
- •Определение изменения энтропии
- •Определение теплоты, подводимой (отводимой) в ходе политропного процесса
- •Определение работы расширения в ходе политропного процесса
- •2.5.2. Частные случаи политропного процесса
- •2.5.3. Изохорный процесс
- •2.5.4. Изобарный процесс
- •2.5.5. Изотермический процесс
- •2.5.6. Адиабатный процесс
- •2.5.7. Графическое изображение процессов
- •Лекция 5 сжатие газов в компрессорах
- •Работа компрессора.
- •Действительная индикаторная диаграмма компрессора.
- •Объемный кпд компрессора.
- •Гидравлические потери в распределительных органах компрессора.
- •Многоступенчатые компрессоры.
- •Лекция 6 истечение газов и паров Первый закон термодинамики для потока газа.
- •Адиабатное течение идеального газа по горизонтальному каналу без совершения технической работы.
- •Закон геометрического обращения воздействия
- •Определение скорости потока на выходе из канала
- •Массовый секундный расход газа
- •Анализ соплового течения газа через суживающееся сопло
- •Сопло Лаваля
- •Лекция 7 реальные газы
- •Устройство pv – диаграммы реального газа
- •Области pv- диаграммы
- •Уравнение состояния реального газа
- •Определение параметров влажного насыщенного пара
- •Диаграммы водяного пара
- •Лекция 8
- •Оновной закон теплопроводности. Гипотеза фурье.
- •В практике теплотехнических расчетов широко пользуются понятием теплового потока:
- •Конвекция
- •Процесс теплообмена между поверхностью твердого тела и жидкостью, омывающей поверхность, называется теплоотдачей.
- •Основной закон теплоотдачи. Уравнение ньютона – рихмана.
- •Теплопередача
- •Теплообмен излучением
- •Лекция 9 дифференциальное уравнение теплопроводности
- •Частные случаи дифференциального уравнения теплопроводности.
- •Для неподвижной среды (для твердого тела).
- •Дифференциальное уравнение теплопроводности для твердого тела в цилиндрической системе координат.
- •Простейший случай дифференциального уравнения теплопроводности для одномерного стационарного поля.
- •Краевые условия (условия однозначности).
- •Граничные условия.
- •Рассмотрим пример.
Лекция 4
2.5. Термодинамические процессы идеальных газов
Ранее было введено понятие термодинамического процесса, без которого невозможно вести речь о работе, теплоте, теплоемкости, первом законе термодинамике и т.д. Протекание термодинамических процессов обеспечивает функционирование тепловых двигателей, компрессоров, различных пневматических приспособлений и т.п.
В ходе термодинамического процесса осуществляется в общем случае энергетическое взаимодействие термодинамической системы с окружающей средой, сопровождающееся изменением параметров состояния системы. Классический аппарат технической термодинамики позволяет проводить анализ обратимых процессов. Поэтому последующее изложение будет относиться к указанным процессам. Анализ термодинамических процессов существенно упрощается, если принять, что при их протекании теплоемкость тела, образующего систему, величина постоянная.
Рассмотрение термодинамических процессов начнем с политропного процесса, которым, в частности, широко пользуются для аппроксимации реальных процессов.
2.5.1. Политропный процесс
Политропным называется процесс, в ходе которого неизменной остается только теплоемкость, все остальные параметры изменяются.
![]() ,
,
где
![]() -
теплоемкость политропного процесса.
-
теплоемкость политропного процесса.
Вывод уравнения политропного процесса
Запишем первый закон термодинамики в дифференциальной форме
![]() ,
(2.13)
,
(2.13)
где
![]() – количество подводимой теплоты;
– количество подводимой теплоты;
![]() – изменение
внутренней энергии;
– изменение
внутренней энергии;
![]() – работа
расширения газа.
– работа
расширения газа.
Изменение энтальпии в элементарном процессе
![]() .
(2.14)
.
(2.14)
![]() – выражение
энтальпии через теплоемкость.
– выражение
энтальпии через теплоемкость.
Решим (2.14) относительно du
![]() (2.15)
(2.15)
Подставляя (2.15) в (2.13), получим
![]() (2.16)
(2.16)
Соотношение (2.16) является математическим выражением первого закона термодинамики через энтальпию.
Запишем первый закон термодинамики в двух формах
![]() (2.17)
(2.17)
Заменим dq, dh и du через теплоемкости
![]() .
.
Разделим одно уравнение на другое:
![]() .
(2.18)
.
(2.18)
Обозначим
![]() .
(2.19)
.
(2.19)
Величина n носит название показателя политропы.
Подставляя (2.19) в (2.18) и разделяя переменные, получаем дифференциальное уравнение политропного процесса
![]() .
(2.20)
.
(2.20)
Проинтегрируем (2.20)
![]() .
(2.21)
.
(2.21)
Потеинцируя (2.21) получаем уравнение политропного процесса
![]() .
(2.22)
.
(2.22)
Кривая, описываемая этим уравнением, называется политропой идеального газа.
Соотношения между параметрами состояния в политропном процессе
Найдем соотношения между параметрами состояния в политропном процессе.
Установим вначале взаимосвязь между давлением и объемом. Используя уравнение (2.22), получим
![]()
или
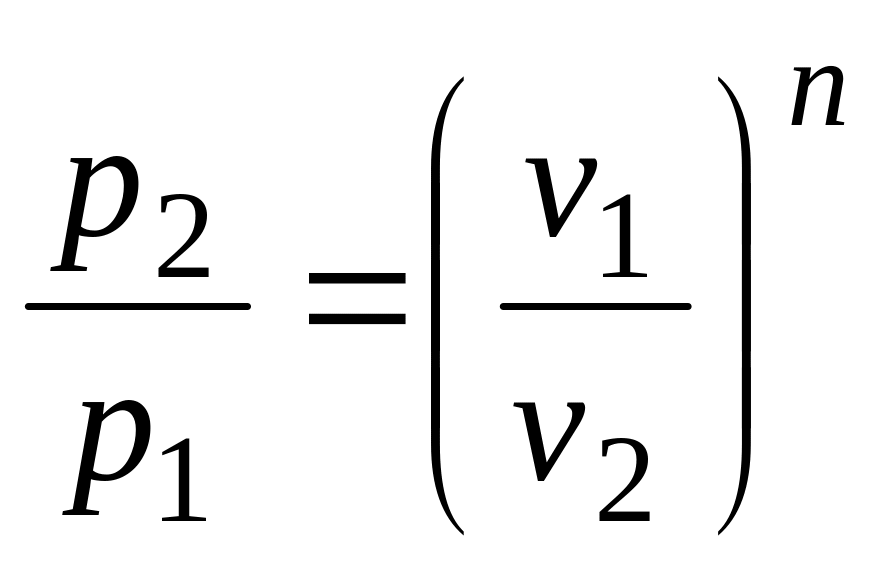 .
(2.23)
.
(2.23)
Из уравнения (2.23) следует, что при n > 0 изменение давления в политропном процессе обратно пропорционально изменению объема. При n < 0 – прямо пропорционально.
Для установления взаимосвязи между P и Т, V и Т знаменатель уравнения состояния для любых двух точек процесса:
![]() и
и
![]() .
.
После деления второго на первое получим:
![]() .
(2.24)
.
(2.24)
Подставляя это соотношение в (2.23) получим соотношение между Т и v
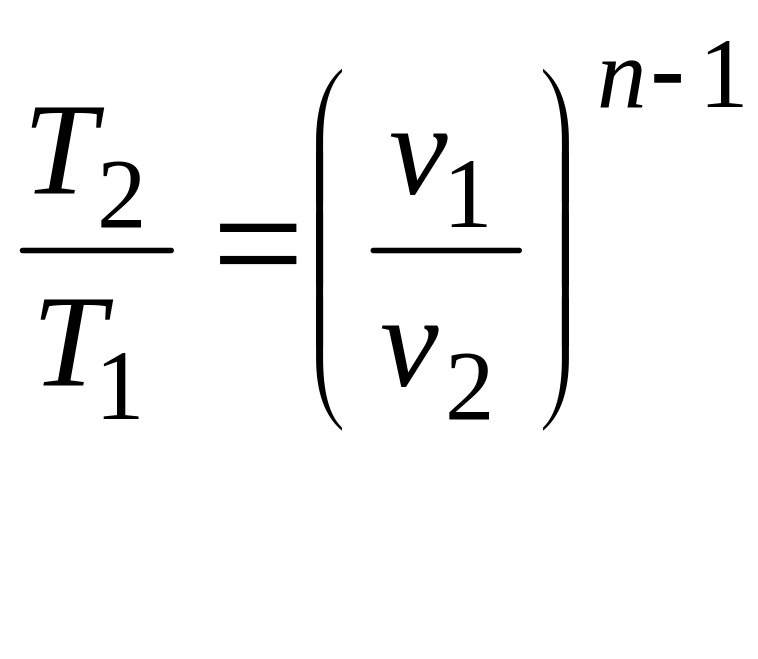 .
(2.25)
.
(2.25)
Таким образом, в политропных процессах при n > 1 изменение объема обратно пропорционально изменению абсолютной температуры. При n < 1 – прямо пропорционально.
Если с помощью (2.23) исключить из (2.24) объем, то получим соотношение между Т и p
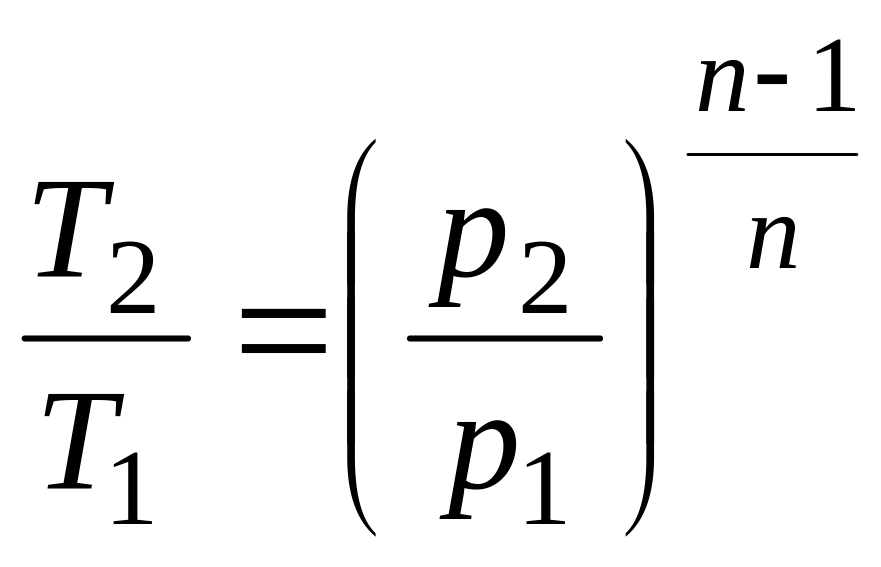 .
(2.26)
.
(2.26)
Как видно из (2.26), при n > 1 и n < 0 изменение давления прямо пропорционально изменению температуры. При 1 > n > 0 – обратно пропорционально.
