
- •Лекция 1
- •1.1. Органические топлива
- •1.1.1. Классификация углеводородных горючих
- •1.1.2. Состав топлив
- •1.1.3. Характеристики топлив
- •1.1.4. Разновидности горения
- •1.1.5. Основные стадии гетерогенного горения
- •1.1.6. Фазы горения
- •Лекция 2
- •1.1.7. Скорость горения
- •1.2. Расчет процессов горения
- •2. Определение количества и состава продуктов сгорания.
- •1.2.1. Определение потребного количества окислителя для полного сжигания 1кг горючего
- •1.2.2. Определение массы воздуха для сжигания 1кг топлива
- •1.2.3. Коэффициент избытка воздуха
- •1.2.4. Определение количества и состава продуктов сгорания
- •1.2.5. Определение состава продуктов сгорания
- •1.2.6. Определение температуры конца сгорания
- •1.2.7. Упрощенная форма уравнения теплового баланса
- •Лекция 3
- •2.1. Основные понятия и определения термодинамики
- •2.2. Параметры состояния системы
- •2.3. Первый закон термодинамики. Работа и теплота.
- •2.4. Свойства рv – и Тs – диаграмм
- •Лекция 4
- •2.5. Термодинамические процессы идеальных газов
- •2.5.1. Политропный процесс
- •Вывод уравнения политропного процесса
- •Соотношения между параметрами состояния в политропном процессе
- •Определение изменения внутренней энергии
- •Определение изменения энтальпии
- •Определение изменения энтропии
- •Определение теплоты, подводимой (отводимой) в ходе политропного процесса
- •Определение работы расширения в ходе политропного процесса
- •2.5.2. Частные случаи политропного процесса
- •2.5.3. Изохорный процесс
- •2.5.4. Изобарный процесс
- •2.5.5. Изотермический процесс
- •2.5.6. Адиабатный процесс
- •2.5.7. Графическое изображение процессов
- •Лекция 5 сжатие газов в компрессорах
- •Работа компрессора.
- •Действительная индикаторная диаграмма компрессора.
- •Объемный кпд компрессора.
- •Гидравлические потери в распределительных органах компрессора.
- •Многоступенчатые компрессоры.
- •Лекция 6 истечение газов и паров Первый закон термодинамики для потока газа.
- •Адиабатное течение идеального газа по горизонтальному каналу без совершения технической работы.
- •Закон геометрического обращения воздействия
- •Определение скорости потока на выходе из канала
- •Массовый секундный расход газа
- •Анализ соплового течения газа через суживающееся сопло
- •Сопло Лаваля
- •Лекция 7 реальные газы
- •Устройство pv – диаграммы реального газа
- •Области pv- диаграммы
- •Уравнение состояния реального газа
- •Определение параметров влажного насыщенного пара
- •Диаграммы водяного пара
- •Лекция 8
- •Оновной закон теплопроводности. Гипотеза фурье.
- •В практике теплотехнических расчетов широко пользуются понятием теплового потока:
- •Конвекция
- •Процесс теплообмена между поверхностью твердого тела и жидкостью, омывающей поверхность, называется теплоотдачей.
- •Основной закон теплоотдачи. Уравнение ньютона – рихмана.
- •Теплопередача
- •Теплообмен излучением
- •Лекция 9 дифференциальное уравнение теплопроводности
- •Частные случаи дифференциального уравнения теплопроводности.
- •Для неподвижной среды (для твердого тела).
- •Дифференциальное уравнение теплопроводности для твердого тела в цилиндрической системе координат.
- •Простейший случай дифференциального уравнения теплопроводности для одномерного стационарного поля.
- •Краевые условия (условия однозначности).
- •Граничные условия.
- •Рассмотрим пример.
2.5.4. Изобарный процесс
В данном случае накладывается запрет на изменение давления (p = const).
Теплоемкость системы
![]() .
.
Определим значение n при р = const. Из (2.19) следует
![]() .
.
Если в основное уравнение политропы подставить найденное значение n, то
![]() ,
,
![]() .
.
При
рассмотрении изобарного процесса имеет
смысл искать соответствие между основными
параметрами состояния лишь в виде
![]() .
Уравнение (2.25) при
.
Уравнение (2.25) при
![]() дает
дает
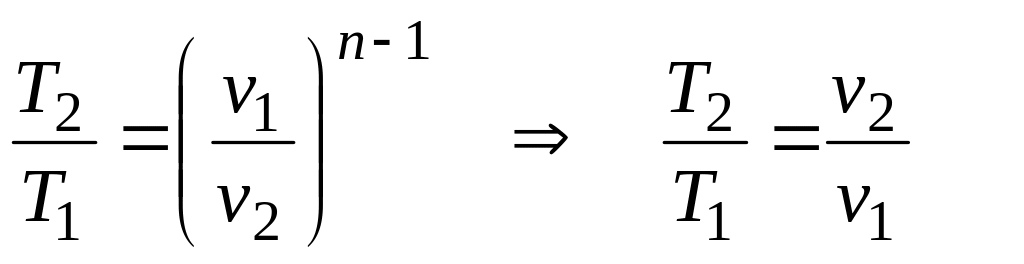 -
закон Гей-Люссака.
-
закон Гей-Люссака.
То есть в изобарном процессе изменение объема прямо пропорционально изменению абсолютной температуры.
Изменение внутренней энергии идеального газа не зависит от пути процесса, т.е. U в случае p = const
.
Изменение энтальпии
.
Изменение энтропии определяется из выражения (2.35)
![]() .
.
Работа, производимая газом в ходе изобарного расширения или затрачиваемая на его изобарное сжатие, легко может быть определена по формуле политропного процесса при условии, что . Это условие сводит все формулы работы политропного процесса к двум:
![]() (2.42)
(2.42)
и
![]() .
(2.43)
.
(2.43)
Следует отметить, что уравнение (2.42) может быть получено для из самого общего выражения работы (2.38) без каких-либо оговорок относительно природы газа. Поэтому данная формула справедлива как для реальных, так и для идеальных газов.
Рассмотрение (2.43) представляет дополнительный интерес в связи с тем, что оно позволяет раскрыть физический смысл газовой постоянной. Действительно, если решить (2.43) относительно газовой постоянной
![]() ,
,
то последняя представляется как работа расширения в изобарном процессе 1 кг идеального газа при изменении его температуры на 1 градус.
Тепло, подводимое (отводимое) в ходе изобарного процесса, можно найти с помощью уравнения первого начала термодинамики
![]()
или с помощью теплоемкости:
![]() .
.
2.5.5. Изотермический процесс
Теплоемкость
![]() (2.44)
(2.44)
в
случае изотермического процесса (![]() ),
как видно из (2.44) равна бесконечности.
Уравнение (2.19) при подстановке в него
),
как видно из (2.44) равна бесконечности.
Уравнение (2.19) при подстановке в него
![]() дает неопределенность вида
дает неопределенность вида
![]() ,
раскрытие которой в данном случае может
быть осуществлено путем вычитания из
обеих его частей по единице:
,
раскрытие которой в данном случае может
быть осуществлено путем вычитания из
обеих его частей по единице:
![]()
при подстановке
![]()
или
![]() .
.
Если
в основное уравнение политропы (2.22)
подставить найденное значение
![]() ,
то получим
,
то получим
![]() (2.45)
(2.45)
представляющее собой математическую запись закона Бойля-Мариотта.
Таким образом, изотермический процесс изменения состояния идеального газа – частный случай политропного процесса, когда .
Как
следует из уравнения (2.45), в системе
координат
![]() изотермический процесс изменения
состояния идеального газа представляет
собой равнобокую гиперболу, асимптотами
которой являются оси координат.
изотермический процесс изменения
состояния идеального газа представляет
собой равнобокую гиперболу, асимптотами
которой являются оси координат.
При
![]() переменными оказываются лишь два
основных параметра состояния, взаимосвязь
между которыми определяется уравнением
(2.45). В соответствии с последним
переменными оказываются лишь два
основных параметра состояния, взаимосвязь
между которыми определяется уравнением
(2.45). В соответствии с последним
![]() .
.
Внутренняя энергия идеального газа включает в себя лишь внутреннюю кинетическую энергию, которая однозначно связана с температурой. Поэтому при
![]() . (2.46)
. (2.46)
Изменение энтальпии
![]() .
.
Изменение энтропии определяется из уравнений (2.34) и (2.35), которые при принимают следующий вид:
![]()
и
![]() .
.
Формулы
работы, производимой идеальным газом
при изотермическом расширении, могут
быть получены из уравнений работы,
полученных для общего случая политропного
процесса. Однако, простая подстановка
в уравнение (2.40)
с учетом
и
приводит к неопределенности типа
![]() .
Используем для этой цели уравнение
(2.40),
применив к нему правило Лопиталя.
Обозначим в уравнении (2.40)
.
Используем для этой цели уравнение
(2.40),
применив к нему правило Лопиталя.
Обозначим в уравнении (2.40)
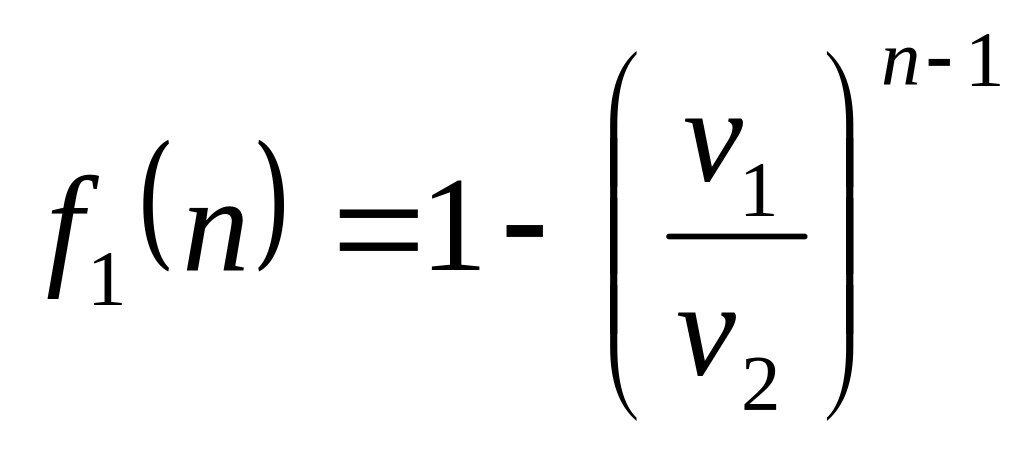
![]() .
.
Тогда (2.40) примет вид:
![]() (2.47)
(2.47)
В соответствии с правилом Лопиталя при неопределенности типа или
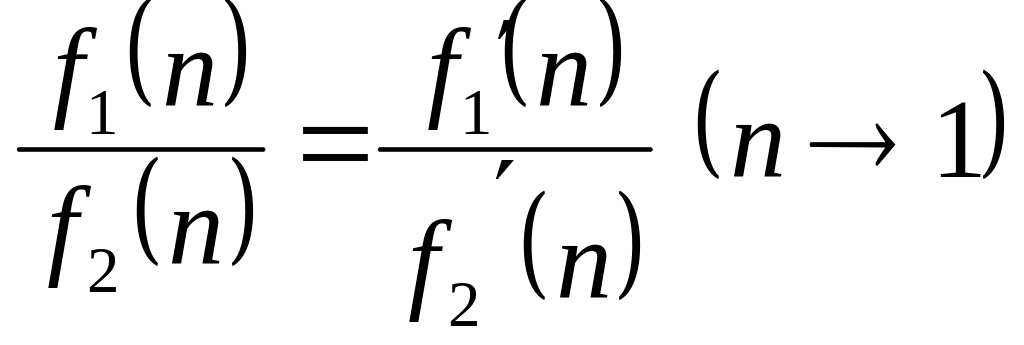 (2.48)
(2.48)
![]() .
(2.49)
.
(2.49)
Решая совместно (2.47), (2.48) и (2.49), получим
![]() .
(2.50)
.
(2.50)
Учитывая (2.46), уравнение первого начала термодинамики для изотермического процесса изменения состояния сведется к виду
![]() .
.
Таким образом, в изотермическом процессе изменения состояния идеального газа все подводимое к телу тепло идет на совершение работы расширения.
