
- •Лекция 1
- •1.1. Органические топлива
- •1.1.1. Классификация углеводородных горючих
- •1.1.2. Состав топлив
- •1.1.3. Характеристики топлив
- •1.1.4. Разновидности горения
- •1.1.5. Основные стадии гетерогенного горения
- •1.1.6. Фазы горения
- •Лекция 2
- •1.1.7. Скорость горения
- •1.2. Расчет процессов горения
- •2. Определение количества и состава продуктов сгорания.
- •1.2.1. Определение потребного количества окислителя для полного сжигания 1кг горючего
- •1.2.2. Определение массы воздуха для сжигания 1кг топлива
- •1.2.3. Коэффициент избытка воздуха
- •1.2.4. Определение количества и состава продуктов сгорания
- •1.2.5. Определение состава продуктов сгорания
- •1.2.6. Определение температуры конца сгорания
- •1.2.7. Упрощенная форма уравнения теплового баланса
- •Лекция 3
- •2.1. Основные понятия и определения термодинамики
- •2.2. Параметры состояния системы
- •2.3. Первый закон термодинамики. Работа и теплота.
- •2.4. Свойства рv – и Тs – диаграмм
- •Лекция 4
- •2.5. Термодинамические процессы идеальных газов
- •2.5.1. Политропный процесс
- •Вывод уравнения политропного процесса
- •Соотношения между параметрами состояния в политропном процессе
- •Определение изменения внутренней энергии
- •Определение изменения энтальпии
- •Определение изменения энтропии
- •Определение теплоты, подводимой (отводимой) в ходе политропного процесса
- •Определение работы расширения в ходе политропного процесса
- •2.5.2. Частные случаи политропного процесса
- •2.5.3. Изохорный процесс
- •2.5.4. Изобарный процесс
- •2.5.5. Изотермический процесс
- •2.5.6. Адиабатный процесс
- •2.5.7. Графическое изображение процессов
- •Лекция 5 сжатие газов в компрессорах
- •Работа компрессора.
- •Действительная индикаторная диаграмма компрессора.
- •Объемный кпд компрессора.
- •Гидравлические потери в распределительных органах компрессора.
- •Многоступенчатые компрессоры.
- •Лекция 6 истечение газов и паров Первый закон термодинамики для потока газа.
- •Адиабатное течение идеального газа по горизонтальному каналу без совершения технической работы.
- •Закон геометрического обращения воздействия
- •Определение скорости потока на выходе из канала
- •Массовый секундный расход газа
- •Анализ соплового течения газа через суживающееся сопло
- •Сопло Лаваля
- •Лекция 7 реальные газы
- •Устройство pv – диаграммы реального газа
- •Области pv- диаграммы
- •Уравнение состояния реального газа
- •Определение параметров влажного насыщенного пара
- •Диаграммы водяного пара
- •Лекция 8
- •Оновной закон теплопроводности. Гипотеза фурье.
- •В практике теплотехнических расчетов широко пользуются понятием теплового потока:
- •Конвекция
- •Процесс теплообмена между поверхностью твердого тела и жидкостью, омывающей поверхность, называется теплоотдачей.
- •Основной закон теплоотдачи. Уравнение ньютона – рихмана.
- •Теплопередача
- •Теплообмен излучением
- •Лекция 9 дифференциальное уравнение теплопроводности
- •Частные случаи дифференциального уравнения теплопроводности.
- •Для неподвижной среды (для твердого тела).
- •Дифференциальное уравнение теплопроводности для твердого тела в цилиндрической системе координат.
- •Простейший случай дифференциального уравнения теплопроводности для одномерного стационарного поля.
- •Краевые условия (условия однозначности).
- •Граничные условия.
- •Рассмотрим пример.
Определение изменения внутренней энергии
Изменение внутренней энергии, как и любого другого параметра состояния, не зависит от характера процесса. В случае идеального газа оно всегда определяется с помощью следующих уравнений.
Для элементарного процесса
. (2.27)
Для 1 кг массы термодинамической системы
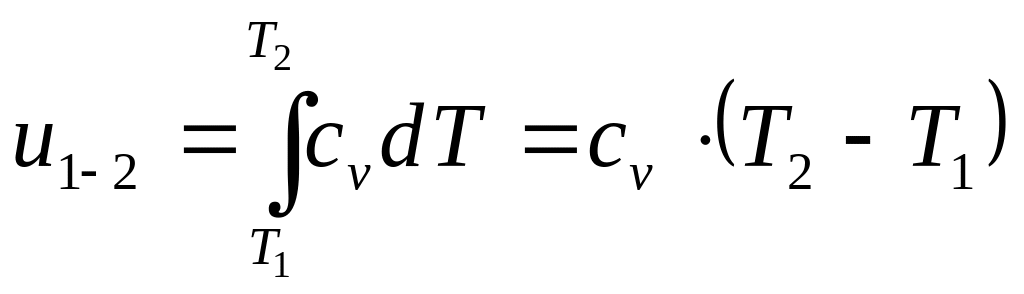 .
(2.28)
.
(2.28)
Для всей массы термодинамической системы
![]() .
(2.29)
.
(2.29)
Определение изменения энтальпии
Для элементарного процесса
. (2.30)
Для 1 кг массы термодинамической системы
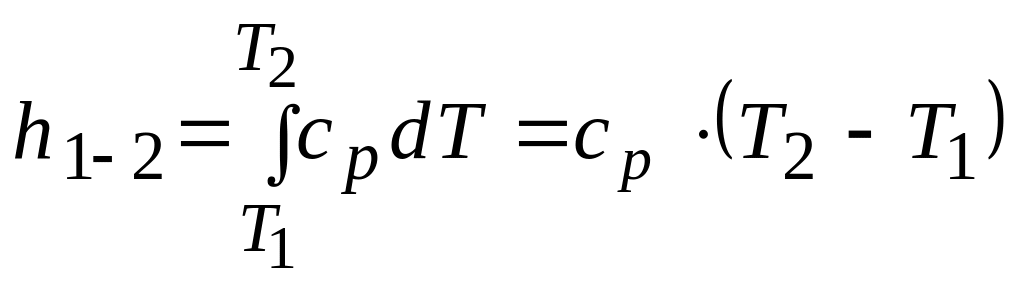 .
(2.31)
.
(2.31)
Для всей массы термодинамической системы
![]() .
(2.32)
.
(2.32)
Определение изменения энтропии
Изменение энтропии в элементарном термодинамическом процессе по определению выражается соотношением
![]() .
.
Используя соотношение первого закона термодинамики (2.13), получим
![]() .
.
Если
решить уравнение состояния идеального
газа, то получим
![]() ,
следовательно
,
следовательно
![]() .
(2.33)
.
(2.33)
Интегрируя соотношение (2.33), получим изменение энтропии в конечном процессе для 1 кг термодинамической системы
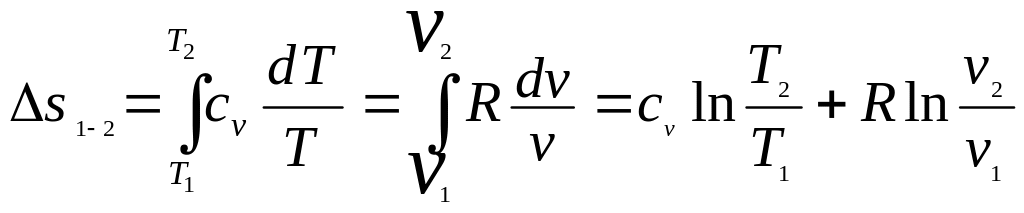 .
(2.34)
.
(2.34)
Используя выражение первого закона термодинамики в форме (2.16), и проделав аналогичные преобразования, получим
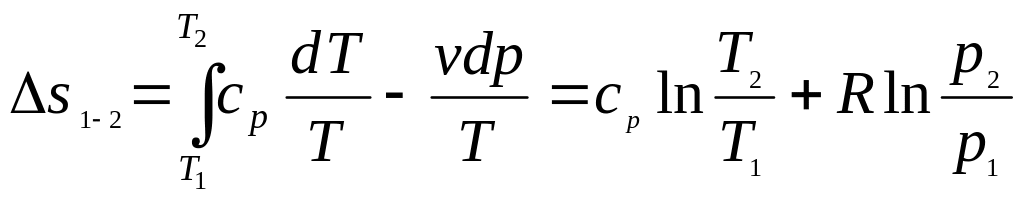 .
(2.35)
.
(2.35)
Определение теплоты, подводимой (отводимой) в ходе политропного процесса
Количество тепла, подводимого (отводимого) в ходе политропного процесса, можно определить с помощью уравнения первого закона термодинамики
![]() .
.
Сказанное не исключает возможности определения dq с помощью теплоемкости
или
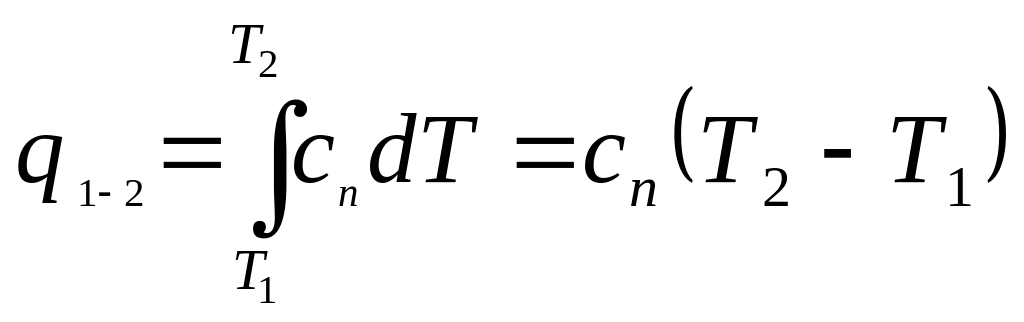 .
.
Используя соотношение (2.19) найдем теплоемкость политропного процесса
![]() ,
(2.36)
,
(2.36)
где
![]()
![]() показатель
адиабаты.
показатель
адиабаты.
Таким образом
![]() .
(2.37)
.
(2.37)
Определение работы расширения в ходе политропного процесса
Определим работу расширения в политропном процессе.
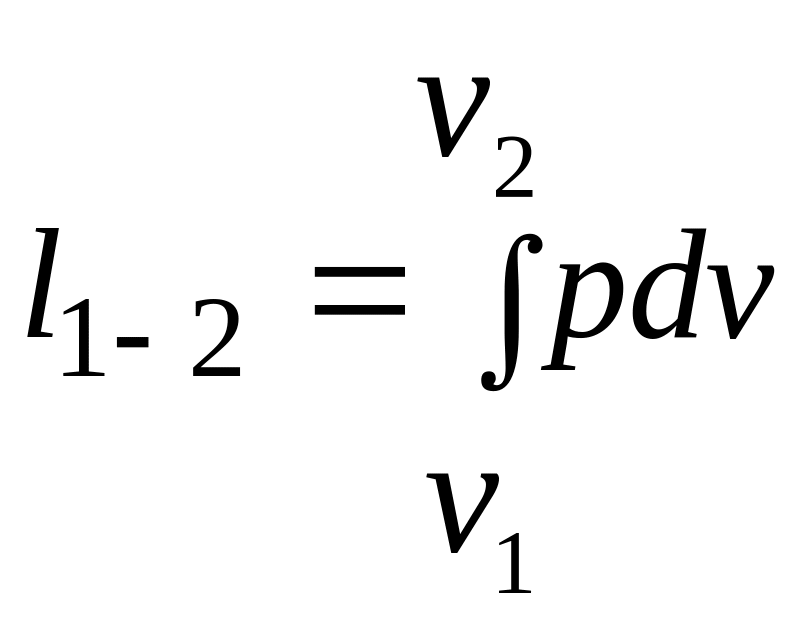 .
(2.38)
.
(2.38)
В соответствии с основным уравнением политропы
![]() ,
,
где p, v – текущие значения давления и объема в ходе процесса.
Отсюда
![]() .
(2.39)
.
(2.39)
Совместное решение (2.38) и (2.39) дает

или
 , (2.40)
, (2.40)
![]() .
.
Для работы идеального газа справедливы следующие выражения
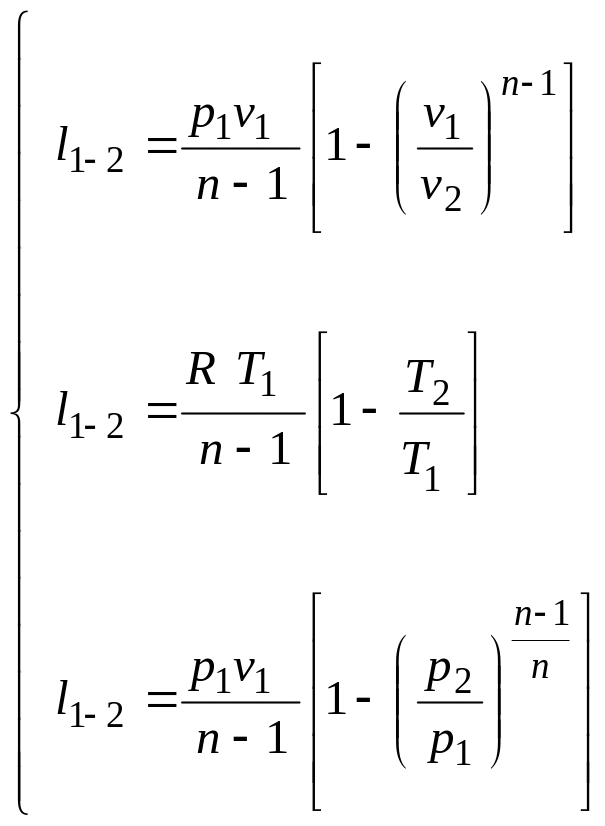 (2.40а)
(2.40а)
2.5.2. Частные случаи политропного процесса
При рассмотрении политропного процесса предполагалось, что все параметры состояния меняются в ходе процесса, что имеет место обмен энергией между системой и окружающей средой. Вместе с тем, существует группа процессов, при протекании которых накладывается запрет на изменение того или иного параметра состояния, на тот или иной вид энергетического обмена с окружающей средой. Различают четыре вида таких процессов. Это изохорный (v = const), изобарный (р = const), изотермический (T = const) и адиабатный или изоэнтропный (s = const). Рассмотрим эти процессы.
2.5.3. Изохорный процесс
В данном случае запрещается изменение объема (v = const).
Теплоемкость системы
![]() .
.
Определим значение n при v = const. Из (2.19) следует
![]()
Извлечем корень n-ой степени из (2.22)
![]()
и подставим в него найденное значение показателя политропы. Тогда получим
![]() .
.
Таким
образом, из общего уравнения политропы
получено уравнение изохорного процесса.
Последнее позволяет рассматривать
изохорный процесс как частный случай
политропного процесса при n =
![]() .
.
Определим соотношение между параметрами в изохорном процессе.
Для изохорного процесса имеет смысл искать соотношение лишь между Р и Т, т.к. при v = const отыскание взаимосвязи между Р и v или Т и v лишено смысла.
В общем случае протекания политропного процесса соотношение Р и Т устанавливалось (2.26)
 .
.
Если ввести в него n = , то
![]() .
(2.41)
.
(2.41)
Выражение (2.41) известно из физики как закон Шарля.
Изменение внутренней энергии
![]() .
.
Изменение энтальпии
![]() .
.
Изменение энтропии определяется из выражения (2.34)
![]() .
.
Работа расширения
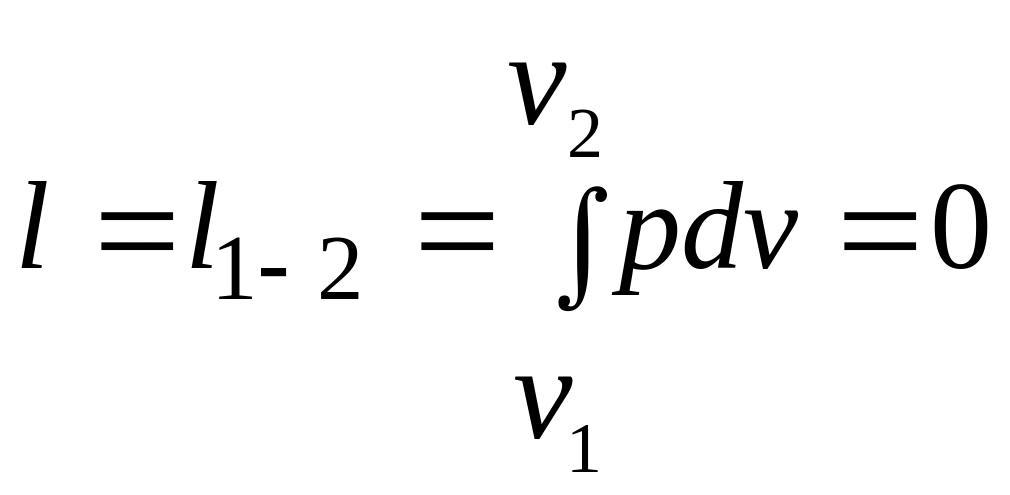 .
.
Из первого закона термодинамики следует
![]()
или
![]() .
.
