
- •Цель и задачи дисциплины
- •План предполагаемого объема часов по темам и видам учебных занятий
- •Основные условные обозначения
- •Раздел I техническая термодинамика
- •Основные положения технической термодинамики.
- •Основные понятия и определения.
- •Основные параметры термодинамики.
- •Физический смысл газовой постоянной
- •2. Основное уравнение кинетической теории газов.
- •3. Состав смеси в массовых и в объемных долях
- •Постоянная теплоемкость
- •Переменная теплоемкость
- •Средняя теплоемкость
- •Теплоемкость при постоянном объеме и давлении
- •Для продуктов горения
- •Для реального газа
- •Теплоемкость смеси газов
- •Вопросы для самоконтроля
- •Внутренняя энергия и её свойства
- •Энтальпия газа
- •Работа газа
- •Вопросы для самоконтроля
- •Изохорный, изобарный, изотермический, адиабатный и политропный процессы.
- •Содержание второго закона термодинамики и его формулировки. Круговые процессы, прямой и обратный цикл. Термический к.П.Д. Цикла. Цикл Карно и холодильный коэффициент.
- •Аналитическое выражение 2-го закона термодинамики. Энтропия газов и диаграмма ts. Статистическое толкование 2-го закона и ошибочность положений Клаузиуса. Термодинамические процессы
- •Изобарный процесс
- •Изотермический процесс
- •Адиабатный процесс
- •Круговые процессы или циклы
- •Цикл Карно (Сади Карно 1824 г.)
- •Обратный цикл Карно
- •Общее свойство обратимых и необратимых циклов
- •Энтропия газов (превращение газов)
- •Диаграмма тs
- •Рассмотрим изотермический процесс
- •Политропные процессы в ts диаграмме
- •Вопросы для самоконтроля
- •Цикл со смешанным подводом тепла (цикл Тринклера).
- •(Цикл Тринклера)
- •(Цикл Отто)
- •(Цикл Дизеля)
- •Вопросы для самоконтроля
- •Влажный воздух как смесь сухого воздуха и водяного пара.
- •Основные параметры влажного воздуха.
- •Диаграмма I-d влажного воздуха
- •Вопросы для самоконтроля
- •Понятие о насадках для истечения паров и газов
- •При адиабатном истечении:
- •Комбинированное сопло Лаваля
- •Истечение водяного пара
- •Вопросы для самоконтроля
- •Процесс образования пара.
- •Диаграммы p-V, t-s и I-s для водяного пара.
- •Основные термодинамические процессы в I-s диаграмме водяного пара.
- •Энтропия процесса получения пара
- •Диаграмма I – s Общий метод решения задач по диаграмме I – s
- •Для всех процессов
- •Вопросы для самоконтроля
- •Цикл Карно для пара
- •Цикл Ренкина
- •Цикл Ренкина c насыщенным паром
- •Цикл Ренкина с перегретым паром
- •Цикл Ренкина с промежуточным перегревом пара
- •Вопросы для самоконтроля
- •Компрессорных машин
- •Рабочий процесс одноступенчатого компрессора и изображение его в p-V и t-s координатах.
- •Работа и мощность на привод компрессора.
- •Термодинамическое обоснование многоступенчатого сжатия.
- •Термодинамическое обоснование многоступенчатого сжатия
- •Вопросы для самоконтроля
- •Сущность процесса.
- •Изменение состояния газа и пара при дросселировании.
- •Эффект Джоуля-Томсона.
- •Вопросы для самоконтроля
- •3. Термические к.П.Д. Циклов и методы их повышения.
- •4. Понятие о бинарных циклах.
- •Работа гту
- •Бинарные циклы
- •Принципиальная схема парогазовой установки и ее ts-диаграмма
- •Преимущества парогазовой установки:
- •Вопросы для самоконтроля
- •Принципиальная схема и цикл паровой компрессионной холодильной установки.
- •Холодопроизводительность.
- •Принцип работы тепловых насосов и отопительный коэффициент.
- •Холод получают:
- •Упрощенный действительный цикл паровой компрессионной холодильной машины
- •Холодопроизводительность
- •Принцип работы тепловых насосов и коэффициент преобразования
- •Вопросы для самоконтроля
- •Раздел II теория теплообмена
- •Основные понятия и определения.
- •Теплопроводность для одно- и многослойных плоскостей различных конфигураций.
- •Основной закон теплопроводности. Закон Фурье.
- •Для реальных:
- •Теплопроводность однородной плоской стенки
- •Теплопроводность многослойной стенки
- •Теплопроводность однослойной цилиндрической стенки
- •Теплопроводность многослойной цилиндрической стенки
- •Вопросы для самоконтроля
- •Факторы процесса теплопередачи
- •Дифференциальное уравнение теплоотдачи
- •Основы теории подобия физических явлений
- •Вопросы для самоконтроля
- •Излучение светящегося пламени
- •Вопросы для самоконтроля
- •Теплопередача
- •Теплопередача через плоскую стенку
- •Теплопередача через многослойную стенку
- •Теплопередача через цилиндрическую стенку
- •Вопросы для самоконтроля
- •Литература
- •Содержание
Внутренняя энергия и её свойства
Каждая молекула обладает кинетической энергией поступательного и вращательного движения. Атомы, образующие молекулу, совершают колебательные движения – это энергия внутренних колебаний.
Реальный газ обладает и потенциальной энергией, зависящей от сцепления между молекулами. Сумма всех видов энергии определяет внутреннюю тепловую энергию газа – внутреннюю энергию газа.
Все виды энергии, кроме потенциальной, зависят от температуры, а потенциальная – от расстояния между молекулами, т.е. под каким давлением при данной температуре находится газ.
Следовательно, внутренняя энергия реального газа зависит от температуры и удельного объема или Р1, а идеального газа – зависит только от температуры, т.е.:
![]() - для реального
газа
- для реального
газа
![]() - для
идеального газа
- для
идеального газа
Если представить в координатах РV ряд произвольных процессов abcdу которых начальные и конечные составляющие одинаковы, то изменение внутренней энергии во всех этих процессах будет одно и то же, т.е.
![]() - это для реального
газа (10)
- это для реального
газа (10)
![]() - для идеальных
газов (11)
- для идеальных
газов (11)
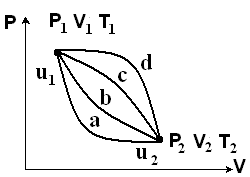
Изменение внутренней энергии не зависит от характера протекания процесса, а зависит от начального и конечного состояний газа, определяемых его параметрами P1, V1, T1 и P2, V2, T2.
Для идеальных газов изменение внутренней энергии зависит только от начальной и конечной температуры.
Следовательно, в термодинамике надо рассматривать не абсолютное количество внутренней энергии, а только ее изменения.
![]() аналогично:
аналогично:
![]() (12)
(12)
Таким образом, какой бы процесс не совершался изменением температуры от Т1 до Т2, изменение внутренней энергии идеального газа будет одинаково и равно изменению его внутренней энергии в процессе при v = const при том же изменении температур, т.е.
![]()
для бесконечного малого изменения состояния:
![]() (13)
(13)
Изменение внутренней энергии для реального газа во всех процессах изменения, кроме процесса при V = const:
![]() (14)
(14)
т.к. в этом случае изменяется не только кинетическая и внутримолекулярная энергия, но и потенциальная энергия.
Энтальпия газа
i – энтальпия введена в термодинамику для упрощения рассмотрения процессов в тепловых двигателях.
![]() кДж/кг (15)
кДж/кг (15)
Энтальпия (теплосодержание) является суммой внутренней энергии и работы проталкивания (произведение давления на удельный объем), т.е., «i» является параметром состояния газа и рассматривается как разность энтальпий в каком-либо процессе.
Для определения численного значения энтальпии в выражение определения внутренней энергии подставляем значения «u» и «P∙V».
i = u+P∙V
![]()
(т.к. отсчет ведут от 0 ºС и Р = 760 мм. рт. ст.)
![]() , следовательно:
, следовательно:
![]() (16)
(16)
т.к.
![]() и
и
![]()
то:
![]() (17)
(17)
т.е. энтальпия численно равна теплу, которое идет на нагревание газа от 0ºС до Т при P = const.
1-й закон термодинамики:
![]() , а т. к.
, а т. к.
![]() и
и
![]()
следовательно:
![]() сгруппируем
сгруппируем
![]()
![]() (18)
(18)
т.е. внешнее тепло в процессе при p = const равно разности энтальпий в конце и начале процесса.
Энтальпии можно дать следующее понятие.
П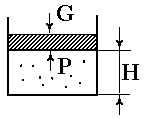 усть
в цилиндре находится 1 кг газа. На поршень
положили груз массой «G»,
уравновешивающий давление газа «Р».
Очевидно, что G
= f∙Р,
где f
– площадь поршня. Вся система находится
в равновесии, т.е. энергия системы (1 кг
газа и груз) равны внутренней (u)
энергии газа и потенциальной энергии
груза массой «G»
поднятого на высоту «Н», т.к. G
= f∙Р
усть
в цилиндре находится 1 кг газа. На поршень
положили груз массой «G»,
уравновешивающий давление газа «Р».
Очевидно, что G
= f∙Р,
где f
– площадь поршня. Вся система находится
в равновесии, т.е. энергия системы (1 кг
газа и груз) равны внутренней (u)
энергии газа и потенциальной энергии
груза массой «G»
поднятого на высоту «Н», т.к. G
= f∙Р
![]() ,
,
а f∙Н = v (1 кг газа в цилиндре), то энергия системы равна:
![]() энтальпии газа.
энтальпии газа.
Соотношение между параметрами P1, V1, T.
Термические уравнения состояния, а между «u» и «i» и любыми двумя из параметров P1 V и Т – калорическими.
