- •Глава 1 методы исследования
- •Осмотр (inspectio)
- •Пальпация (palpatio)
- •Перкуссия (percussio)
- •Аускультация (auscultatio)
- •Методика и техника аускультации
- •Термометрия
- •I. Предварительное ознакомление с больным животным
- •II. Собственное исследование (status praesens)
- •Типы конституции и их клиническое значение
- •Кожные сыпи
- •Термометрия
- •Нормальная температура тела животных
- •Лихорадка
- •Гипотермия
- •Глава III исследование сердечно-сосудистой системы
- •Исследование сердца
- •Аускультация сердца
- •Происхождение и характер тонов сердца
- •Шумы сердца
- •Графические методы, применяемые при исследовании сердечно-сосудистой системы
- •Клиническое исследование периферических вен
- •Флебография
- •Аритмии (arhythmiae)
- •Кровяное давление
- •Функциональные методы исследования сердечно-сосудистой системы
- •Глава IV исследование дыхательной системы
- •Осмотр носовых отверстий и слизистой оболочки носа
- •Исследование верхнечелюстной и лобной пазух
- •Исследование воздухоносных мешков у лошадей
- •Исследование гортани и трахеи
- •Исследование мокроты
- •Исследование щитовидной железы
- •Частота дыхания
- •Ритм дыхания
- •Типы дыхания
- •Сила и симметричность дыхательных движений
- •Форма грудной клетки
- •Пальпация грудной клетки
- •Перкуссия грудной клетки
- •Изменение границ легких
- •Аускультация грудной клетки
- •Основные физиологические дыхательные шумы
- •Патологические шумы дыхания
- •Трахеальная перкуссия — плегафония
- •Фонометрия
- •Графические методы исследования дыхания
- •Пневмография
- •Пробный прокол грудной клетки
- •Функциональные методы исследования дыхательной системы
- •Клинические показатели подготовленности лошади (по н. С. Черепанов)
- •Глава V исследование пищеварительной системы общие замечания
- •Аппетит
- •Прием корма и питья
- •Исследование преджелудков жвачных
- •Исследование желудка лошади
- •Исследование кишечника
- •Желудочный сок лошади
- •Патологическая секреция при заболеваниях желудка лошади
- •Исследование нативного содержимого желудка
- •Глава VI исследование мочевой системы общие замечания
- •Исследование мочевого пузыря
- •Свойства нормальной мочи некоторых животных
- •Определение физических свойств мочи
- •Определение количества белка в моче кольцевой пробой Роберте -Стольникова
- •Упрощенные методы исследования мочи (с помощью фильтровальной бумаги)
- •Микроскопическое исследование осадков мочи
- •Функциональные методы исследования почек
- •Выделение индигокармина у клинически здоровых лошадей и крупного рогатого скота
- •Глава VII исследование нервной системы
- •И. П. Павлова
- •Патологические изменения чувствительности
- •Мышечный тонус и пассивные движения
- •Расстройства координации движений (атаксии)
- •Механическая возбудимость мышц
- •Параличи
- •Судороги и гиперкинезы
- •Фармакологическая методика
- •Глава VIII исследование системы крови значение гемодиализа и история развития гематологии
- •Ретракция кровяного сгустка
- •Реакция оседания эритроцитов (роэ)
- •Определение билирубина в сыворотке крови
- •Определение кальция в крови
- •Определение фосфора в крови
- •Определение количества гемоглобина
- •Определение цветного показателя
- •Подсчет форменных элементов крови
- •Нормальное количество эритроцитов в крови здоровых животных
- •Техника подсчета лейкоцитов
- •Нормальное количество лейкоцитов в кропи здоровых животных
- •Техника подсчета кровяных пластинок
- •Техника подсчета форменных элементов крови у птиц
- •Техника приготовления мазков
- •Диаметр (в микронах) эритроцитов разных видов животных
- •Лейкоциты
- •Лейкоцитарная формула здоровых животных
- •Учение Шиллинга о лейкоцитозе в свете нейрогенной теории
- •Лейкоцитарный профиль
- •Сетка для гематологического профиля лошади (по Домрачеву)
- •Определение функциональной) способности кровотворных органов
- •Оглавление
- •Глава I. Методы исследования (в. И. Зайцев)............ 13
- •Глава II. Общее исследование животного (в. И. Зайцев)......... 25
- •Глава III. Исследование сердечно-сосудистой системы (и. Г. Шарабрин)67
- •Глава IV. Исследование дыхательной системы (в. И. Зайцев) . . .... 107
- •Глава V. Исследование пищеварительной системы (а. В. Синее) ..... 149
- •Глава VI. Исследование мочевой системы (п. С. Ионов).......... 215
- •Глава VII. Исследование нервной системы (а. Б. Синев)........ 268
- •Глава VIII. Исследование системы крови (а. В. Васильев) ....... 311
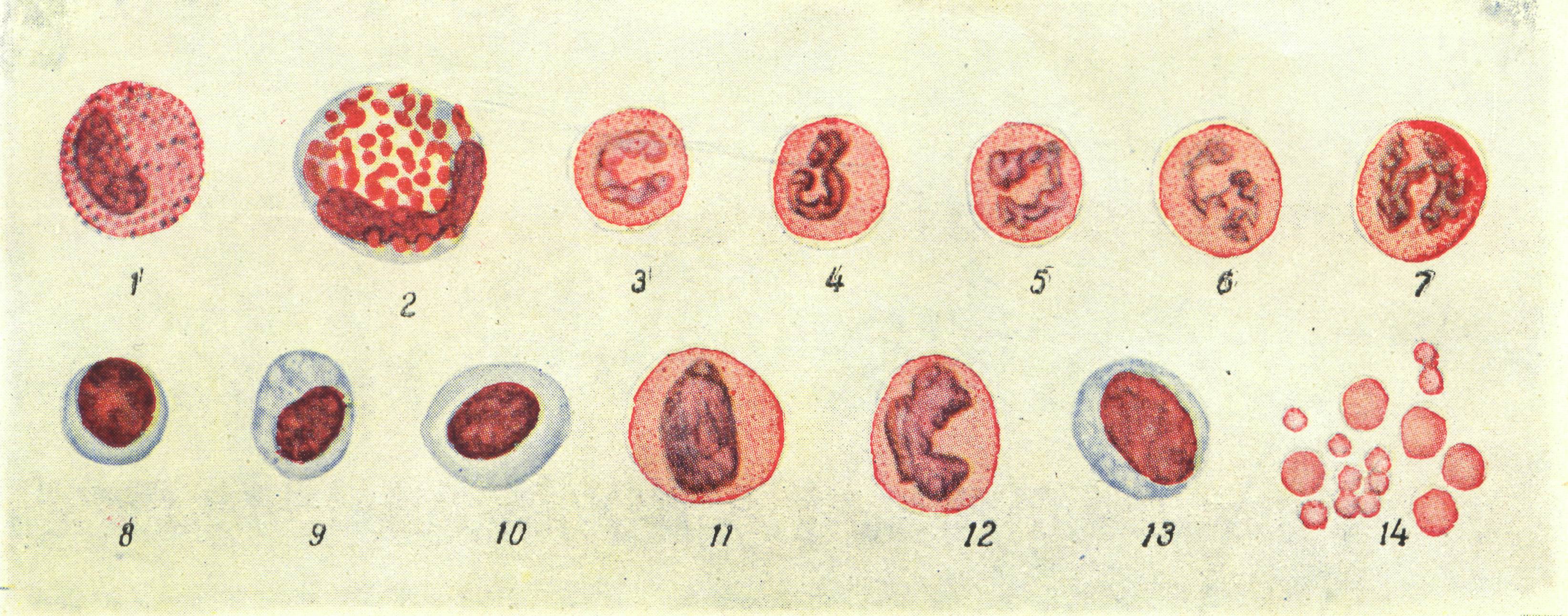
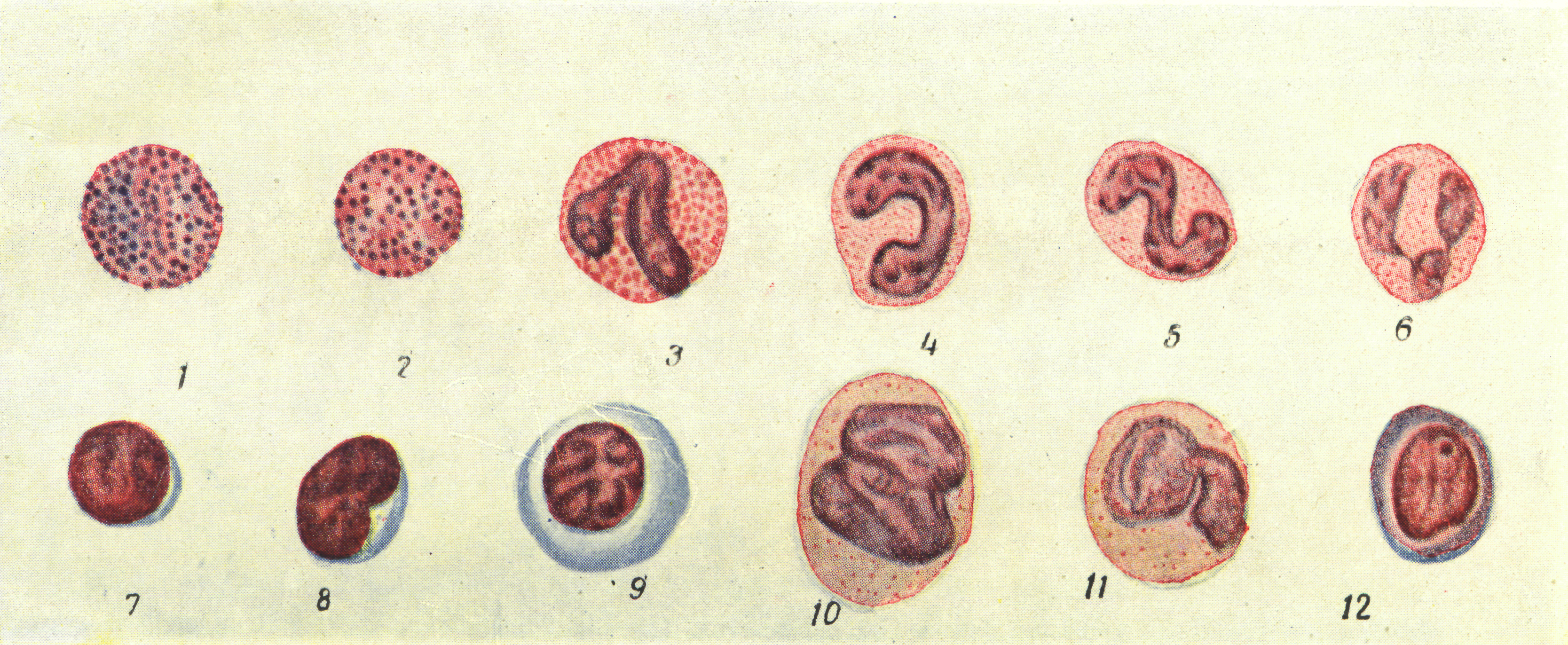
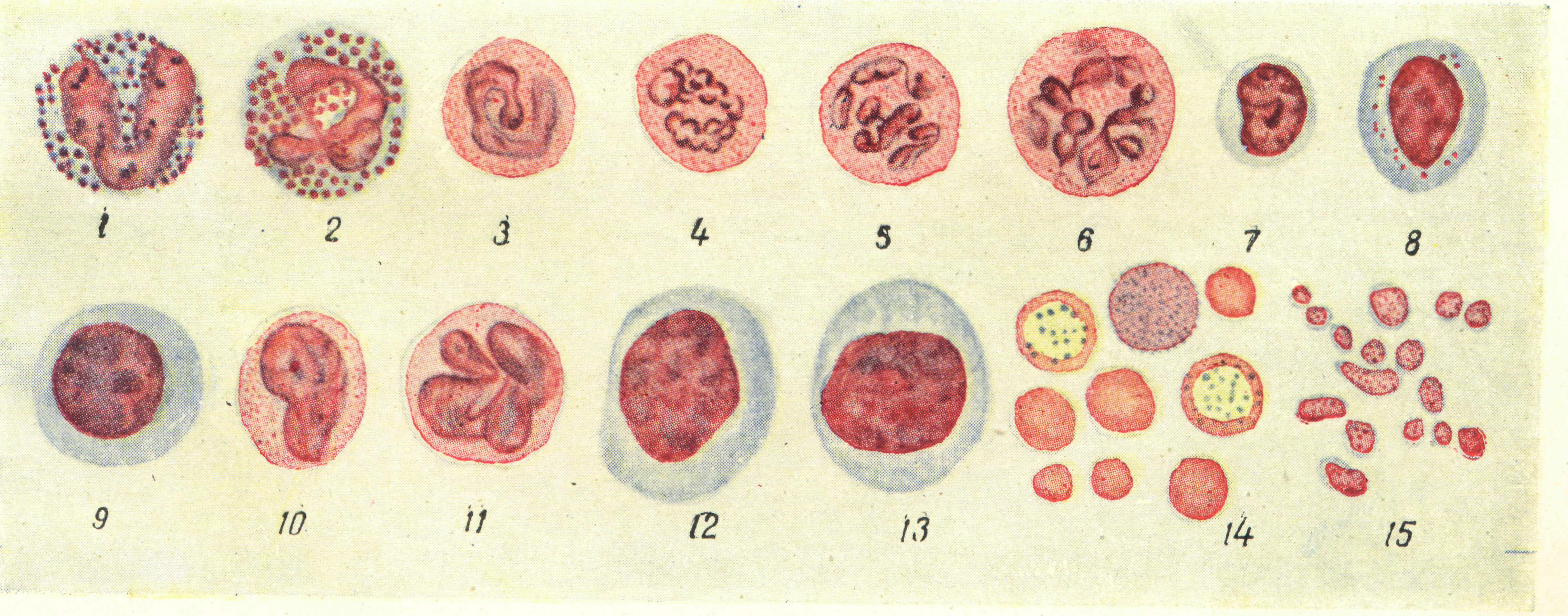
Техника подсчета форменных элементов крови у птиц
Техника подсчета у птиц несколько иная, чем у млекопитающих животных. Это объясняется тем, что эритроциты и тромбоциты птиц в циркулирующей крови имеют ядро и в обычных условиях не дифференцируются. Кроме того, они не разрушаются раствором уксусной кислоты, что препятствует подсчету лейкоцитов.
У птиц в счетной камере вначале определяют общее количество форменных элементов (эритроцитов, лейкоцитов и тромбоцитов), затем в окрашенном мазке подсчитывают 1000 клеток с подразделением на эритроциты, лейкоциты п тромбоциты. После этого путем перерасчета устанавливают количество клеток отдельных видов в 1 мм3.
Если общее количество форменных элементов в 1 мм3 равно 3 500 000, а в окрашенном мазке на 1000 клеток приходится эритроцитов 980, лейкоцитов 9, а тромбоцитов 11, то можно высчитать количество тех и других в 1 мм3 как в абсолютных цифрах, так и в процентах, например
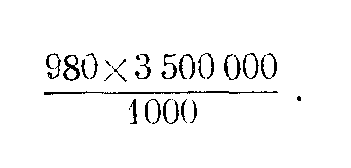
Техника приготовления мазков
Мазки готовят на предметных стеклах. Их нужно обезжирить — хорошо промыть в проточной воде, а стекла, бывшие в употреблении, предварительно прокипятить в соде или лучше в зольном щелоке. Вытертые чистой сухой тряпочкой стекла помещают в смесь спирта с эфиром (в равных частях). Перед работой их вынимают пинцетом и насухо вытирают чистым полотенцем. Лучшие стекла получаются из фотопластинок, так как они не имеют пузырьков и поверхность их ровная и чистая.
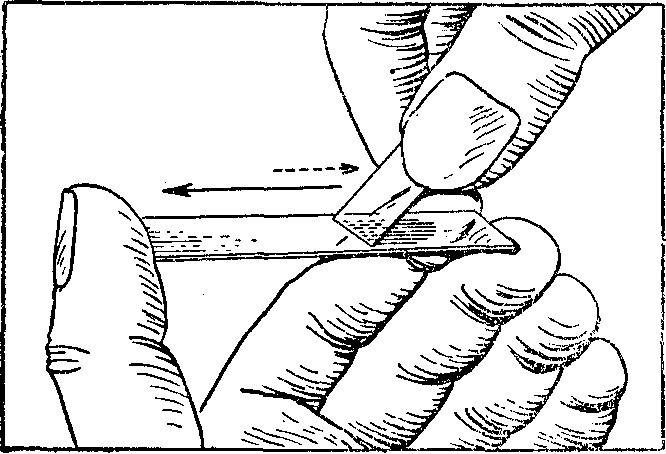
Рис. 179. Техника приготовления мазка.
Первую каплю крови удаляют ваткой, а из второй изготовляют мазки. Кровь необходимо использовать, возможно, быстрее, пока она не потеряла своих физических свойств (наступающее свертывание крови делает приготовление мазка совершенно невозможным). Чтобы мазки получились ровными, однородными и без прерывистых линий, необходимо уверенное выполнение всех манипуляций. Предметное стекло зажимают между большим и средним пальцами левой руки. В правую руку берут шлифованное или покровное стекло. Небольшую каплю крови снимают прикосновением поверхностью предметного стекла, а у беспокойных животных углом покровного стекла, с последующим переносом на предметное.
Краем покровного стекла прикасаются к капле крови, находящейся на предметном стекле. Угол между покровным и предметным стеклом не должен превышать 45—50°. Если стекла чистые и сухие, кровь в силу капиллярности распределяется между ними почти моментально. Покровное стекло фиксируют между пальцами правой руки так, чтобы кончик одного или обоих
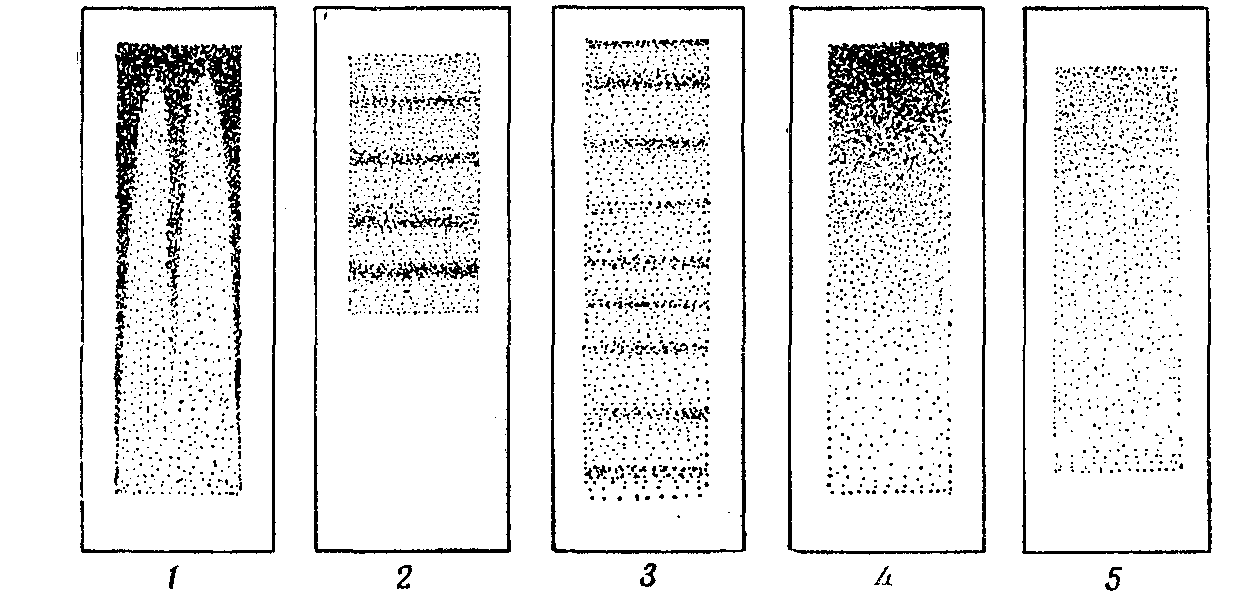
Рис. 180. Правильно и неправильно приготовленные мазки:
1—мазок на плохо обезжиренном стекле; 2—слишком короткий мазок;
3—слишком длинный, неравномерный мазок; 4—слишком толстый мазок;
5—правильный мазок, тонкий, равномерный и достаточно длинный.
пальцев касался края предметного стекла. В этих случаях мазки получаются с ровными краями. Спокойно и не очень быстро передвигая покровное стекло по предметному, приготовляют мазок. Кровь при движении покровного стекла тянется за ним и поэтому не подвергается травмированию. Такие мазки называются «вытяжными», что дает довольно точное определение процесса их изготовления. Мазков делают несколько, чтобы выбрать из них лучшие. Мазок необходимо сейчас же высушить. Летом это можно сделать, положив ого в перевернутом виде на спичку и выставив на солнечный свет. Переворачивание стекол мазками вниз необходимо потому, что летом их очень часто портят мухи. При работе в сыром и холодном помещении мазки можно высушивать на руке, а затем убирать в боковой карман, прикрыв их предварительно чистым стеклом с целью предохранения от повреждений.
Если мазки готовят при температуре 10—15° ниже нуля, то для предотвращения гемолиза их нужно сразу же опустить в кюветку с метиловым спиртом и в таком виде внести в теплое помещение. Окрашивают их обычным методом после фиксации в спирте в течение 5—10 минут. Такие мазки ничем не отличаются от препаратов, сделанных в сухом и теплом помещении, и могут быть использованы для самых тонких гематологических исследований.
Просушивание мазков на пламени горелки не рекомендуется, так как при этом деформируются форменные элементы крови и мазки становятся непригодными.
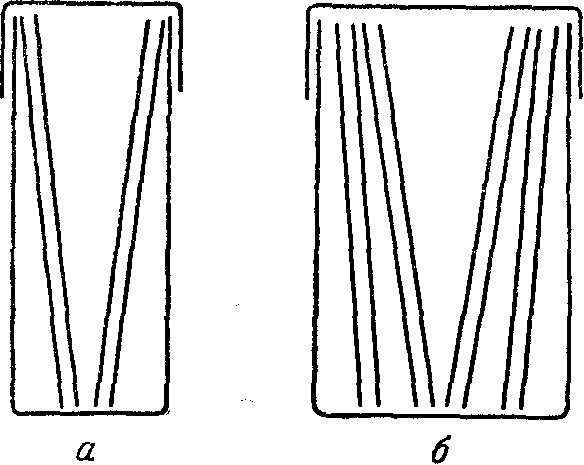
Рис. 181. Кюветки для фиксации мазков: а — узкая, б — широкая.
На высохшем препарате помечают порядковый номер, кличку или номер животного, а также дату приготовления.
Для окраски и исследования отбирают лучшие мазки, отвечающие следующим требованиям: 1) они должны быть уже и короче стекла, т. е. иметь свободные края по длине и зазубренный край но ширине в конце мазка; 2) края их должны быть ровными; 3) они должны быть тонкими, гомогенными, без просветов и прерывающихся линий, с нежной поверхностью и без следов гемолиза.
Препарат, предназначенный для хранения, необходимо оберегать от насекомых, влаги, действия кислот и щелочей, дыма и различных газов. Плохо сохраняемые мазки становятся иногда совершенно непригодными, несмотря на правильное приготовление их вначале.
Фиксация мазков преследует цель закрепить клетки крови в таком виде, чтобы совершенно не изменялись их форма и внутренняя структура. Большинство артефактов, обнаруживаемых при исследовании мазка крови, появляется из-за плохой фиксации. Лучшим фиксатором считают абсолютный метиловый спирт.
Спирт наслаивают непосредственно иа мазок высоким слоем; препарат в этом случае должен лежать горизонтально. Можно также целиком погружать его в спирт, налитый в кюветки. Чтобы предотвратить улетучивание спирта, кюветку закрывают крышкой или пробкой. Такая фиксация производится в течение 3—5 минут. Спирт, если он не загрязнен, можно использовать для фиксации препаратов вторично. Способ фиксации в кюветках удобен тем, что позволяет фиксировать одновременно четыре препарата.
Кроме метилового спирта, можно использовать и другие фиксаторы:

Необходимо учитывать, что денатурированный или 96° спирт дают очень много артефактов.
Специальная фиксация мазков не требуется только в тех случаях, когда фиксирующие вещества входят в состав красок, например при окраске по Май-Грюнвальду и Лейшману.
Фиксированные препараты сохраняются в течение продолжительного времени.
Окраска мазков крови требует внимания и известного опыта. Хорошо приготовленный зафиксированный мазок может быть испорчен плохим окрашиванием вследствие плохого качества краски или же несоблюдения соответствующих правил.
Окрашивание мазков крови, зависящее от прямого сродства элементов крови к краске, должно быть прогрессивным (продолжительное воздействие слабыми растворами краски) и паноптическим. Паиоптическое окрашивание выявляет максимальное число элементов крови с мельчайшими нюансами тонов. В отличие от комбинированного метода, паноптический требует применения нейтральных красок, а не смеси основных и кислых красок. Среди нейтральных паноптических красок наиболее важное место занимает краска Романовского и ее модификации.
Окраска по Романовскому — Гимза. Для окрашивания используют готовый раствор краски. Перед употреблением краску разводят из расчета 1—2 капли на 1 мл дистиллированной воды. Зафиксированный препарат помещают над чашкой мазком вверх на стеклянные палочки и покрывают поверхность мазка высоким слоем рабочего раствора. Окрашивать можно и в кюветках, наполненных раствором краски. Окрашивание продолжается 15—30 минут; для окраски свежих мазков и в сухую жаркую погоду требуется меньше времени, чем при окраске старых и в сырую холодную погоду.
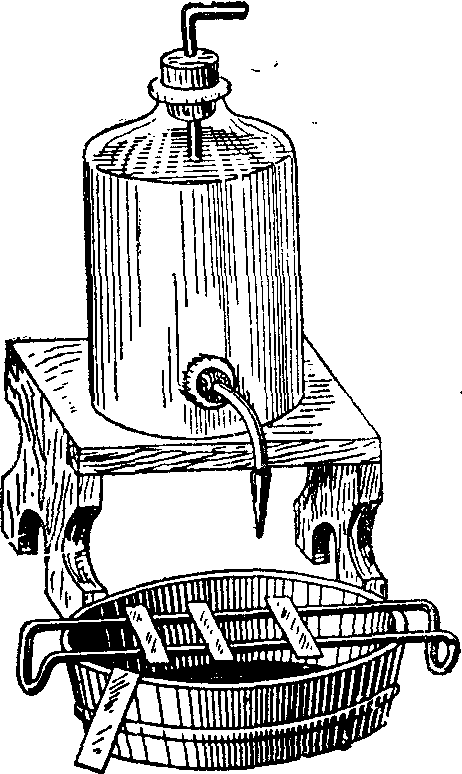
Рис. 182. Приспособление для окрашивания мазков.
По истечении определенного времени краску смывают, лучше дистиллированной водой, и мазок для высушивания ставят вертикально на пропускную бумагу. Та же цель может быть достигнута подогреванием на руке.
При окрашивании по методу Романовского — Гимза необходимо соблюдать ряд предосторожностей: 1) вода должна иметь рН = 6,6—6,8; 2) посуда, в которой разводится краска, должна быть чистой; 3) раствор краски готовят ex tempore, перед окраской, а не заранее, так как наилучшие результаты получаются только со свежим разведением алкогольного раствора в воде; 4) краску следует добавлять в воду по каплям, а не наливать сразу, 5) концентрация раствора не должна превышать 3 капли на 1 мл; 6) для получения красивой дифференциальной окраски дистиллированную воду после промывки оставляют на мазке в течение одной минуты.
Правильная окраска узнается по внешнему виду препарата. Макроскопически он должен иметь розоватый цвет с незначительным фиолетовым оттенком. Серые или серо-голубые мазки указывают на избыток щелочи, ярко-красные — на избыток кислоты или слишком кратковременное окрашивание.
Метод Романовского — Гимза особенно хорош при исследовании мазков на присутствие кровопаразитов, а также при окрашивании одновременно нескольких мазков.
Окраска по Лейшману производится готовым раствором краски Лейшмана. Метод не требует предварительной фиксации и считается поэтому быстрым и сравнительно удобным.
Наслоенные на нефиксированный мазок крови 15—20 капель краски Лейшмана оставляют на 3 минуты. Краска, содержащая метиловый алкоголь, фиксирует препарат и одновременно окрашивает клетки крови. По истечении указанного срока в краску добавляют такое же количество капель дистиллированной воды (15—20 капель) и стеклянной палочкой или пипеткой осторожно все перемешивают. Через 7—15 минут разведенную краску смывают дистиллированной водой, которую так же, как и при окрашивании по Романовскому — Гимза, лучше оставить на мазке на одну минуту. Затем мазок ставят в вертикальное положение или же высушивают на руке. Метод Лейшмана дает очень хорошие результаты при окрашивании мазков из костного мозга.
Окраска по Май-Грюнвальду производится готовым раствором краски Май-Грюнвальд.
На нефиксированный мазок крови наносят 15—20 капель краски и оставляют на нем 3 минуты. По истечении этого времени на мазок наслаивают такое же количество дистиллированной воды (15—20 капель). Краску хорошо перемешивают с водой стеклянной палочкой и докрашивают еще 10—15 минут. Затем препарат промывают дистиллированной водой и высушивают.
Окраска по Паппен гейму соединяет преимущества методов Май-Грюнвальда и Романовского — Гимза. Окраска эта комбинированная и заключается в том, что мазок вначале окрашивают по Май-Грюнвальду, а затем докрашивают по Романовскому — Гимза.
На нефиксированном мазке выдерживают в течение 3 минут 15—20 капель краски Май-Грюнвальд. Затем к краске добавляют такое же количество дистиллированной воды, и после перемешивания выдерживают еще 3 минуты. По истечении этого срока краску сливают, стекло ставят краем на пропускную бумагу, чтобы стекла вода, и на невысохший еще мазок наслаивают свежеприготовленную краску Романовского — Гимза (15—20 капель краски на 10 мл воды). Мазок докрашивают 15—30 минут, смотря по давности его приготовления, после чего краску смывают и высушивают мазок. Если мазки окрашиваются интенсивно, их можно «раскрасить» дистиллированной водой в течение 1 минуты, а затем высушить.
Витальная окраска мазков крови применяется для выявления гранулофиламентозной субстанции в эритроцитах. С этой целью используются бриллианткрезильблау, толлуидинблау, нейтральрот, азур 1. Брил-лианткрезильблау окрашивает быстрее других красок и вместе с тем дает более четкий рисунок субстанции. Для окрашивания применяется раствор краски в разведении 1: 80 на абсолютном спирте.
На слегка подогретое предметное стекло стеклянной палочкой наносят каплю краски и быстро размазывают ее наподобие мазка крови. На стекле образуется едва заметный серовато-фиолетовый налет. Окрашенные таким образом стекла могут храниться в сухом месте продолжительное время. На окрашенной поверхности стекла делают в дальнейшем мазки крови, которые тотчас же вносятся на 3—5 минут во влажную камеру, которую можно изготовить из бактериологических чашек. В нижнюю чашку по ее окружности кладут фильтровальную бумагу, смоченную в воде; в центр чашки помещают две спички, а на них предметное стекло мазком вверх. Затем эту чашку закрывают второй. По истечении указанного времени мазок вынимают из влажной камеры и высушивают.
Витально окрашенные мазки можно дополнительно обработать краской Романовского — Гимза или Лейшмана, что дает очень красивые мазки, но при этом исчезает часть субстанции.
Для устранения этого недостатка витально окрашенный мазок докрашивают предварительно 1 % спиртовым раствором метиленовой синьки в течение 1—2 минут и в последующем по методу Лейшмана (А. В. Васильев). Субстанция при таком окрашивании количественно не уменьшается и становится рельефной.
Окраска толстой капли. Исследование в толстой капле осуществляется с целью подсчета эозинофилов и установления наличия кровопаразитов.
Помещенную на предметное стекло крупную каплю крови препаровальной иглой размазывают до величины 10-копеечной монеты и высушивают на воздухе в течение 20—30 минут. На высушенный и нефиксированный препарат наливают раствор краски Романовского — Гимза. Краска быстро гемолизирует эритроциты и, разлагаясь, образует красное облачко на поверхности жидкости. Раствор краски через 3 минуты осторожно сливают, приподнимая для этой цели или стекло, или же чашку, над которой производится окрашивание. Остатки первой порции краски осторожно смывают прилива-нием сбоку новой порции краски. Повторив эту манипуляцию еще раз, оставляют краску Романовского — Гимза на стекле минут на 20—30. По истечении указанного времени с теми же предосторожностями сливают краску и, смыв ее дистиллированной водой, высушивают мазок, придав ему вертикальное положение.
Удачное окрашивание характеризуется тем, что середина препарата принимает синеватый или голубоватый цвет, а его края красновато-фиолетовый оттенок. Перекрашенные препараты узнаются по грязно-фиолетовому окрашиванию. Такой же дефект получается при щелочной реакции воды.
В правильно окрашенной толстой капле должны быть отчетливо выражены характерные особенности каждой клетки, а кровопаразиты иметь хорошо прокрашенную протоплазму в голубой цвет и рубиново-красное ядро. При плохой окраске ядра клеток видны неотчетливо, зернистость протоплазмы, а также кровяные пластинки еле заметны.
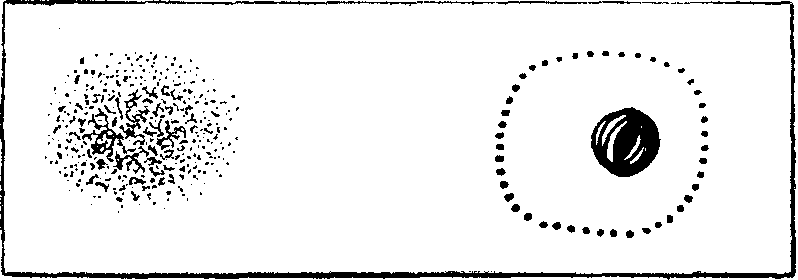
Рис. 183. Толстая кайля.
Ввиду большого значения для клинических целей количества эозинофилов, а также незначительного их содержания в циркулирующей крови число их рекомендуется определять отдельно. При помощи иммерсионной системы подсчитывают от 200 до 500 лейкоцитов и при этом особо фиксируют число эозинофилов. Подсчитав нужное количество лейкоцитов, по формуле выводят процент эозянофилов, например:
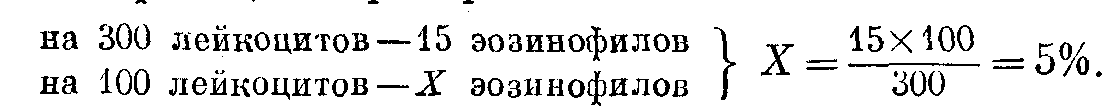
Практически можно полученное количество эозинофилов разделить на цифру подсчитанных сотен лейкоцитов.
МОРФОЛОГИЯ ФОРМЕННЫХ ЭЛЕМЕНТОВ КРОВИ
Эритроциты циркулирующей крови
Основную массу форменных элементов крови представляют красные кровяные тельца. В висячей капле эритроциты находятся в таком огромном количестве, что первое время закрывают все другие элементы; они придают крови ее красный цвет и непрозрачность.
Эритроцитам большинства млекопитающих присуща типичная форма равномерно закругленных, двояковогнутых, безъядерных пластинок. При рассмотрении в профиль они имеют вид бисквитов, a en face — тарелки с темной периферией и светлоокрашенным центром.
У верблюда, оленя и ламы эритроциты циркулирующей крови имеют овальную форму, а эритроциты птиц, кроме того, обладают ядром.
В крови, размазанной на предметном стекле, эритроциты часто складываются в «монетные столбики», в которых каждое тельце наполовину прикрывает рядом с ним лежащее. Это объясняется снятием с них электрического заряда или уменьшением его.
Отдельные эритроциты имеют желтовато-зеленоватый цвет, а толстый слой их кажется красноватым.
Величина эритроцитов различных животных неодинакова.