
- •Кафедра общей и технической физики
- •Лабораторная работа 1
- •Основные теоретические сведения
- •Рис. 8. Структура исследуемого образца
- •Санкт-Петербургский государственный горный институт
- •Кафедра общей и технической физики
- •Лаборатория физики твердого тела и квантовой физики
- •Лабораторная работа 2
- •Кафедра общей и технической физики
- •Лаборатория физики твердого тела и квантовой физики
- •Лабораторная работа 3
- •2.2. Металлы
- •Кафедра общей и технической физики
- •Лаборатория физики твердого тела и квантовой физики
- •Лабораторная работа 4
- •Гальваномагнитные явления в твердых телах
- •Кафедра общей и технической физики
- •Лаборатория физики твердого тела и квантовой физики
- •Лабораторная работа 6
- •Исследование солнечных генераторов электроэнергии
- •Кафедра общей и технической физики
- •Лаборатория физики твердого тела и квантовой физики
- •Лабораторная работа 7
- •Кафедра общей и технической физики
- •Лаборатория физики твердого тела и квантовой физики
- •Лабораторная работа 8
- •Кафедра общей и технической физики
- •Лаборатория физики твердого тела и квантовой физики
- •Лабораторная работа 9
- •Санкт- Петербургский государственный горный институт им. Г.В. Плеханова
- •(технический университет)
- •МЕХАНИКА
- •ОЦЕНКА ТОЧНОСТИ ПРЯМЫХ И КОСВЕННЫХ ИЗМЕРЕНИЙ
- •Таблица 1
- •Таблица 2
- •Контрольные вопросы
- •Санкт- Петербургский государственный горный институт им. Г.В. Плеханова
- •(технический университет)
- •МЕХАНИКА
- •Таблица 1
- •Санкт- Петербургский государственный горный институт им. Г.В. Плеханова
- •(технический университет)
- •МЕХАНИКА
- •Общие сведения
- •Порядок выполнения работы
- •Последовательность проведения измерений следующая:
- •Теоретическое значение момента инерции маятника
- •Контрольные вопросы
- •Санкт- Петербургский государственный горный институт им. Г.В. Плеханова
- •(технический университет)
- •МЕХАНИКА
- •Санкт- Петербургский государственный горный институт им. Г.В. Плеханова
- •(технический университет)
- •МЕХАНИКА
- •Санкт- Петербургский государственный горный институт им. Г.В. Плеханова
- •(технический университет)
- •МЕХАНИКА
- •Санкт- Петербургский государственный горный институт им. Г.В. Плеханова
- •(технический университет)
- •МЕХАНИКА
- •Санкт- Петербургский государственный горный институт им. Г.В. Плеханова
- •(технический университет)
- •МЕХАНИКА
- •МОМЕНТ ИНЕРЦИИ РАЗЛИЧНЫХ ТЕЛ. ТЕОРЕМА ШТЕЙНЕРА
- •Цель работы – измерить моменты инерции различных тел. Проверить теорему Штейнера.
- •Санкт- Петербургский государственный горный институт им. Г.В. Плеханова
- •(технический университет)
- •МЕХАНИКА
- •Общие сведения
- •Санкт- Петербургский государственный горный институт им. Г.В. Плеханова
- •(технический университет)
- •МЕХАНИКА
- •Общие сведения
- •Санкт- Петербургский государственный горный институт им. Г.В. Плеханова
- •(технический университет)
- •МЕХАНИКА
- •ВЫЧИСЛЕНИЕ ПОГРЕШНОСТИ ПРИ ПРЯМЫХ ИЗМЕРЕНИЯХ
- •Кафедра общей и технической физики
- •Лабораторная работа 1
- •Основные теоретические сведения
- •Рис. 8. Структура исследуемого образца
- •3. ОПРЕДЕЛЕНИЕ ПОКАЗАТЕЛЯ ПРЕЛОМЛЕНИЯ ВОЗДУХА ИНТЕРФЕРОМЕТРОМ ЖАМЕНА
- •Теоретические аспекты.
- •Описание установки.
- •Порядок выполнения работы.
- •Описание установки.
- •Порядок выполнения работы.
- •5. ИЗМЕРЕНИЕ РАЗРЕШАЮЩЕЙ СПОСОБНОСТИ ОБЪЕКТИВОВ
- •Описание установки.
- •Порядок выполнения работы.
- •Таблица 2
- •6. ИССЛЕДОВАНИЕ ПОЛЯРИЗОВАННОГО СВЕТА
- •Описание установки.
- •Задание 1. Исследование поляризации лазерного излучения.
- •Задание 2. Изучение закона Малюса.
- •Таблица 1
- •Задание 3. Изучение эллиптической поляризации.
- •Таблица 2
- •Задание 4. Исследование круговой поляризации.
- •7. ОПРЕДЕЛЕНИЕ КОНЦЕНТРАЦИИ САХАРНОГО РАСТВОРА САХАРИМЕТРОМ
- •Общие сведения
- •Описание установки
- •Порядок выполнения работы
- •Описание установки.
- •Снятие отсчета по лимбу
- •Порядок выполнения.
- •часть I. Определение преломляющего угла призмы
- •Таблица 1
- •Таблица 2
- •Часть III. Построение кривой дисперсии.
- •Таблица 3
- •Экспериментальная установка и порядок ее настройки
- •САНКТ-ПЕТЕРБУРГ
- •Теоретические основы лабораторной работы
- •Порядок выполнения эксперимента
- •Обработка результатов измерений
- •Содержание отчёта
- •Контрольные вопросы
- •САНКТ-ПЕТЕРБУРГ
- •Теоретические основы лабораторной работы
- •Порядок выполнения работы
- •Содержание отчета
- •Контрольные вопросы
- •САНКТ-ПЕТЕРБУРГ
- •Теоретические основы лабораторной работы
- •Порядок выполнения работы
- •Обработка результатов
- •Обработка результатов
- •Содержание отчета:
- •Контрольные вопросы
- •САНКТ-ПЕТЕРБУРГ
- •Теоретические основы лабораторной работы
- •Электрическая схема установки
- •Порядок выполнения работы
- •Обработка результатов измерений
- •Содержание отчёта
- •Контрольные вопросы
- •САНКТ-ПЕТЕРБУРГ
- •Теоретические основы лабораторной работы
- •Схема установки
- •Порядок выполнения работы
- •Обработка результатов
- •Содержание отчета
- •Контрольные вопросы
- •2. ИССЛЕДОВАНИЕ ЗАВИСИМОСТИ КОЭФФИЦИЕНТА ПОГЛОЩЕНИЯ ЖИДКОСТИ ОТ ДЛИНЫ ВОЛНЫ.
- •Порядок выполнения работы.
- •ТЕОРЕТИЧЕСКИЕ АСПЕКТЫ
- •ОПИСАНИЕ УСТАНОВКИ
- •Порядок выполнения работы.
- •Санкт- Петербургский государственный горный институт им. Г.В. Плеханова
- •(технический университет)
- •МЕХАНИКА
- •Описание установки
- •Пояснение к схеме:
- •Краткая теория
- •Санкт- Петербургский государственный горный институт им. Г.В. Плеханова
- •(технический университет)
- •МЕХАНИКА
- •ИЗУЧЕНИЕ ИЗОПРОЦЕССОВ В ГАЗАХ
- •Экспериментальная установка
- •Порядок выполнения работы
- •Санкт- Петербургский государственный горный институт им. Г.В. Плеханова
- •(технический университет)
- •МЕХАНИКА
- •Санкт- Петербургский государственный горный институт им. Г.В. Плеханова
- •(технический университет)
- •МЕХАНИКА
- •Описание экспериментальной установки
- •САНКТ-ПЕТЕРБУРГ
- •Теоретические основы лабораторной работы
- •Порядок выполнения работы
- •2. Исследование основных параметров колебательного контура и обработка результатов
- •Содержание отчёта
- •Контрольные вопросы
- •Приложение
- •Методические указания к лабораторной работе № 5
- •САНКТ-ПЕТЕРБУРГ
- •Теоретические основы лабораторной работы
- •Порядок выполнения работы
- •Исследование основных параметров резистивно-индуктивной цепи
- •Обработка результатов
- •Содержание отчёта
- •Контрольные вопросы
- •Методические указания к лабораторной работе № 6
- •САНКТ-ПЕТЕРБУРГ
- •Теоретические основы лабораторной работы
- •Порядок выполнения работы
- •Содержание отчёта
- •Контрольные вопросы
- •САНКТ-ПЕТЕРБУРГ
- •Теоретические основы лабораторной работы
- •Измерительная установка и электрическая схема
- •Порядок выполнения эксперимента.
- •Обработка результатов измерений
- •Содержание отчёта
- •Контрольные вопросы:
- •Экспериментальная установка
- •САНКТ-ПЕТЕРБУРГ
- •Теоретические основы лабораторной работы
- •Схема установки
- •Порядок выполнения работы.
- •Обработка результатов.
- •Содержание отчета
- •Контрольные вопросы
- •Приложение
- •Методические указания к лабораторной работе № 9
- •САНКТ-ПЕТЕРБУРГ
- •Теоретические основы лабораторной работы
- •Порядок выполнения работы
- •Обработка результатов измерений
- •Содержание отчета
- •Контрольные вопросы
- •САНКТ-ПЕТЕРБУРГ
- •Теоретические основы лабораторной работы
- •Измерительная установка и электрическая схема
- •Методика измерений
- •Порядок выполнения работы
- •Обработка результатов измерений
- •Содержание отчёта
- •Контрольные вопросы
- •Работа № 12 Исследование эффекта Джоуля-Томпсона при адиабатическом истечении газа
- •Работа № 17 Определение теплопроводности газов методом нагретой нити
- •Кафедра Общей и технической физики
- •Термодинамика, теплопередача, тепло и массообмен
- •ФИЗИКА
- •Работа №1 Газовые законы. Тарировка газового термометра
- •Работа №2 Цикл тепловой машины
- •Работа № 6 Определение теплоемкости твердого тела
- •Работа № 8 Определение показателя адиабаты при адиабатическом расширении газа
- •Экспериментальная установка
- •Работа № 10 Определение коэффициента термического расширения (линейного) твердого тела
- •Работа № 11 Определение коэффициента термического расширения (объемного) жидкости
- •Работа № 12 Исследование эффекта Джоуля-Томпсона при адиабатическом истечении газа
- •ЗАДАНИЕ
- •Работа № 13 Исследование диффузии газов
- •Работа № 17 Определение теплопроводности газов методом нагретой нити
- •Работа № 18 Определение теплопроводности твердого тела (пластина)
- •Санкт- Петербургский государственный горный институт им. Г.В. Плеханова
- •(технический университет)
- •ФИЗИКА НА КОМПЬЮТЕРЕ
- •Санкт- Петербургский государственный горный институт им. Г.В. Плеханова
- •(технический университет)
- •ФИЗИКА НА КОМПЬЮТЕРЕ
- •Санкт- Петербургский государственный горный институт им. Г.В. Плеханова
- •(технический университет)
- •ФИЗИКА НА КОМПЬЮТЕРЕ
- •Санкт- Петербургский государственный горный институт им. Г.В. Плеханова
- •(технический университет)
- •ФИЗИКА НА КОМПЬЮТЕРЕ
- •Санкт- Петербургский государственный горный институт им. Г.В. Плеханова
- •(технический университет)
- •ФИЗИКА НА КОМПЬЮТЕРЕ
- •Санкт- Петербургский государственный горный институт им. Г.В. Плеханова
- •(технический университет)
- •ФИЗИКА НА КОМПЬЮТЕРЕ
- •Санкт- Петербургский государственный горный институт им. Г.В. Плеханова
- •(технический университет)
- •ФИЗИКА НА КОМПЬЮТЕРЕ
- •Санкт- Петербургский государственный горный институт им. Г.В. Плеханова
- •(технический университет)
- •ФИЗИКА НА КОМПЬЮТЕРЕ
- •Санкт- Петербургский государственный горный институт им. Г.В. Плеханова
- •(технический университет)
- •ФИЗИКА НА КОМПЬЮТЕРЕ
- •Санкт- Петербургский государственный горный институт им. Г.В. Плеханова
- •(технический университет)
- •ФИЗИКА НА КОМПЬЮТЕРЕ
- •САНКТ-ПЕТЕРБУРГ
- •Теоретические основы лабораторной работы
- •Схема установки
- •Порядок выполнения работы
- •Обработка результатов
- •Содержание отчёта
- •Контрольные вопросы
- •САНКТ-ПЕТЕРБУРГ
- •Теоретические основы лабораторной работы
- •Порядок выполнения эксперимента
- •Обработка результатов измерений
- •Содержание отчёта
- •Контрольные вопросы
- •САНКТ-ПЕТЕРБУРГ
- •Теоретические основы лабораторной работы
- •Описание установки
- •Порядок выполнения
- •Обработка результатов
- •Содержание отчета
- •Контрольные вопросы
- •САНКТ-ПЕТЕРБУРГ
- •САНКТ-ПЕТЕРБУРГ
- •САНКТ-ПЕТЕРБУРГ
- •САНКТ-ПЕТЕРБУРГ
- •САНКТ-ПЕТЕРБУРГ
- •САНКТ-ПЕТЕРБУРГ
- •САНКТ-ПЕТЕРБУРГ
- •САНКТ-ПЕТЕРБУРГ
- •САНКТ-ПЕТЕРБУРГ
- •САНКТ-ПЕТЕРБУРГ
- •САНКТ-ПЕТЕРБУРГ
- •САНКТ-ПЕТЕРБУРГ
- •САНКТ-ПЕТЕРБУРГ
- •САНКТ-ПЕТЕРБУРГ
- •САНКТ-ПЕТЕРБУРГ
- •Экспериментальная установка
- •САНКТ-ПЕТЕРБУРГ
- •Экспериментальная установка
- •10.2. Состав
- •САНКТ-ПЕТЕРБУРГ
- •САНКТ-ПЕТЕРБУРГ
- •САНКТ-ПЕТЕРБУРГ
vk.com/club152685050 | vk.com/id446425943
Федеральное агентство по образованию
Государственное образовательное учреждение высшего профессионального образования
Санкт-Петербургский государственный горный институт имени Г.В. Плеханова (технический университет)
Кафедра Общей и технической физики
(лаборатория виртуальных экспериментов)
Исследование эффекта Джоуля-Томпсона при адиабатическом истечении газа
Методические указания к лабораторной работе № 12 для студентов всех специальностей
САНКТ-ПЕТЕРБУРГ
2010
vk.com/club152685050 | vk.com/id446425943
УДК 531/534 (075.83)
СТАТИСТИЧЕСКАЯ ФИЗИКА И ТЕРМОДИНАМИКА:
Лабораторный практикум курса общей физики. Смирнова Н.Н., Фицак В.В. Чернобай В.И. / Санкт-Петербургский горный институт. С-Пб, 2010, 14 с.
Лабораторный практикум курса общей физики по статистической физике и термодинамике предназначен для студентов всех специальностей Санкт-
Петербургского горного института.
С помощью учебного пособия студент имеет возможность, в предварительном плане, ознакомиться с физическими явлениями, методикой выполнения лабораторного исследования и правилами оформления лабораторных работ.
Выполнение лабораторных работ практикума проводится студентом индивидуально по графику.
Табл. 3. Ил. 2. Библиогр.: 5 назв.
Научный редактор доц. Н.Н. Смирнова
© Санкт-Петербургский горный
институт им. Г.В. Плеханова, 2010 г.
2
vk.com/club152685050 | vk.com/id446425943
Цель работы:
1)определить изменение температуры углекислого газа при протекании через малопроницаемую перегородку при разных начальных значениях давления и температуры;
2)вычислить, по результатам опытов, коэффициенты Ван-дер-
Ваальса "a" и "b".
Молекулярно-кинетическая теория газов основывается на
модели идеального газа. В этой модели пренебрегается размерами молекул по сравнению с расстоянием между ними, т.е. молекулы рассматриваются как материальные точки. Кроме того, пренебрегается силами взаимодействия между молекулами (за исключением моментов столкновения). Обычные газы при невысоких давлениях можно рассматривать как идеальные.
Уравнение состояния для идеального газа это уравнение Менделеева - Клапейрона. Для одного моля газа оно имеет вид:
P Vm R T
При больших давлениях расстояния между молекулами мало, и размерами молекул уже нельзя пренебрегать по сравнению с этим расстоянием. Кроме того, при малых расстояниях между молекулами следует учитывать взаимодействие между ними (силы притяжения и отталкивания). Поэтому при высоких давлениях свойства реальных газов отличаются от свойств идеальных газов.
Состояние реальных газов описывается уравнением Ван-дер-
Ваальса, которое имеет вид (для одного моля)
|
|
|
|
a |
|
|
|
||
|
P |
|
|
|
V b R T |
|
|||
|
V |
2 |
|
||||||
|
|
|
|
|
|
|
|||
|
Здесь a и b |
– |
константы |
Ван-дер-Ваальса. |
Поправка |
||||
a |
дает внутреннее |
давление pi, |
обусловленное |
взаимным |
|||||
V 2 |
|||||||||
|
|
|
|
|
|
|
|
||
притяжением молекул друг к другу. Константа b – определяет ту
часть объема, которая недоступна для движения молекул вследствие их конечных размеров.
3

vk.com/club152685050 | vk.com/id446425943
Внутренняя энергия идеального газа состоит из кинетической энергии, движения молекул и потенциальной энергии взаимодействия молекул
U U k U u
Кинетическая энергия зависит только от температуры газа Т
U k CV T
Где СV – молярная теплоемкость при постоянном объеме.
Потенциальная энергия взаимодействия молекул зависит от их расстояния друг от друга и, следовательно, от объема занимаемого газом. При расширении газа должна быть совершена работа по преодолению сил притяжения между молекулами, т.е.
против внутреннего давления pi |
a |
||
|
|
. |
|
V |
2 |
||
|
|
|
|
Эта работа идет на увеличение потенциальной энергии
dU n |
pi |
dV |
a |
dV |
|
||||
|
|
V 2 |
|
|
Интегрирование этого выражения дает для потенциальной энергии
U n a V
Таким образом, внутренняя энергия реального газа является функцией двух параметров: Т и V
U U k U n CvT a V
Для идеального газа взаимодействием между молекулами пренебрегается, поэтому внутренняя энергия идеального газа состоит только из кинетической энергии молекул и зависит только от температуры.
Согласно первому закону термодинамики количество тепла, подводимого к системе, идет на приращение внутренней энергии системы и на совершение этой системой работы A над внешними
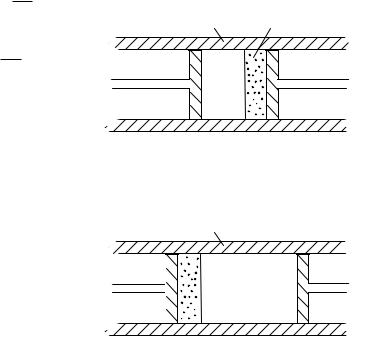
телами Q U A
4
vk.com/club152685050 | vk.com/id446425943 |
|
||||||||
|
Если газ расширяться адиабатическим, т.е. |
без теплообмена |
|||||||
с окружающей средой, то Q=0 |
|
|
|
|
|||||
|
|
|
|
0 U A |
U A |
|
|
||
|
Если при адиабатическом расширении газ не будет |
|
|||||||
совершать внешней работы (А=0) (при расширении в пустоту), то |
|
||||||||
U 0 |
|
|
|
|
|
|
|
|
|
U C |
T a V 0 |
|
|
|
|
||||
|
V |
|
V 2 |
|
Т |
|
П |
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
||
CV T a2 |
V |
K1 |
P |
K2 |
|
||||
|
|
|
V |
|
|
|
|
||
|
Отсюда |
следует, |
|
1 |
|
|
|||
|
|
V1 |
|
||||||
что |
T |
и |
V имеют |
|
|
||||
|
|
|
|
||||||
разные |
знаки. |
|
При |
|
|
|
|
||
расширении V>0, T <0. |
1 |
|
2 |
|
|||||
Следовательно, |
|
при |
|
|
|||||
|
|
|
|
|
|||||
адиабатическом |
пустоту |
|
|
а) |
|
||||
расширении |
в |
|
|
|
|
||||
реальный |
|
газ |
должен |
|
|
|
|
||
охлаждаться. |
|
|
Т |
|
|
|
|||
|
В случаях |
|
|
|
|
|
|
||
идеального газа в этих |
|
|
P |
|
|||||
условиях |
|
|
|
|
K1 |
|
K2 |
||
|
|
|
|
|
|
||||
U CV T |
0 T |
|
|
2 |
|
||||
|
|
V2 |
|
||||||
|
=0 |
|
Т=const |
|
|
|
|
|
|
|
Т.е |
|
|
при |
1′ |
|
2′ |
|
|
адиабатическом |
|
|
|
|
|||||
расширении |
идеального |
|
|
б) |
|
||||
газа |
в |
пустоту |
его |
|
|
|
|||
температура |
не |
должна |
|
Рис.1 |
|
||||
меняться. |
|
|
|
|
|
|
|||
|
В середине XIX века английские ученые Джоуль и |
||||||||
|
|
|
|||||||
Томсон экспериментально обнаружили, что при адиабатическом |
|||||||||
расширении газа без совершения им полезной работы температура |
|||||||||
5
vk.com/club152685050 | vk.com/id446425943
газа изменяется. Это явление получило название эффекта Джоуля-
Томсона.
Схема опыта Джоуля-Томсона приведена на рис. 1. В
хорошо теплоизолированную трубу вставлена пористая перегородка (пробка). Слева и справа от пробки поддерживаются постоянные
давления p1и p2 (p1> p2). Под действием перепада давлений p=p1- p2 газ продавливается через пробку и при этом адиабатически расширяется от давления р1 до давления р2. Измерялась разность
температур T=T2-T1
Представим себе, что определенная порция газа, например, 1 моль, протекает слева направо через пористую перегородку П. Вначале этот газ занимает объем V1 между перегородкой и сечением 1, а после прохождения перегородки, т.е. после расширения, - объем V2 между перегородкой и сечением 2’. Для наглядности поместим
мысленно в сечение 1 поршень перемещение которого вправо и вызывает протекание газа через перегородку под постоянным давлением p1. После прохождения через перегородку этот же газ перемещает воображаемый поршень K2 из положения 2 в положение 2’. В действительности роль поршней K1 и K2 выполняет
компрессор.
На основании первого закона термодинамики можно написать
Q U A
Так как труба теплоизолированная , то процесс расширения будет адиабатическим
(1)
-работа, произведенная над газом при вытеснении его из объема
-работа, произведенная газом при перемещении поршня справа от
перегородки Тогда уравнение (1) запишется так
6

vk.com/club152685050 | vk.com/id446425943
(2)
Преобразуем равенство (2), сделав некоторые упрощения. В левой части давление большое, поэтому газ здесь будем считать
реальным, а в правой части давление |
невелико и, следовательно, |
газ можно считать идеальным. |
|
Тогда |
(3) |
(4)- Из уравнения Ван-дер-Ваальса
(5)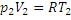 (6)
(6)
Подставим (3),(4),(5) и (6) в формулу (2)
(7)
Третье слагаемое можно записать в виде
(8)
С учетом этого уравнение(7) перепишется так
Отсюда получим формулу для изменения температуры газа при протекании через пористую перегородку
|
|
(9) |
Как видно, знак |
определяется знаком |
выражения, |
стоящего в скобках. |
|
|
Если можно пренебречь поправкой а (а=0), то |
>0, |
|
т.е при расширении газ нагревается. Это отрицательный эффект
Джоуля -Томсона |
|
Если можно пренебречь поправкой b (b=0), то |
<0, |
газ охлаждается. Это положительный эффект Джоуля- Томсона.
Для одного и того же газа в зависимости от его температуры и давления, может играть большую роль то поправка а, то поправка b. Поэтому один и тот же газ в зависимости от внешних условий
7
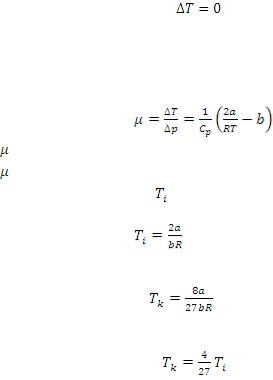
vk.com/club152685050 | vk.com/id446425943
может давать или положительный, или отрицательный эффект Джоуля-Томсона.
При некоторых условиях (скобка в уравнении (9) равна 0) может быть нулевой эффект. Эта температура называется
температурой инверсии. |
|
|
Из |
формулы (9) видно |
также, что для идеального газа |
(поправки |
а и b равны 0) |
то есть температура идеального |
газа при таком расширении не меняется, т.е эффект Джоуля-
Томсона отсутствует .
Для количественной оценки эффекта вводится коэффициент Джоуля-Томсона. При некоторых упрощающих предположениях он
имеет вид
(10)
<0-отрицательный эффект Джоуля-Томсона >0- положительный эффект Джоуля-Томсона
Температура инверсии получается из равенства нулю скобки в уравнении (10)
(11)
Критическая температура для реальных газов также выражается через поправки а и b
(12)
Сравнивая (11) и (12) получаем следующее простое соотношение между температурой инверсии и критической температурой
(13)
Экспериментальная установка.
Схема установки для исследования эффекта Джоуля-
Томсона в углекислом газе представлена на рисунке. Основным элементом установки является трубка 1 с пористой перегородкой 2,
через которую пропускается исследуемый газ. Трубка сделана из материала, обладающего малой теплопроводностью. Пористая перегородка 2 расположена в конце трубки и представляет собой
8
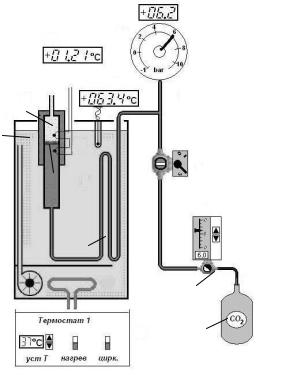
vk.com/club152685050 | vk.com/id446425943
стеклянную пористую пробку с множеством узких и длинных каналов. Пористость и толщина пробки подобраны так, чтобы обеспечить оптимальный поток газа при перепаде давлений до 10 атм.; при этом в результате эффекта Джоуля-Томсона создается
достаточная разность температур. Газ поступает
втрубку из
термочстатичсесчкого |
|
|
6 |
|
||||
|
|
|
|
|||||
объёма 8, в котором |
|
|
|
|||||
нагревается змеевик 9 до |
|
12 |
|
|||||
температуры |
|
|
воды |
в |
3 |
|
|
|
термостате. |
|
Температура |
11 |
|
||||
|
|
|
||||||
воды |
|
|
измеряется |
1 |
|
|
||
|
|
|
|
|
|
|
|
|
термопарой |
|
|
11 |
и |
|
4 |
|
|
отображается |
|
|
на |
|
|
|
||
индикаторе |
|
7, |
разность |
|
2 |
|
||
температур |
до |
и после |
|
8 |
|
|||
перегородки |
|
измеряется |
|
|
||||
|
|
|
|
|||||
дифференциальной |
и |
|
|
12 |
||||
термопарой |
|
|
4 |
|
9 |
|
||
отображается |
|
|
на |
|
|
|
||
индикаторе 6. |
|
|
|
|
|
10 |
||
Газ |
поступает |
в |
|
|
||||
|
|
|
||||||
систему |
из |
|
баллона |
13 |
|
7 |
|
|
через |
редуктор |
12, |
|
13 |
||||
|
|
|
|
|
|
|
|
|
который |
|
|
|
позволяет |
|
|
|
|
регулировать |
|
давление |
|
|
|
|||
газа в магистрали. Кран 10 позволяет перекрыть поток газа, давление контролируется манометром 11.
ТЭН управляется с пульта 7. Пульт содержит задатчик
температуры (в С), переключатели "НАГРЕВ" и "ЦИРК". Переключатель "НАГРЕВ" включает режим поддержания температуры воды внутри термостата равной заданной, при выключенном переключателе "НАГРЕВ" температура воды устанавливается равной комнатной. Индикацией включения нагрева
9
vk.com/club152685050 | vk.com/id446425943
является окрашивание в красный цвет изображения ТЭНа внутри термостата. Переключатель "ЦИРК" включает или выключает циркуляцию воды через водяную рубашку трубы 1. Индикацией включения циркуляции является вращение крыльчатки насоса внутри термостата.
В процессе протекания через пористую перегородку газ испытывает существенное трение, приводящее к ее нагреву. Потери энергии на нагрев трубки в начале процесса могут быть очень существенными и сильно искажают ход явления. После того как температура трубки установится и газ станет уносить с собой все выделенное им в перегородке тепло, формула [1] становится точной, если, конечно, теплоизоляция трубки достаточно хороша и не происходит утечек тепла наружу через ее стенки.
ЗАДАНИЕ
1.Запустите работу.
2.Установите на пульте термостата температуру регулирования
20 С, включите термостат в режим "НАГРЕВ" и "ЦИРК".
3.Откройте регулирующий вентиль 12 настолько, чтобы избыточное
давление составило 8 10 атм. Запишите показания манометра Р.
Откройте кран 10.
4.Через несколько минут после подачи давления, когда полностью
затухнут |
переходные |
процессы, |
запишите |
показания |
дифференциального термометра Т.
5. При помощи вентиля 12 установите давление на 1 атм. меньше
первоначального. Через несколько минут, когда установятся давление и разность температур, вновь запишите показания манометра и дифференциального термометра 6.
Результаты измерений занести в таблицу:
Физ. |
Т |
Р |
Т |
|
|
|
a |
|
b |
ТИНВ |
ТКР |
||
величина |
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Ед. |
о |
|
|
о |
|
|
|
|
|
|
|
|
|
измерений |
С |
Па |
С |
o |
C Па |
Н м |
4 |
м |
3 |
К |
К |
||
|
|
|
|||||||||||
Номер |
|
|
|
моль2 |
моль |
||||||||
опыта |
|
|
|
|
|
|
|
|
|
|
|
|
|
10

vk.com/club152685050 | vk.com/id446425943
1
…
n
6.Проведите измерения для нескольких (5-7) значений давления при
комнатной температуре.
7.Отложив полученные точки на графике T f P , по наклону
графика определите коэффициент Джоуля-Томсона для выбранной
вами температуры.
8.Окончив измерения при комнатной температуре, закройте кран 10 и установите на термостате температуру 40 50 C.
9.Когда температура установится и установка войдет в стационарный режим, повторите измерения, как указано в пунктах
3-7.
10. Окончив измерения, проделайте такие же измерения, как указано в пунктах 3—7, для температуры 70 80 C.
11. Используя формулу |
|
T |
|
2a RT b |
|
|
P |
C P |
|||||
|
|
|
||||
( СP 41 Дж/ моль К , |
R |
– |
газовая постоянная) и |
|||
экспериментальные данные, полученные при трех значениях температуры, определите постоянные a и b для углекислого газа по двум парам температур.
Найдите температуру инверсии ТИНВ и критическую температуру ТКР для углекислого газа при помощи формул:
T |
2 a |
T |
|
4 |
T |
|
|
||||
ИНВ |
R b |
КР |
|
27 |
ИНВ |
|
|
|
|
12. Сравните полученные значения с табличными (табличные
данные соответствуют измерению при критической температуре).
Контрольные вопросы
1. Что можно сказать на основании ваших измерений ТИНВ и ТКР о точности уравнения Ван-дер-Ваальса?
11
vk.com/club152685050 | vk.com/id446425943
БИБЛИОГРАФИЧЕСКИЙ СПИСОК УЧЕБНОЙ ЛИТЕРАТУРЫ
1.Калашников Н.П. Основы физики. М.: Дрофа, 2004. Т. 1
2.Савельев И.В. Курс физики. М.: Наука, 1998. Т. 2.
3.Детлаф А.А., Яворский Б.М. Курс физики. М.: Высшая школа,
2000.
4.Иродов И.Е Электромагнетизм. М.: Бином, 2006.
5.Яворский Б.М., Детлаф А.А. Справочник по физике. М.: Наука,
1998.
12
