
- •Лабораторна робота №1 Комплексонометричне визначення сульфат-іонів у воді
- •Лабораторна робота №2 Окиснюваність води
- •Дослід 1. Визначення перманганатної окиснюваності.
- •Дослід 2. Визначення біохімічного споживання кисню (бск)
- •Лабораторна робота №3 Визначення оптимальної дози коагулянту для обробки води
- •Лабораторна робота №4 Визначення активного й залишкового хлору
- •Дослід 1. Визначення активного хлору.
- •Дослід 2. Визначення хлоропоглинання
- •Лабораторна робота № 5 Дослідження складу активного мулу
- •Додаток 1 Коротка характеристика систематичних ознак організмів активного мулу і біоплівки
- •Додаток 2 Індикаторні організми активного мулу
- •Додаток 3 Біологічний контроль за санітарним станом водойм
- •Рекомендована література
Лабораторна робота №4 Визначення активного й залишкового хлору
Мета роботи: освоєння методики визначення активного хлору у воді.
Матеріальне забезпечення:
колби конічні скляні лабораторні місткістю 250 см3;
посуд мірний лабораторний скляний: циліндри місткістю 50, 100 см3; колби 1000 см3;
піпетки з поділками на 2 і 10 см3;
бюретки місткістю 25 і 50 см3.
Реактиви:
кислота оцтова (ч.д.а), льодяна або ацетатний буферний розчин з рН = 4,5: змішати 102 мл розчину оцтової кислоти (Секв = 1 моль/л) і 98 мл розчину натрій ацетату (СН3СООNa·3H2О) (Секв = 1 моль/л). Отриманий розчин довести дистильованою водою до 1 л;
калій йодид, ч.д.а.;
натрій тіосульфат (Секв = 0,1 моль/л і 0,01 моль/л);
крохмаль, 0,5%-ний розчин. Змішують 5 г розчинного крохмалю ч.д.а. з 50 мл дистильованої води і доливають до 950 мл дистильованої води, що кипить. Розчин консервують додаванням невеликої кількості йодиду ртуті або іншого консерванту, наприклад, саліцилової кислоти;
концентрований стандартний розчин хлорної води. Готують розчин із концентрацією 1000 мг хлору в 1 л, тобто 1 мл розчину містить 1 мг Сl2. Концентрований розчин зберігають у холодному місці. Перед застосуванням у ньому перевіряють вміст хлору.
розбавлений стандартний розчин хлорної води. Готують десятикратним розведенням концентрованого розчину. 1 мл розчину містить 0,1 мг Сl2. Завжди застосовувати свіжоприготований розчин.
Методичні вказівки.
Хлорування – найбільш поширений метод знезаражування води. Знезаражуюча дія хлору полягає в окисленні й руйнуванні речовин, що входять до складу протоплазми клітин бактерій. Але під час хлорування повна стерилізація води не відбувається, в ній залишаються одиничні хлоррезистентні особини, які зберігають життєздатність.
Під
час хлорування воду обробляють
газоподібним хлором або препаратами,
що містять активний хлор – гіпохлоритами
кальцію або натрію, хлорним вапном,
хлор(IV) оксидом, хлорамінами. Активним
називають хлор, який входить до складу

 хлорвміщуючих
речовин і здатний за певного значення
рН виділяти еквівалентну кількість
йоду з водних розчинів калій йодиду.
хлорвміщуючих
речовин і здатний за певного значення
рН виділяти еквівалентну кількість
йоду з водних розчинів калій йодиду.
Хлор взаємодіє з водою (гідроліз хлору) з утворенням гіпохлоритної (хлорнуватистої) кислоти: Cl2 + H2O HCl + HClO.
Гіпохлоритна кислота існує лише в розчині. Рівновага процесу її гідролізу залежить від рН середовища.
Гідроліз натрій гіпохлориту також проходить з утворенням гіпохлоритної кислоти: NaClO + H2ONaOH + HClO.
Розрізняють хлор вільний (молекулярний хлор, хлорнуватиста кислота, гіпохлорит-іони) і зв’язаний (хлор у складі хлорамінів). Вільний хлор в 20-25 разів більш бактерицидний ніж зв’язаний.
Бактерицидний ефект хлору в значній мірі залежить від його початкової дози й тривалості контакту з водою. На руйнування бактеріальних клітин витрачається лише незначна частина хлору, що вводиться у воду. Більша його частина йде на реакції з органічними й мінеральними домішками води, швидкість яких залежить від концентрації хлору, рН, температури води та інших факторів.
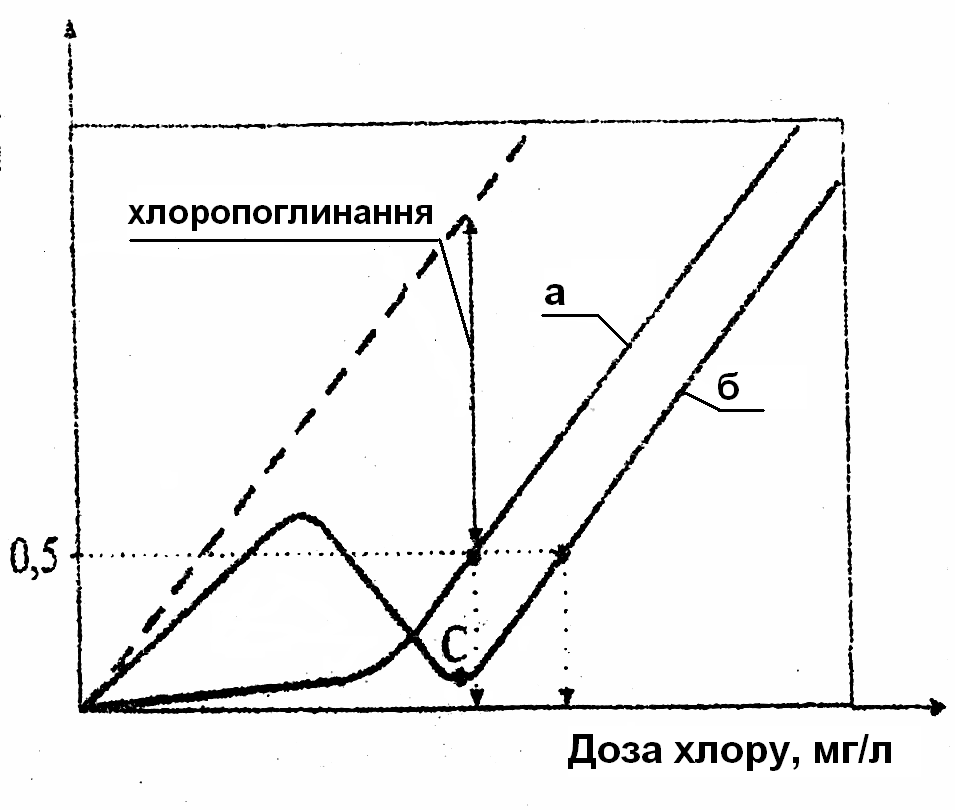
Кількість хлору, яка реагує з домішками, характеризує хлоропоглинання води. До таких речовин слід віднести водний гумус, продукти розпаду клітковини і білкових сполук, солі заліза(II), нітрити, амоніак, солі амонію, сірководень та інші. До деякої міри хлоропоглинання є показником ступеню забрудненості води органічними речовинами. Отже, хлоропоглинання води – це різниця між кількістю введеного у воду хлору і його концентрацією через певний час (здебільшого 30 хвилин).
Хлоропоглинання річкової та озерної води складає 2-2,5 мг/дм3, для води ставків і боліт воно підвищується до 4-5 мг/дм3 Сl2. Різке підвищення хлоропоглинання свідчить про зниження якості води і можливе погіршення її санітарно-бактеріологічних показників. Щоб оцінити хлоропоглинання води, користуються показником хлорованості води, що являє собою дріб, в чисельнику якого одиниця, а в знаменнику – доза хлору, яка забезпечує після 30-хвилинного контакту 0,5 мг/дм3 залишкового хлору.
Н а
рис.4 наведені основні типи кривих
хлоропоглинання. Із збільшенням дози
хлору хлоропоглинання води і концентрація
залишко-вого хлору плавно збільшуються
(рис.4,а).
а
рис.4 наведені основні типи кривих
хлоропоглинання. Із збільшенням дози
хлору хлоропоглинання води і концентрація
залишко-вого хлору плавно збільшуються
(рис.4,а).
Г
Рис.4.
Основні типи кривих хлоропогли-нання:
а
–
за відсутності у воді амоніаку;
б –
в присутності амоніаку;
с – точка
перелому.
У зв’язку зі складною залежністю хлоропоглинання води від ряду факторів, дозу хлору визначають експериментально для конкретних практичних умов.
Для гарантії знезаражуючої дії у воді після хлорування підтримують залишкові концентрації вільного або зв’язаного активного хлору. Відповідно до ГОСТ 2874-82 [2] після 30-хвилинного контакту у воді має залишитись 0,3-0,5 мг/л вільного хлору або після 60 хвилин контакту 0,8-1,2 мг/л зв’язаного хлору.
Хлорування є постійним заходом, що здійснюється на станціях водоочистки та очисних спорудах каналізації. Крім того, воно здійснюється під час уведення в експлуатацію ділянок водопровідної мережі, фільтрів і т.п.
Виходячи з різних цілей хлорування існуючі методи обробки води хлором можна об’єднати у дві основні групи: постхлорування і прехлорування води.
Постхлорування – це процес знезаражування води, який застосовується після усіх інших способів її обробки, тобто є завершальним етапом очищення води.
Постхлорування може проводитись як невеликими (нормальне хлорування) так і підвищеними дозами хлору (перехлорування); воно може застосовуватись і спільно з іншими знезаражуючими реагентами (комбіноване хлорування). Нормальне хлорування застосовується у випадках невеликого забруднення води. Кількість залишкового хлору після 30 хвилин контакту води з хлором допускається не більше 0,5 мг/л.
Перехлорування застосовується тоді, коли нормальне хлорування не дає необхідного бактерицидного ефекту або призводить до погіршення органолептичних показників якості води, наприклад, за наявності у воді фенолів. Перехлоруванням ліквідують багато неприємних присмаків, запахів, знищують бактерії, очищують воду від деяких отруйних речовин. Надлишок хлору, який перевищує допустиму у воді норму, видаляється дехлоруванням.
Прехлорування води проводиться перед іншими методами її обробки. Його використовують для покращення деяких процесів очищення води, наприклад коагуляції, знебарвлення, відстоювання, при зараженні деякими отруйними речовинами і значному бактеріальному забрудненні. Після прехлорування воду не потрібно дехлорувати, оскільки зайвий хлор видаляється під час подальших процесів обробки води.
Вміст активного хлору визначається у питній воді, яку дезинфікують хлором, у стічних водах, які хлорували, або які містять хлор і його сполуки. В поверхневих водах вміст хлору визначається нижче скиду стічних вод, що містять хлор.
Принцип визначення:
Для визначення активного хлору користуються йодометричним методом або колориметричним методом із застосуванням о-толідину.
Йодометричним методом визначають 0,05 мг/л і більше вільного хлору в пробі об’ємом 500 мл. Колориметричний метод дозволяє визначити від 0,01 до 7 мг/л хлору. Результати визначення виражають у міліграмах хлору (Сl2) на 1 л води.
Йодометричний метод ґрунтується на тому, що хлор виділяє йод із розчину йодиду за рівнянням:
Сl2 + 2КІ → І2 + 2КСl.
Йод, що виділився, титрують розчином натрій тіосульфату в присутності крохмалю в кислому середовищі (йод із крохмалем утворює комплексну сполуку синього кольору). Під час цього відбувається реакція:
І2 + 2Nа2S2O3 = 2NаІ + Nа2S4O6.
Розчин знебарвлюється, коли увесь йод зв’язується натрій тіосульфатом. Натрій йодид і тетратіонат, які утворюються під час титрування, із крохмалем забарвлених сполук не утворюють.
Проби для визначення активного хлору не можна консервувати. Визначення слід проводити безпосередньо після відбору проби.
Принцип визначення хлоропоглинання ґрунтується на тому, що до проб досліджуваної води додають відому кількість хлору. Після 30 хвилин контакту (у темному місці при 20°С) визначають залишковий хлор йодометричним способом.
Хід визначення.
